Когнитивные нарушения у пациентов с метаболическим синдромом
- Аннотация
- Статья
- Ссылки
- English
Одним из самых распространенных нарушений обмена веществ является метаболический синдром. Среди взрослых его частота, по данным разных авторов, составляет 15–30%. В ближайшие 20 лет ожидается увеличение числа таких пациентов на 50%. Тесная взаимосвязь метаболического синдрома с сердечно-сосудистой и неврологической патологией определяет важность своевременной диагностики и терапии имеющихся нарушений.
Метаболический синдром
Метаболический синдром характеризуется сочетанием абдоминального (висцерального) ожирения с дислипидемией (высоким уровнем триглицеридов при относительно низком уровне липопротеинов высокой плотности), артериальной гипертензией, гипергликемией вследствие нарушения толерантности к глюкозе или сахарного диабета (СД) 2 типа.
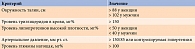
Метаболический синдром принято диагностировать при наличии трех и более из пяти критериев NCEP–ATP III (National Cholesterol Education Program – Adult Treatment Panel) (см. таблицу). Согласно данным критериям метаболический синдром может быть констатирован у пациентов с нарушением толерантности к глюкозе и дислипидемией даже в отсутствие признаков СД и артериальной гипертензии [1–4].
Примерно 40% лиц старше 50 лет имеют признаки метаболического синдрома, который является одним из важнейших факторов риска развития сердечно-сосудистых и цереброваскулярных заболеваний.
G.M. Reaven (1988), назвавший данное состояние «синдромом X», первым указал на ключевую роль инсулинорезистентности в развитии основных компонентов метаболического синдрома [5]. Снижение чувствительности периферических тканей к инсулину приводит к увеличению продукции инсулина и повышению уровня глюкозы в крови, периферических тканях и центральной нервной системе. Первоначально инсулинорезистентность проявляется лишь как нарушение толерантности к глюкозе, поскольку поджелудочная железа в состоянии вырабатывать достаточно инсулина, чтобы поддерживать уровень глюкозы ниже критического уровня, позволяющего диагностировать СД. Со временем секреция инсулина снижается, хотя его повышенный уровень в крови может сохраняться за счет уменьшения метаболизма. В результате уровень глюкозы в крови растет и со временем превышает порог, позволяющий диагностировать СД 2 типа [6, 7].
Непосредственные причины инсулинорезистентности остаются понятными. Некоторое значение, по-видимому, имеет наследственная предрасположенность [2].
Однако основным фактором развития метаболического синдрома считается висцеральное ожирение вследствие гиподинамии и несбалансированного питания. Вырабатываемые жировыми клетками соединения (прежде всего фактор некроза опухоли альфа (ФНО-альфа)) не только способны блокировать инсулиновые рецепторы, вызывая инсулинорезистентность, но и приводят к развитию системного воспалительного процесса. Длительная периферическая гиперинсулинемия приводит к уменьшению транспорта инсулина через гематоэнцефалический барьер (ГЭБ), результатом является снижение его уровня в мозге [2, 8–10].
Церебральные эффекты инсулина
Длительное время считалось, что инсулин не играет сколько-нибудь значительной роли в деятельности мозга, хотя бы в силу того, что сам размер молекулы инсулина препятствует ее проникновению через ГЭБ. Однако в последующем оказалось, что инсулин пересекает ГЭБ с помощью специального переносчика и, более того, синтезируется клетками коры и гиппокампа [3]. И хотя он не играет в мозговой ткани той роли в утилизации глюкозы, которую выполняет в периферических тканях, его функции в мозге весьма заметны, хотя и недостаточно изучены [5, 6].
Рецепторы инсулина в головном мозге выявлены преимущественно в лимбических структурах (обонятельных луковицах, гиппокампе, гипоталамусе, миндалине, перегородке), а также в коре головного мозга. Значительная численность рецепторов инсулина в гиппокампе и средней височной коре указывает на его участие в процессах памяти. Экспериментальные и нейровизуализационные исследования подтверждают роль инсулина в регуляции когнитивных процессов. Так, введение инсулина сопряжено с увеличением нейрональной активности в теменной области и стимуляцией когнитивных процессов [11].
Кроме того, инсулин в головном мозге способствует клиренсу бета-амилоида, усиливая его выведение в цереброспинальную жидкость, а также снижает его синтез в клетках мозга [9].
Метаболический синдром и когнитивные нарушения
В целом ряде исследований показано, что у пациентов с метаболическим синдромом повышен риск развития когнитивных нарушений, как преддементных, так и достигающих степени деменции [11, 12–18]. При этом влияние инсулинорезистентности на когнитивные функции нельзя объяснить лишь пожилым возрастом больных или другими метаболическими нарушениями, связанными со старением. Даже молодые люди с нарушением толерантности к глюкозе хуже выполняли тесты на логическую и ассоциативную память, независимо от уровня глюкозы в крови в момент тестирования [11]. У лиц среднего возраста (40–59 лет) с нарушением толерантности к глюкозе также отмечено снижение показателей тестов, оценивающих нейродинамические и мнестические процессы (независимое от влияния других факторов) относительно возрастной нормы. Аналогичное когнитивное снижение отмечено у лиц среднего возраста с СД 2 типа [13, 15, 17, 19].
С возрастом когнитивные нарушения, обусловленные инсулинорезистентностью, имеют тенденцию к нарастанию, даже в отсутствие СД 2 типа, при этом преимущественно ухудшается выполнение тестов на внимание, регуляторные функции, слухоречевую память с немедленным и отсроченным воспроизведением, что указывает на преобладание подкорково-лобного типа нейропсихологических нарушений. Зрительно-пространственные и речевые функции остаются относительно сохранными.
Отмечена связь метаболического синдрома с развитием депрессии, что также может вносить вклад в развитие когнитивной дисфункции и согласуется с подкорково-лобным нейропсихологическим профилем. У пациентов с умеренным когнитивным расстройством, страдающих метаболическим синдромом, риск конверсии в деменцию повышается примерно в 2 раза [3, 13].
Показано, что когнитивный дефицит может уменьшаться при хорошем контроле уровня глюкозы в крови. Однако когнитивные нарушения при инсулинорезистентности могут быть необратимыми, особенно при умеренном и тяжелом СД 2 типа, и продолжать нарастать с увеличением возраста и длительности заболевания [10].
Механизм развития когнитивных нарушений при метаболическом синдроме
Неблагоприятное влияние на деятельность мозга могут оказывать все основные клинические составляющие метаболического синдрома, прежде всего артериальная гипертензия, ожирение и гипергликемия. При комбинации нескольких факторов риск развития когнитивных расстройств существенно увеличивается. В то же время показано, что когнитивное снижение в большей степени зависит от инсулинорезистентности [3, 10, 13, 20].
Влияние инсулинорезистентности может быть опосредовано изменением уровня глюкозы в крови. Головной мозг крайне чувствителен к изменению уровня глюкозы, так как, составляя только 2% от общей массы тела, потребляет примерно 25% доступной глюкозы. При общей тенденции к гипергликемии при метаболическом синдроме уровень глюкозы становится более вариабельным, что не может не сказываться на работе мозга.
Риск умеренных когнитивных нарушений повышается с увеличением уровня гликированного гемоглобина как у больных СД, так и у больных без СД.
Гиппокамп и лобные доли можно считать основными мишенями метаболического синдрома. Это может быть связано с более высокой потребностью в глюкозе и предопределять особую уязвимость данных структур к дизрегуляции ее уровня, а также высокую частоту нарушений памяти и регуляторных функций [8, 14, 19, 21].
Предполагают, что повышение активности гиппокампа, сопровождающееся усиленным расходованием глюкозы, может приводить к функциональной гипогликемии, что нарушает течение мнестических процессов. Так как глюкоза пассивно не проникает через ГЭБ, ее транспорт обеспечивается специальными белками-переносчиками (GLUT), особенно GLUT-1, локализующимся в эндотелиальных клетках кровеносных сосудов. Чтобы компенсировать повышенный расход глюкозы, должны расшириться мелкие сосуды, в результате больше транспортеров GLUT-1 контактируют с кровью (рекрутирование капилляров). Этот процесс нарушается при инсулинорезистентности, в результате острое снижение уровня глюкозы в гиппокампе и, возможно, в других мозговых структурах при их активации остается некомпенсированным, что ведет к функциональной гипогликемии и развитию когнитивного дефицита. Со временем хроническая функциональная гипогликемия может приводить к развитию атрофического процесса в гиппокампе и других структурах мозга [11, 22, 23].
Снижение реактивности мелких сосудов может объясняться повреждением эндотелиальных клеток вследствие гипергликемии. Нарушение функции эндотелия приводит к нарушению транспорта глюкозы через ГЭБ. Кроме того, гипергликемия может сопровождаться повышенной продукцией токсических соединений (например, свободных радикалов), что способно приводить к повреждению нейронов.
Важную роль могут играть конечные продукты гликирования, выработка которых при гипергликемии быстро возрастает. Конечные продукты гликирования вызывают повреждение белков, нарушают структуру клеток, способствуют развитию окислительного стресса и системной воспалительной реакции [3].
Кроме того, при инсулинорезистентности нарушается функция инсулина в мозге, который вовлечен в процессы обучения и консолидации следов памяти. Предполагают, что нарушение функции гиппокампа, по крайней мере, частично можно объяснить нарушением функции инсулиновых рецепторов. Более того, инсулин связан с регуляцией тонуса сосудов через влияние на продукцию оксида азота в эндотелиальных клетках. Гипергликемия и воспаление препятствуют реализации эффектов инсулина, что является фактором развития эндотелиальной дисфункции. Инсулинорезистентность приводит к снижению реактивности сосудов и церебральной перфузии, что является дополнительным фактором развития функциональной гипогликемии.
Показано, что инсулинорезистентность коррелирует с когнитивным статусом только у пациентов, имеющих высокие показатели воспалительного процесса (С-реактивный белок, интерлейкин 6) [10].
Метаболический синдром и цереброваскулярная патология
Основные компоненты метаболического синдрома (артериальная гипертензия, гиперлипидемия, сахарный диабет) относятся к факторам риска развития цереброваскулярной патологии. Риск ишемического инсульта и немого инфаркта у лиц с метаболическим синдромом увеличивается в 2–4 раза, лейкоареоза – в 5 раз. Риск развития сосудистой деменции повышается примерно в 5 раз, при наличии воспалительных процессов – в 9,5 раз [22, 24–26].
Инсулин оказывает непосредственное влияние на вазореактивность и региональную перфузию. Он повышает продукцию NO – основного медиатора вазодилатации и контролирует вазоконстрикцию через эндотелин 1. При инсулинорезистентности уменьшается количество NO и увеличивается уровень эндотелина 1, что способствует сужению сосудов и снижению наполнения капилляров. Эндотелиальная дисфункция в свою очередь уменьшает транспорт инсулина. Порочный круг – прогрессирующая эндотелиальная дисфункция и нарастающая инсулинорезистентность – замыкается [19].
Артериальная гипертензия, являющаяся одним из компонентов метаболического синдрома, усугубляет эндотелиальную дисфункцию и ослабляет феномен функциональной гиперемии, который обеспечивает координацию деятельности мозговых структур и региональной мозговой перфузии. Непосредственной причиной нарушения функциональной гиперемии являются снижение продукции вазоактивных посредников (NO), окислительный стресс, структурные изменения кровеносных сосудов [3].
Инсулинорезистентность и риск развития болезни Альцгеймера
Данные о влиянии инсулинорезистентности на риск развития и прогрессирования болезни Альцгеймера противоречивы. С одной стороны, в многочисленных исследованиях показана связь между СД 2 типа, ожирением, артериальной гипертензией (особенно у лиц среднего возраста) и повышением риска развития болезни Альцгеймера в пожилом возрасте [17, 23]. Показано, что риск таковой у лиц с инсулинорезистентностью повышается в 1,3 раза [3]. Недавно опубликованные результаты Роттердамского исследования показали, что риск развития болезни Альцгеймера у больных СД непосредственно связан с наличием инсулинорезистентности и уровнем инсулина в крови (но только в первые три года наблюдения) [10].
Ранее уже упоминалась роль повышенной продукции ФНО-альфа в патогенезе метаболического синдрома. Показано, что в веществе головного мозга и цереброспинальной жидкости у пациентов с болезнью Альцгеймера и умеренным когнитивным расстройством повышено содержание ФНО-альфа. Сопряженные с этим воспалительные изменения, препятствуя транспорту бета-амилоида из головного мозга, способствуют его накоплению, что может запускать механизм альцгеймеровской дегенерации. Нарушение продукции и транспорта бета-амилоида может усугубляться из-за нарушения липидного обмена. Экспериментально показано, что повышение секреции липопротеинов очень низкой плотности на периферии, а также увеличение в рационе количества насыщенных жиров способствуют накоплению бета-амилоида в головном мозге [3, 10].
Способствовать отложению амилоида в паренхиме и сосудах головного мозга может и связанное с патологией мелких церебральных сосудов повреждение ГЭБ. В свою очередь отложение бета-амилоида в сосудах головного мозга вызывает воспалительный процесс, сопровождающийся повреждением эндотелия. Таким образом, данные процессы могут взаимно усиливать друг друга, формируя порочный круг [22].
Вместе с тем в ряде патоморфологических исследований у пациентов с СД отмечена та же выраженность альцгеймеровских изменений в мозге, что и у лиц, не страдавших СД. Более того, по данным нескольких патоморфологических исследований, у пациентов с СД в среднем выявлено более низкое накопление амилоида в мозге, чем у лиц того же возраста без деменции [27]. В одном из клинических исследований у пациентов с болезнью Альцгеймера, страдавших СД, отмечено более медленное когнитивное снижение, чем у пациентов с болезнью Альцгеймера без СД [25]. У пациентов с СД, которым проводилось лечение диабета, отмечался более низкий уровень накопления бета-амилоида, чем у лиц, не болевших СД, но имевших одинаковый с ними уровень деменции, и примерно та же выраженность амилоидной патологии, что и у больных СД, не имевших деменции. В то же время у больных СД с деменцией, не получавших лечение диабета, накопление амилоида было выражено в той же степени, что и у пациентов с деменцией, не имевших СД. По-видимому, противодиабетическое лечение препятствует накоплению амилоида, хотя и не препятствует развитию деменции, которая в данной ситуации в большей степени развивается вследствие цереброваскулярной патологии [3, 9, 12, 14, 24, 28].
Общие подходы к лечению метаболического синдрома
Основные направления лечения метаболического синдрома включают [1, 2]:
- снижение массы тела (низкокалорийная диета, повышение физической активности и др.);
- прием препаратов, повышающих чувствительность тканей к инсулину: производных тиазолидиндиона (например, троглитазона или пиоглитазона) или бигуанидов (метформина); гиполипидемических препаратов (статинов и фибратов); антигипертензивных средств.
Наличие когнитивного дефицита должно учитываться при планировании терапии: лечение в этом случае должно быть максимально упрощено и корригироваться поэтапно, чтобы обеспечить оптимальный результат.
При уже развившемся когнитивном дефиците в программы лечения должны включаться средства, улучшающие когнитивные функции. В частности, пациентам с деменцией, развившейся вследствие болезни Альцгеймера или цереброваскулярной патологии, показано применение ингибиторов холинэстеразы и мемантина, у пациентов с умеренными когнитивными нарушениями одним из препаратов выбора может быть Ноопепт.
Применение Ноопепта при умеренном когнитивном расстройстве
Ноопепт – этиловый эфир N-фенилацетил-L-пролилглицина. Препарат относится к фармакологической группе биоактивных пептидов. На экспериментальных моделях когнитивных нарушений показано, что Ноопепт может тормозить высвобождение глутамата, противодействуя эксайтотоксичности, модулировать Н-холинорецепторы, препятствовать токсическому воздействию амилоида, активировать антиоксидантные системы, повышать экспрессию трофических факторов в мозге и таким образом оказывать нейропротективный эффект. Данный профиль фармакологических эффектов делает препарат перспективным для применения у лиц с когнитивными нарушениями, возникающими при метаболическом синдроме.
Клиническое изучение эффективности и переносимости Ноопепта проведено в Научно-исследовательском институте фармакологии им. В.В. Закусова, Государственном научном центре социальной и судебной психиатрии им. В.П. Сербского, Московском научно-исследовательском институте психиатрии, Первом Московском государственном медицинском университете им. И.М. Сеченова.
В ряде клинических исследований показан благоприятный эффект Ноопепта у пациентов с умеренным когнитивным расстройством. Установлено, что в отличие от пирацетама Ноопепт улучшает первоначальную обработку информации, ее фиксацию и консолидацию, а также извлечение. Препарат обладает мягким антиастеническим действием, поэтому не вызывает избыточного стимулирующего эффекта, усиления тревоги или нарушения сна.
Во всех проведенных исследованиях отмечена хорошая переносимость Ноопепта, однако у некоторых пациентов на фоне его приема наблюдались подъемы артериального давления. Это стало одной из причин проведения нами открытого обсервационного клинического исследования эффективности и безопасности Ноопепта у 30 пациентов с дисциркуляторной гипертонической энцефалопатией и умеренным когнитивным расстройством. У трети из них, имевших тенденцию к более быстрому когнитивному снижению, выявлялись отдельные признаки метаболического синдрома (в том числе СД 2 типа – у 28% пациентов) [7].
Ноопепт назначался внутрь в течение первого месяца по одной таблетке (10 мг) два раза в день, в течение второго и третьего месяцев – по одной таблетке три раза в день (последний прием не позже 18 часов).
Результаты исследования свидетельствовали о том, что прием Ноопепта способствовал выраженному и умеренному улучшению состояния у 76% пациентов, прежде всего за счет уменьшения выраженности нарушений памяти и внимания. Уменьшение жалоб на снижение памяти отмечено у 77% пациентов, на рассеянность – у 58%, на раздражительность – у 54%, на утомляемость – у 50%. При объективной оценке когнитивных функций установлено достоверное увеличение оценки по тесту «Кодирование» (на 14%), показателя отсроченного воспроизведения в тесте на слухоречевую память (на 28%) и зрительной памяти (на 37%), оценки по тесту «Рисование часов» (на 9%), тесту на фонетическую речевую активность (на 7%). Необходимо отметить, что степень улучшения когнитивных функций зависела от дозы препарата и достигала максимума при суточной дозе 30 мг. Эффект терапии оказался выше у пациентов с дизрегуляторным типом когнитивных нарушений, наиболее четко связанным с микроваскулярной патологией головного мозга.
Переносимость препарата в течение периода наблюдения была хорошей. Опасение, связанное с возможностью ухудшения течения артериальной гипертензии на фоне приема Ноопепта, не подтвердилось. Только у 10% пациентов, включенных в исследование, было зафиксировано транзиторное повышение артериального давления, не потребовавшее снижения дозы или отмены препарата. Более того, к концу исследования в группе отмечена тенденция к снижению артериального давления. Эффективность и безопасность терапии Ноопептом у пациентов с признаками метаболического синдрома и в исследуемой группе в целом не различались.
Заключение
Для достижения более выраженных результатов у пациентов с когнитивными расстройствами, возникающими на фоне соматической патологии, в том числе метаболического синдрома, представляется особенно важным не только своевременная коррекция соматического статуса, но и проведение мероприятий по профилактике развития и усугубления когнитивного дефицита. Важной задачей может стать формирование когнитивного резерва. Решение этой задачи достигается не только применением средств, улучшающих когнитивные функции, но и адекватной умственной и физической нагрузкой, активной социальной деятельностью, методиками направленной нейропсихологической реабилитации [29].
O.A. Gankina, O.S. Levin, F.N. Ilyasova
Russian Medical Academy of Postgraduate Education
Contact person: Oleg Semyonovich Levin, oslevin@mail.ru
Metabolic syndrome is one of the most common metabolic disorders observed in 15–30% adults, which is characterized by combined abdominal obesity together with dyslipidemia, arterial hypertension, and hyperglycemia. Insulin resistance plays an important role in developing major components of metabolic syndrome. A close relationship between metabolic syndrome and cardiovascular and neurological pathologies (including cognitive impairment) determines importance of its timely diagnostics and therapy. All main clinical components comprising metabolic syndrome primarily arterial hypertension, obesity and hyperglycemia, especially their combination, may exhibit unfavorable influence on brain activity. Mainly, treatment of metabolic syndrome includes measures on reducing body weight including increased physical activity, administration of drugs elevating sensitivity of body tissues to insulin as well as hypolipidemic and anti-hypertensive agents. Opportunity of using current peptidergic agents in correction of cognitive impairment in patients with metabolic syndrome is discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.