Применение инсулина гларгин (Лантус®) в комбинации с пероральными сахароснижающими препаратами
- Аннотация
- Статья
- Ссылки




Медико-социальное и экономическое значение СД типа 2 не ограничивается лишь числом случаев заболевания, большую опасность представляют поздние сосудистые осложнения диабета, ведущие к ранней инвалидности и высокой смертности пациентов, уменьшению продолжительности жизни и ухудшению соматического здоровья. Поэтому приоритетной задачей медицины в настоящее время является разработка и внедрение в клиническую практику новых эффективных подходов к ведению пациентов с СД типа 2 (5, 6, 11, 15).
Результаты исследования UKPDS убедительно продемонстрировали достоверные преимущества жесткого и непрерывного контроля гликемии, близкого к норме, как надежного метода профилактики хронических осложнений у больных с СД типа 2 (13). Терапевтической целью, согласно обновленному руководству ADA/EASD (2008), является достижение и поддержание уровня HbA1с насколько можно ближе к физиологическому (< 7,0%): на любом этапе лечения СД типа 2 показатель HbA1c > 7,0% следует рассматривать как сигнал к активному действию − изменению фармакотерапии (при условии отсутствия гипогликемических состояний), или интенсификации. Принципиально новым подходом к ведению пациентов с СД типа 2 является раннее начало и своевременная интенсификация инсулинотерапии. Раннее добавление базального инсулина к пероральной сахароснижающей терапии может улучшить контроль гликемии, что позволяет снизить риск развития осложнений. Однако в реальной клинической практике назначение инсулина часто откладывается до тех пор, пока уровень HbA1c не приблизится к 9%, и у многих пациентов с СД типа 2 к тому моменту, когда они начинают инсулинотерапию, уже развились осложнения.
Инсулин гларгин (Лантус®) – аналог человеческого инсулина длительного действия, однократное введение которого обеспечивает базальный контроль гликемии в течение суток. Беспиковый предсказуемый профиль его действия позволяет максимально имитировать физиологическую базальную секрецию инсулина, что значительно снижает риск гипогликемий и вариабельность концентраций глюкозы в течение суток по сравнению с НПХ-инсулином. Кроме того, 24-часовая длительность действия инсулина гларгин позволяет вводить его 1 раз в сутки, что является несомненным преимуществом по сравнению с НПХ-инсулином. Важно, что инсулин гларгин обеспечивает базальный контроль гликемии в течение суток независимо от времени введения (утром или перед сном) и места введения (подкожная клетчатка плеч, бедер или живота).
Инсулин гларгин впервые появился на мировом рынке в 2000 году, в РФ зарегистрирован в марте 2003 года. Эффективность и безопасность его применения у пациентов с СД типа 2 была неоднократно подтверждена в контролируемых клинических исследованиях (ККИ) (3, 4, 7, 9, 10, 12, 15). Однако результаты ККИ вследствие жесткости их протоколов могут быть экстраполированы на повседневную клиническую практику с целым рядом ограничений. Несомненно, бóльшую практическую ценность в получении информации о применении препаратов имеют наблюдательные программы, изучающие крупные когорты пациентов, которые получают терапию этими препаратами в реальном измерении (2). Это и послужило причиной проведения нами наблюдательной программы по применению инсулина гларгин у больных СД типа 2 в условиях реальной клинической практики.
Основной целью наблюдательной программы была оценка количества пациентов, у которых возможно достижение целевого уровня гликемии натощак < 5,5 ммоль/л при добавлении к терапии пероральными сахароснижающими препаратами (ПССП) инсулина гларгин с последующей активной титрацией его дозы в повседневной клинической практике. Также планировалось оценить такие показатели эффективности и безопасности применения инсулина гларгин, как изменение уровня HbA1c, среднюю дозу инсулина гларгин, необходимую для достижения целевого уровня гликемии натощак и HbA1c, частоту эпизодов гипогликемии.
Материалы и методы
Дизайн программы: открытая, проспективная, нерандомизированная, многоцентровая наблюдательная программа, изучавшая применение инсулина гларгин в качестве базального инсулина у пациентов с СД типа 2, проводилась в стационарах и поликлиниках различных городов Российской Федерации при участии 100 эндокринологов. Длительность наблюдения составила 6 месяцев, в течение которых было проведено 3 визита: визит 1 – исходный (включение в программу), визит 2 – через 3 месяца и визит 3 (заключительный) – через 6 месяцев после начала терапии инсулином гларгин.
Характеристика пациентов. В программе участвовали 879 пациентов с СД типа 2 с неудовлетворительным контролем гликемии на предшествующей терапии ПССП, которые для достижения компенсации углеводного обмена, по мнению лечащего врача, нуждались в добавлении базального инсулина. Исходная характеристика пациентов представлена в таблице 1.
Титрация инсулина гларгин осуществлялась по одному из двух алгоритмов (1). Выбор конкретного алгоритма осуществлялся лечащим врачом в зависимости от знаний, предполагаемой комплаентности пациента и возможности самостоятельно корректировать дозу инсулина. Алгоритм 1 представлен в таблице 2.
Алгоритм 2 титрования дозы инсулина: начальная доза инсулина гларгин составляла 10 МЕ. Увеличение дозы инсулина гларгин на 2 МЕ производилось каждые 3 дня, если среднее значение ГКН за эти дни превышало 5,5 ммоль/л.
В обоих алгоритмах дозу инсулина не увеличивали, если в течение предыдущей недели регистрировали снижение уровня ГКН менее 4,0 ммоль/л. При развитии тяжелой гипогликемии или снижении уровня ГКН менее 3,1 ммоль/л в течение предыдущей недели доза инсулина уменьшалась на 2-4 MЕ/сут.
Дозы ПССП после включения пациентов в программу не менялись и оставались постоянными на протяжении всего периода наблюдения.
Статистический анализ
Для описания количественных переменных были использованы следующие статистические характеристики: количество пациентов, среднее арифметическое значение, стандартное отклонение, медиана. Для описания качественных переменных были использованы частоты и проценты. Внутригрупповые изменения оценивались при помощи парного t-теста, критерия Вилкоксона, теста Мак-Немара и его подвидов. Зависимость качественных переменных оценивалась с использованием тестов χ-квадрат, точный критерий Фишера или методы Кохран-Мантель-Хенцеля. Данные в тексте и в таблицах представлены в виде M ± m (M – среднее арифметическое значение, m – стандартное отклонение). Статистически значимыми считали различия при р < 0,05.
Результаты
Анализ эффективности. При анализе динамики HbA1с можно отметить, что уже через 3 месяца после добавления к терапии ПССП инсулина гларгин его уровень достоверно снизился с 10,1 ± 1,9% до 8,2 ± 1,4% (р < 0,001), а через 6 месяцев терапии – до 7,2 ± 1,1% (р < 0,001), т.е. на 2,9% (рисунок 1).
Исходный уровень ГКН составлял 11,2 ± 2,5 ммоль/л, через 3 месяца после начала терапии инсулином гларгин отмечено статистически значимое снижение его до 7,5 ± 1,6 ммоль/л (р < 0,001), а через 6 месяцев – до 6,3 ± 1,1 ммоль/л (р < 0,001), т.е. на 4,9 ммоль/л (рисунок 2).
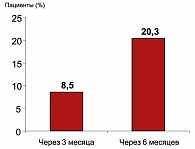
С клинической точки зрения большую значимость имеет не столько снижение концентрации ГКН само по себе, сколько достижение ее целевого значения <5,5 ммоль/л. Через 3 месяца после добавления к терапии ПССП инсулина гларгин целевой уровень ГКН был достигнут у 75 из 879 (8,5%) пациентов, а через 6 месяцев терапии − уже у 178 из 879 (20,3%) пациентов (рисунок 2). Вместе с тем лишь 57 из 75 пациентов, которые через 3 месяца от начала терапии достигли целевого уровня ГКН, сохранили этот результат в течение следующих трех месяцев лечения.
Средняя доза инсулина гларгин исходно составляла 11,6 ± 3,9 МЕ (медиана 10,0 МЕ), через 3 месяца с момента включения в программу статистически значимо выросла до 20,8 ± 7,4 МЕ (медиана 18,0 МЕ), а через 6 месяцев − до 24,3 ± 8,9 МЕ (медиана 23,0 МЕ) (р < 0,001). У 178 пациентов, достигших целевого уровня ГКН < 5,5 ммоль/л, средняя доза инсулина гларгин через 6 месяцев терапии составила 21,8 ± 7,9 ME (медиана дозы 20 ME).
Нами была выявлена статистически значимая зависимость между дозами инсулина гларгин и количеством пациентов, достигших целевого уровня ГКН к концу наблюдения (таблица 3). Наибольшее количество пациентов – 79 из 879 (9,0%) – достигло целевого уровня ГКН на фоне терапии инсулином гларгин в дозе 10−20 МЕ, вместе с тем 21,5% пациентов, получавших инсулин гларгин в дозе из этого же диапазона, целевого уровня гликемии не достигли. Как уже неоднократно говорилось ранее, нет понятия «оптимальная доза инсулина», его должно быть «так мало, как это возможно, но столько, сколько необходимо», а это зависит от исходного состояния компенсации углеводного обмена, массы тела пациента, степени физической активности и ряда других факторов. Главный критерий адекватности дозы инсулина – целевой уровень гликемии.
Анализ безопасности. Наиболее важным с клинических позиций представляется тот факт, что за период всего наблюдения не было зарегистрировано ни одного эпизода тяжелой гипогликемии. Также в течение 6 месяцев не было отмечено увеличения количества ночных гипогликемических эпизодов.
Важно отметить, что количество дневных и ночных гипогликемических состояний в когорте из 879 пациентов с СД типа 2, получавших терапию инсулином гларгин в комбинации с ПССП и включенных в окончательный анализ, статистически значимо снизилось через 3 и 6 месяцев от момента включения в программу (начала терапии инсулином гларгин). Через 3 месяца статистически значимо снизилось как количество легких дневных гипогликемий с 601 до 420 (на 30,1%) (р = 0,004), так и легких ночных гипогликемических состояний – с 288 до 244 (на 15,3%) (р = 0,646). В конечной точке наблюдения количество легких дневных гипогликемических эпизодов достоверно снизилось с 601 до 304 (на 49,4%) (р < 0,001), а количество легких ночных гипогликемических эпизодов – с 288 до 230 (на 20,1%) (р = 0,107).
Обсуждение результатов
В программе приняли участие 100 эндокринологов, работающих в учреждениях практического здравоохранения РФ, которые включили в наблюдение в общей сложности 879 пациентов, т.е. на одного врача приходилось в среднем 8-9 больных СД типа 2. Достаточный объем выборки дает возможность экстраполировать полученные результаты на общую популяцию пациентов с СД типа 2, у которых не удалось достичь компенсации углеводного обмена на терапии ПССП.
Согласно обновленному Консенсусу ADA/EASD (2008), при неэффективности первого этапа лечения СД типа 2 – модификации образа жизни и терапии метформином, что проявляется сохранением в течение 2-3 месяцев уровня НbA1c > 7%, рекомендован переход к следующему этапу – интенсификации сахароснижающей терапии. На втором этапе к метформину могут быть добавлены базальный инсулин или препарат сульфонилмочевины, охарактеризованные экспертами ADA/EASD как «хорошо подтвержденная базовая терапия». При этом выбор препарата определяется уровнем НbA1c: для больных с HbA1c более 8,5%, а также для пациентов с клиническими симптомами гипергликемии, предпочтительно назначение базального инсулина как наиболее эффективного сахароснижающего препарата (8). Это объясняется тем, что чем выше уровень НbA1c, тем больший вклад в его значение вносит ГКН, обусловленная повышением гепатической продукции глюкозы (17). Инициация инсулинотерапии путем добавления к одному ПССП именно базального инсулина, несомненно, оправдана с точки зрения патофизиологии СД типа 2. Инсулин является самым мощным физиологическим ингибитором глюконеогенеза в печени, поэтому экзогенное введение базального инсулина в адекватной дозе способствует поддержанию нормогликемии натощак (концепция «FIX FASTING FIRST»), что, в свою очередь, улучшает уровень постпрандиальной и постабсорбтивной гликемии в течение дня. Принимая во внимание, что у включенных в программу пациентов средний уровень НbA1c исходно составил 10,1 ± 1,9%, необходимость добавления к терапии ПССП базального инсулина была патогенетически оправданной.
В нашей наблюдательной программе была подтверждена продемонстрированная ранее в ККИ эффективность инсулина гларгин в улучшении состояния углеводного обмена у пациентов с СД типа 2, у которых не удалось достичь оптимального гликемического контроля на фоне лечения ПССП, в сочетании с хорошим профилем безопасности. Однако доля пациентов, достигших целевого уровня ГКН < 5,5 ммоль/л через 6 месяцев после добавления к терапии ПССП инсулина гларгин, в нашей программе была существенно ниже – 20,3%, чем в цитируемых исследованиях Treat-To-Target, LANMET, AT LANTUS и др. (1, 10, 15). Средняя доза инсулина гларгин при завершении нашего наблюдения также была существенно ниже (24,3 ± 8,9 МЕ, медиана 23,0 МЕ), чем в уже упомянутых исследованиях: Treat-To-Target (средняя доза в конце исследования 47 МЕ), LANMET (средняя доза в конце исследования 68 МЕ) и AT LANTUS (средняя доза при титрации врачами – 41 МЕ, при титрации пациентами – 45 МЕ).
Таким образом, в очередной раз подтверждается факт, что недостаточно назначить инсулин – в нашем случае инсулин гларгин, обладающий улучшенными фармакокинетическими и фармакодинамическими свойствами, – необходимо своевременно и адекватно увеличивать его дозу до достижения целевых показателей ГКН.
Инсулин гларгин – беспиковый аналог инсулина 24-часового действия. Начальная доза инсулина гларгин при инициации инсулинотерапии у пациентов с СД типа 2 составляет 10 МЕ. Однако, несмотря на указанную рекомендованную стартовую дозу инсулина гларгин, удивительно, что у части пациентов в нашем наблюдении эта доза была меньше. Этот факт может быть обусловлен часто не обоснованными опасениями врачей в отношении гипогликемии: очевидно, что пациенты находятся в состоянии декомпенсации углеводного обмена, но врачи не могут решиться назначить инсулин гларгин в дозе 10 МЕ вследствие подобных страхов. Начало лечения с дозы инсулина ниже 10 МЕ могло быть и личным выбором пациента, обусловленным, скорее всего, все тем же страхом гипогликемии, который не удалось преодолеть ни врачу, ни пациенту. Средняя доза инсулина гларгин в нашей программе также значительно отличается от таковой в ККИ. Инсулинотерапию необходимо не только своевременно начинать, но активно титровать дозу препарата до достижения целевых показателей гликемии. Анализ динамики дозы инсулина гларгин демонстрирует более активное ее увеличение в течение первых трех месяцев терапии и замедление скорости титрации препарата в течение трех последующих месяцев. Такая ситуация может свидетельствовать о снижении созданной врачами при включении в программу мотивации пациента к титрованию дозы инсулина гларгин. Долгосрочный контроль СД типа 2 предполагает особое внимание к мотивации пациента, который должен быть активно вовлечен в лечение, настроен на достижение поставленных целей.
Причинами этого могут быть и субъективные факторы: во-первых, снижение ГКН и HbA1c могло несколько «успокоить» как врачей, так и пациентов – «уже не все так плохо, как было раньше»; во-вторых, одним из хорошо известных барьеров не только к инициации инсулинотерапии, но и к активному титрованию дозы инсулина является уже упомянутый страх развития гипогликемии. При этом нельзя забывать, что в отличие от НПХ-инсулина у инсулина гларгин нет пика действия – это значительно снижает риск развития гипогликемий, что было неоднократно доказано в многочисленных исследованиях. Меньшая частота гипогликемических состояний при терапии инсулином гларгин вызывает особый интерес, поскольку именно опасения развития гипогликемии являются одним из основных препятствий к старту инсулинотерапии и оптимизации его дозы. Так, в исследовании AT LANTUS один из алгоритмов подбора дозы инсулина гларгин предполагал единовременное увеличение дозы препарата на 2-10 МЕ в неделю, при этом частота тяжелых гипогликемий была низкой и не отличалась от частоты гипогликемии при увеличении дозы препарата на 2 МЕ каждые 3 дня.
Еще одним очевидным преимуществом инсулина гларгин является простой, понятный и надежный алгоритм подбора дозы. Здесь также уместно привести результаты уже упомянутого исследования AT LANTUS, в котором титрация дозы инсулина на каждом визите осуществлялась под руководством врача или самостоятельно пациентом каждые 3 дня: большего снижения HbA1c и ГКН достигли пациенты, изменявшие дозу инсулина гларгина самостоятельно, по сравнению с теми, у которых титрация проводилась врачом.
Эти убедительные данные в сочетании с высоким уровнем приверженности лечению (97,4%) свидетельствуют о простоте и понятности применяемого алгоритма подбора дозы инсулина гларгин для пациентов, что позволяет принимать активное участие в управлении своим лечением и дает возможность значительно уменьшить нагрузку на врачей, постоянно увеличивающуюся в связи с растущей распространенностью СД типа 2.
Следует заметить, что в нашей программе лимитировать активную титрацию инсулина гларгин могли и такие объективные факторы, как обеспеченность пациентов тест-полосками для самоконтроля. Следовательно, можно предположить, что в течение второго квартала программы регулярный самоконтроль и титрацию дозы инсулина проводили лишь хорошо обученные и мотивированные пациенты.
Различия между ККИ и «реальной жизнью» столь существенны, что невозможно не задуматься о методах, которые позволят хотя бы немного сократить разрыв между повседневной практикой и ККИ. Здесь уместно привести результаты исследования INITIATE: инициация инсулина гларгина больным СД типа 2 методом группового или индивидуального обучения приводит к одинаково хорошему контролю гликемии по истечении 24 недель (16). Однако групповой метод начала терапии гларгином занимает вдвое меньше времени, чем индивидуальная инициация, что существенно снижает нагрузку на врачей и затраты на ведение пациентов. Несомненно, более широкое внедрение и реализация эффективных образовательных программ для обучения основным принципам и навыкам, необходимым пациентам для инициации и своевременной интенсификации инсулинотерапии, позволит достичь целевых показателей гликемии как можно большему количеству наших пациентов с СД типа 2 и будет действенной мерой в профилактике развития и прогрессирования хронических осложнений заболевания.
Выводы
- Добавление инсулина гларгин к терапии ПССП привело к улучшению гликемического контроля у пациентов с СД типа 2.
- Для достижения целевого уровня гликемии натощак < 5,5 ммоль/л необходима своевременная коррекция дозы инсулина гларгина, что может быть осуществлено путем самостоятельной титрации дозы препарата пациентом, прошедшим необходимое обучение.
- В течение всего периода наблюдения не отмечено увеличения частоты ночных гипогликемических эпизодов и не зарегистрировано ни одного эпизода тяжелой гипогликемии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.