Лечение диссеминированного рака желудка у пожилых больных
- Аннотация
- Статья
- Ссылки



Рак желудка (РЖ) остается одним из самых распространенных заболеваний в мире, занимая второе место после рака легкого. Ежегодно регистрируется почти 800 тысяч новых случаев и 628 тысяч смертей от этого заболевания. Странами-лидерами являются Япония, Россия, Чили, Корея, Китай, Коста-Рика, Филиппины. Страны с низкой заболеваемостью – США, Австралия, Новая Зеландия.
В России самый высокий показатель заболеваемости РЖ приходится на Новгородскую область и Республику Тува, минимальные показатели – в регионах Северного Кавказа, Магаданской области и Чукотском автономном округе. В структуре онкологической заболеваемости России рак желудка устойчиво занимает второе ранговое место и относится к немногим формам с тенденцией снижения заболеваемости во всех экономических районах. С 1991 по 2001 год отмечено снижение заболеваемости с 43/100000 до 31,9/100000 у мужчин и с 18,5/100000 до 13,9/100000 у женщин. В 2001 году рак желудка впервые в жизни был диагностирован у 46957 больных и составил среди всех злокачественных заболеваний 12,4% у мужчин (второе место после рака легкого) и 8,5% – у женщин (третье место после рака молочной железы и рака кожи).
В Москве в 2001 году было выявлено 2872 новых случая РЖ.
В структуре смертности населения России от злокачественных заболеваний в 2001 году рак желудка составил 15,3% у мужчин (второе место после рака легкого) и 13,8% – у женщин (второе место после рака молочной железы).
По уровню смертности от РЖ среди 45 стран мира Россия занимает II место у мужчин и III место – среди женщин (3).
За последнее десятилетие в Российской Федерации наряду со статистически значимым снижением показателя заболеваемости увеличивается показатель летальности на первом году. Это явление связано, скорее всего, с увеличением количества впервые выявленных больных с IV стадией болезни и ухудшением оказания онкологической помощи населению России (4).
Наиболее часто РЖ выявляется в возрасте старше 50 лет, основной пик заболеваемости приходится на возрастную группу 70-74 года, средний возраст заболевших – 65,7, медиана – 66,8 (3).
Увеличение доли пожилых больных и поздняя выявляемость заболевания повышает актуальность проблем, связанных с проведением лечебных и скрининговых мероприятий у данной категории пациентов.
Зачастую пожилые люди с анемией, кахексией, обезвоживанием, дисфагией, явлениями кишечной непроходимости, кровотечением попадают в терапевтические и хирургические отделения общего профиля, где вышеперечисленные осложнения ассоциируются с крайней запущенностью процесса. Такие пациенты редко получают специфическое лечение, и помощь лечебного учреждения ограничивается симптоматической терапией и дальнейшим наблюдением районного онколога на дому. Предубежденность в отношении проведения специфического лечения лицам пожилого и старческого возраста наблюдается не только в нашей стране. Так, по данным исследования, проведенного в Дании (3), больные старше 70 лет имеют в 3 раза меньше возможности получить хирургическое, лучевое или лекарственное лечение по поводу онкологического заболевания по сравнению с более молодыми пациентами. Число пожилых пациентов, участвующих в клинических исследованиях, составляет не более 20%, так как в большинстве научных протоколов пожилой возраст является критерием исключения при отборе больных (6).
Данная тенденция наблюдается не только в отношении злокачественных опухолей желудка. Сходные проблемы возникают при лечении рака молочной железы, легкого, опухолей толстой кишки (хотя частота возникновения колоректального рака у больных старше 60 лет повышается в 20 раз), рака яичников, где половина всех случаев заболевания приходится на возраст старше 65 лет (7) и т. д.
Fentiman в 1990 году (8) назвал основные причины, препятствующие разработке адекватного лечения рака у пожилых больных:
- консерватизм большинства онкологов, считающих пожилой возраст противопоказанием для активного лечения;
- недооценка значения такого фактора, как продолжительность жизни человека;
- общераспространенное мнение о том, что рак у пожилых более резистентен к химиотерапии;
- ложные представления о плохой переносимости химиотерапии и лучевой терапии в пожилом возрасте;
- недостаток фармакокинетических исследований лекарственной активности у лиц пожилого возраста;
- недостаток научных исследований в области лечения рака у пожилых;
- отсутствие четко обоснованной оптимальной лечебной тактики;
- дефицит активных и одновременно малотоксичных противоопухолевых препаратов.
Monfardini и Yancik (9) в1993 году дополнили этот список следующими причинами:
- типичность наличия скрытых симптомов рака;
- неправильная интерпретация жалоб пожилыми больными из-за наличия хронических сопутствующих заболеваний;
- поздняя обращаемость к врачу;
- частое незнание пациентами симптомов рака.
Поскольку в настоящее время нет четко обоснованной оптимальной лечебной тактики, специфичной для лечения пожилых больных, возможны ошибки. Так, по данным РОНЦ им. Н.Н. Блохина РАМН, у половины больных раком желудка, которым в общехирургических клиниках выполнена пробная лапаротомия, в специализированном онкологическом учреждении было оказано хирургическое пособие в объеме гастрэктомии, наложения обходных гастроэнтероанастомозов и др.
Проблемным является и вопрос о лекарственной терапии, обладающей системным воздействием на организм (10). При проведении химиотерапии клиницисты часто необоснованно снижают дозы цитостатиков, стремясь уменьшить вероятность развития тяжелых побочных реакций. Однако необоснованная редукция доз препаратов (11, 12) может привести к снижению эффективности лечения. Для выбора адекватного режима химиотерапии чрезвычайно важно правильно оценить состояние пациента, учитывая медицинский аспект, функциональное и эмоциональное состояние, социально-экономический статус, наличие гериартрических синдромов.
Существуют объективные предпосылки, связанные с возрастными фармакокинетическими особенностями, повышающими риск химиотерапии у пожилых больных. Основной фармакокинетической особенностью этого возраста является увеличение объема распределения жирорастворимых препаратов и уменьшение объема распределения водорастворимых препаратов. Это связано с особенностями возрастных физиологических процессов: изменением массы тела, которое характеризуется увеличением процентного содержания жировой ткани (с 15 до 30% от массы тела), уменьшением количества внутриклеточной жидкости (13), снижением концентрации альбумина, анемией (14,15,16). В этих условиях возможно увеличение токсичности цитостатиков, связывающихся с белками или эритроцитами: таксанов, эпиподофилотоксинов, антрациклинов и антраценоидов (17, 18). В отношении абсорбции препаратов при оральном применении следует отметить, что у лиц старше 80 лет, как правило, наблюдается атрофический гастрит, что может приводить к снижению абсорбции фолатов, этопозида и других таблетированных форм (19, 20). Наиболее важными являются изменения метаболической функции печени и снижение гломерулярной фильтрации. Метаболизм лекарственных препаратов в печени включает в себя цитохром Р-450 зависимые реакции (I фаза) и реакции коньюгации (II фаза). Изменения в реакциях I фазы могут влиять на активность и токсичность таких противоопухолевых агентов, как циклофосфан, идарубицин, однако на сегодняшний день нет клинических тестов для определения данной функции (17, 18). Снижение гломерулярной фильтрации приводит к увеличению токсичности химиопрепаратов, основным путем выведения которых являются почки (блеомицин, метотрексат, цисплатин) (17). Также важно помнить о проявлениях нейротоксичности при применении винкаалкалоидов, таксанов, производных платины, эпидофилотоксинов. Резкое снижение периферической чувствительности, ототоксичность, проявления центральной токсичности, могут привести к нежелательным последствиям для пожилых пациентов. Необходимо иметь в виду, что из-за низких резервов костного мозга, у них наблюдается увеличение случаев непредсказуемой миелотоксичности, даже при индивидуальном подборе доз препаратов с учетом фармакокинетических параметров больного (21). Тем не менее большинство пациентов в свои 70, а некоторые даже в 80 лет могут перенести умеренно токсичные режимы, используемые в рутинной практике.
Химиотерапия при диссеминированном процессе носит паллиативный характер, поэтому каждый раз врачу приходится решать вопрос, что в большей степени улучшит состояние онкологического больного – оптимальная симптоматическая терапия или токсическое специфическое лечение.
В отделении химиотерапии и отделении амбулаторных методов диагностики и лечения РОНЦ им. Н.Н. Блохина РАМН имеется опыт по лечению пожилых больных с диссеминированным раком желудка. На основании собственного клинического материала мы попытались оценить переносимость и эффективность различных лекарственных комбинаций, базовыми цитостатическими агентами, которые являются производными платины (цисплатин, оксалиплатин). В схемы лечения также включали таксаны и фторпроизводные.
Цисплатин – производное платины первого поколения. Обладает дозозависимой нефротоксичностью, которая является как правило лимитирующей. Для преодоления нефротоксичности был разработан режим гидратации перед введением цисплатина, что подразумевает введение до 2 л физиологического раствора с последующим форсированным диурезом. У людей старшего возраста данная методика требует дополнительного мониторинга со стороны сердечно-сосудистой системы и откорректированной сопутствующей терапии. Расчет дозы цисплатина у пожилых больных должен проводиться перед каждым курсом лечения. Коррекция дозы проводится с учетом клиренса креатинина по формуле Коккрофта (при клиренсе креатинина 60-46 мл/мин. рекомендуется редукция).
Следующим дозолимитирующим фактором является нейротоксичность. Характеризуется периферическими нейропатиями, включая парестезии, мышечную слабость, судороги, тремор. Длительность и интенсивность неврологических расстройств определяются разовой и кумулятивной дозой препарата. У пожилых пациентов наблюдается обычно стойкая симптоматика, которая подвергается медленному обратному развитию, что связано скорее всего, с неблагоприятным преморбидным фоном.
Отдельным пунктом стоит ототоксичность. Чаще всего возникает у пожилых больных при применении больших доз цисплатина, является кумулятивной и проявляется в виде потери слуха. В основном поражается Кортиев орган и улитка с разрушением волосковых эпителиальных клеток. Миелодепрессия цисплатина умеренная возникает примерно у 20-30% больных. Основным видом миелотоксичности является анемия. Гематологическая токсичность также обусловлена величиной дозы и возможно также является кумулятивной.
Цисплатин – высокоэметогенный препарат, поэтому его применение требует использование адекватных доз антиэметиков и дексаметазона.
Кардиотоксичность препарата минимальна.
Оксалиплатин (элоксатин) – производное платины третьего поколения. В предклинических исследованиях препарат проявил широкую противоопухолевую активность, в том числе, при 2 клеточных линиях рака желудка человека. Миелосупрессия и желудочно-кишечная токсичность проявляются лишь в умеренной степени. Случаев нефротоксичности и ототоксичности на фоне лечения элоксатином не отмечено. Характерным осложнением оксалиплатина является периферическая кумулятивная нейротоксичность. Проявляется острыми «холодовыми» парестезиями, является обратимой. У пожилых больных с сопутствующим диабетом и диабетической нейропатией риск нейротоксичности возрастает. Электрофизиологические исследования показали, что нейротоксичность может развиться при кумулятивной дозе элоксатина 417 мг/м2
Капецитабин (кселода) – высокоэффективный и безопасный пероральный фторпиримидин. Доминирующими нежелательными явлениями, связанными с приемом препарата, являются кожные реакции (ладонно–подошвенный синдром), реакции со стороны желудочно-кишечного тракта (тошнота, мукозиты, диарея) и слабость. Случаи миелосупрессии возникают довольно редко. Все виды токсичности достаточно хорошо купируются временным прерыванием лечения и модификацией доз препарата, а для коррекции ладонно-подошвенного синдрома широко используются препараты содержащие витамин В6 (пиридоксин, нейромультивит). 70% метаболитов капецитабина экскретируется почками. Редукция дозы рекомендуется при клиренсе креатинина менее 50 мл/мин., прекращение лечения – при клиренсе менее 30 мл/мин. Умеренное снижение печеночной функции не влияет на фармакокинетику препарата. Анализ фармакокинетики капецитабина показал его хорошую усвояемость у больных, ранее перенесших резекцию желудка, препаратом, хорошо переносится пожилыми больными.
Доцетаксел (Таксотер) – противоопухолевый препарат растительного происхождения (группа таксанов). Наиболее частыми побочными эффектами Таксотера являются обратимая нейтропения, периферическая нейропатия, миалгии, артралгии, мышечная слабость, реже отмечаются тромбоцитопения и анемия. Со стороны ЖКТ – тошнота, рвота, диарея, стоматит, эзофагит, колит.
У части больных наблюдается реакция гиперчувствительности на введение препарата. При кумулятивной дозе доцетаксела 400 мг/м2 развивается синдром задержки жидкости в организме. Для купирования этих нежелательных явлений разработана специальная премедикация с использованием дексаметазона.
В настоящее время препарат имеет зарегистрированные показания в США и Европе для применения в I линии лечения при 4 видах опухолей: рак молочной железы, немелкоклеточный рак легкого, рак предстательной железы, рак желудка (2006 г.).
Материалы и методы
Исследование проведено в отделении химиотерапии и отделении амбулаторных методов диагностики и лечения.
Анализировалась эффективность и токсичность трех схем лечения, включающих препараты платины.
Схема А.
Цисплатин 80 мг/м2 в/в капельно в 1-й день, на фоне гипергидратации и антиэметической защиты, включающей блокаторы 5-HT3 рецепторов и дексаметазон.
Капецитабин – внутрь по 1000 мг/м2 х 2 раза в сутки с вечера 1-го дня по утро 15-го дня. Цикл – 21 день.
Схема В.
Оксалиплатин от 85 до 120 мг/м2 (разведенный только на 5%-ой глюкозе) в/в капельно в течение 2 часов на фоне антиэметической защиты, включающей блокаторы 5-HT3 рецепторов и дексаметазон.
Капецитабин – внутрь по 1000 мг/м2 х 2 раза в сутки с вечера 1-го дня по утро 15-го дня. Цикл – 21 день.
Схема С.
Таксотер 75 мг/м2 – 1-часовая в/в инфузия во 2-й день на фоне премедикации дексаметазоном по 8 мг внутрь за 13, 7 и 1 час до инфузии таксотера, затем по 8 мг каждые 12 часов на протяжении 3 суток.
Цисплатин 75 мг/м2 – в/в капельно после таксотера во 2-й день на фоне гипергидратации и антиэметической защиты, включающей блокаторы 5-HT3 рецепторов и дексаметазон.
5-фторурацил – по 500 мг/м2 в/в капельно в течение 3 часов в 1, 2, 3-й дни.
Курсы повторялись каждые 28 дней.
Лечение проводилось до прогрессирования процесса или появления угрожающей жизни токсичности.
Эффективность лечения оценивалась каждые 2 курса химиотерапии у больных, получивших минимум 2 лечебных курса, согласно критериям ВОЗ.
В исследование включались пациенты при наличии морфологически подтвержденного неоперабельного или диссеминированного рака желудка, нерезектабельных метастазов или рецидива заболевания после оперативного лечения, а также пациенты, выполнение хирургического вмешательства которым невозможно вследствие сопутствующих заболеваний или отягощенного общего состояния.
Помимо этого критерии включения предполагали:
- возраст от 18 лет и старше;
- наличие по крайней мере одного очага не менее 2 см, измеряемого в двух взаимно перпендикулярных проекциях, или очага, оцениваемого по протяженности;
- общее состояние больного £3 по шкале ВОЗ;
- адекватную функцию костного мозга (Hb³9г/дл, нейтрофилы ³ 2,0х109/л, тромбоциты ³ 100 х109/л), печени (нормальный уровень общего билирубина, АЛТ и АСТ ³ 3N, щелочная фосфатаза ³ 5N), почек (креатинин < 115мкмоль/л);
- предполагаемую продолжительность жизни более 3 месяцев;
- отсутствие химиотерапии с лечебной целью по поводу рака желудка;
- адъювантная химиотерапия – если таковая проводилась – не должна была включать цисплатин, оксалиплатин или таксаны и должна быть закончена, по крайней мере, за 6 месяцев до начала лечения.
Критерии исключения:
- наличие признаков кишечной непроходимости;
- наличие признаков активного желудочно-кишечного кровотечения;
- активный неконтролируемый инфекционный процесс;
- хроническая диарея;
- метастатическое поражение ЦНС;
- периферическая нейропатия ³ II степени по критериям NCIC;
- сопутствующие заболевания в стадии декомпенсации (сахарный диабет, сердечно-сосудистые, легочные заболевания, болезни печени и почек);
- снижение клиренса креатинина менее 35 мл/мин.;
- повышение уровня билирубина выше нормы;
- психические расстройства, включая деменцию, шизофрению, алкоголизм.
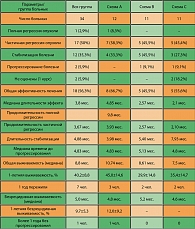
В исследовании участвовало 110 больных. Из них лица пожилого возраста (от 65 лет и старше) составили 30,9% – 34 пациента. Мы представляем данные статистического анализа эффективности и токсичности химиотерапии у пожилых больных с диссеминированным раком желудка.
Согласно протоколу, лечение по схеме А (цисплатин/капецитабин) получили 12 больных, из них – 6 мужчин (50%) и 6 женщин (50%) в возрасте от 65 до 74 лет, медиана – 67 лет. Лечение по схеме В (элоксатин/капецитабин) проведено 11 пациентам: 8 мужчинам (72,7%) и 3 женщинам (27,3%) в возрасте от 65 до 83 лет, медиана – 72 года. Лечение по схеме С (цисплатин/таксотер/5-ФУ) также проведено 11 больным, из них 6 мужчин (54,4%) и 5 женщин (45,4%) в возрасте от 65 до 77 лет, медиана – 69 лет. Всего 34 пациента, медиана – 69 лет.
Предшествующее хирургическое лечение было у 18 (52,9%) больных: у 6 (50%) – из группы А , у 7 (63,6%) – из группы В, у 5 (45,5%) – из группы С (таблица 1).
Контингент включенных в исследование больных характеризовался обширным распространением опухолевого процесса и тяжестью состояния. Вовлечение в опухолевый процесс одного органа наблюдалось у 7 (20,6%) пациентов, 2 органов – у 12 (35,5%) пациентов, 3 – у 6 (17,6%), более 3 органов – у 9 (26,5%) больных.
Распространенность и локализация опухолевого поражения была следующая*:
- первичная опухоль – 17 (50%) больных;
- метастатическое поражение регионарных лимфоузлов – 19 (55,9%) больных;
- метастатическое поражение периферических лимфоузлов – 6 (17,7%) больных;
- метастатическое поражение большого сальника – 5 (15,2%);
- метастатическое поражение брюшины – 6 (17,7%);
- клинически значимый асцит – 7 (20,6%);
- метастатическое поражение печени – 18 (52,9%);
- метастатическое поражение легких – 9 (26,5%);
- клинически значимый плеврит – 2 (5,9%);
- метастатическое поражение костей скелета – 2 (5,9%);
- метастатическое поражение мягких тканей – 1 (2,9%);
- метастатическое поражение органов малого таза – 3 (8,8%).
*данные на всю группу – 34 человека.
На момент начала химиотерапии проводилась оценка общего состояние пожилых пациентов по шкале ВОЗ. Данные представлены в таблице 2.
Необходимо добавить, что состояние практически всех пациентов было отягощено хронической сопутствующей патологией. Так в группе цисплитин/капецитабин одинадцать человек (91,7%) страдали различными по степени тяжести заболеваниями сердечно-сосудистой системы, 2 (16,7%) в анамнезе перенесли тяжелые инфекции (гепатит, менингит), у 3 пациентов был выявлен сахарный диабет. В группу элоксатин/капецитабин были включены 3 (27,3%) пациента с хронической патологией мочевыводящих путей, 9 (81,8%) – с сердечно- сосудистой патологией.
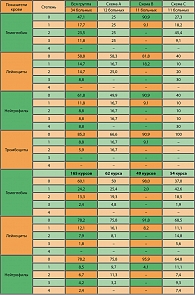
Всего проведено 165 курсов химиотерапии: 62 – по схеме цисплатин/капецитабин, 49 – по схеме элоксатин/капецитабин и 54 курса – по программе цисплатин/таксотер/5-фу. Данные по больным представлены в таблице 3.
Оценка результатов химиотерапии производилась в соответствии с критериями ВОЗ после каждых двух курсов химиотерапии. 2 (18,2%) пациентам в группе С был проведен только 1 курс лечения, в связи с чем они не были включены в число оцененных больных.
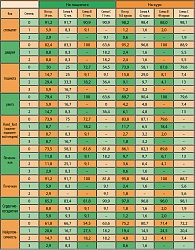
Результаты лечения представлены в таблице 4.
Общая эффективность лечения составила 56,3%, при медиане длительности эффекта 3,8 месяца, медиане времени до прогрессирования болезни – 4,8 месяцев и медиане общей выживаемости – 8,8 месяца, 1 год прожили 40,2% больных.
Оценена токсичность 165 курсов химиотерапии у 34 больных. Гематологическая токсичность, в частности нейтропения, явилась дозолимитирующим видом токсичности, но была умеренно выраженной и обратимой. В целом нейтропения наблюдалась у 38,2% больных, при этом нейтропения III-IV степени – у 17,6 % на 6,6% курсов. Наибольшая частота развития нейтропений III-IV степени была у пациентов, получающих лечение по схеме С – 40% на 16,7% курсов. Наиболее щадящей была схема с элоксатином (В), где падения нейтрофилов до III-IV степени не отмечено. Схема А заняла среднее положение по уровню нейтропенийи – только III степени у 16,7% на 3,2% курсов. Уровень падения гемоглобина достиг 3 степени у 11,8% больных на 2,4% курсов. Наибольшее число анемий III степени, 25% на 4,8% курсов, наблюдалось у больных, Оценена токсичность 138 курсов химиотерапии у 31 больного: 84 курсов на схеме А. Результаты анализа токсичности представлены в таблице 5.
Негематологическая токсичность была редкой, как правило, не превышала II степени. Тошнота (I-III степени) и рвота (I-II степени) чаще регистрировались у больных, получавших цисплатин, и отмечены при проведении 26,1% курсов и 10,3% курсов соответственно. Ладонно-подошвенный синдром III степени был только в группе цисплатин/капецитабин, составил 16,7% на 3,25% курсов.
При лечении таксотером и цисплатином нейротоксичность является одним из видов дозолимитирующей токсичности. В нашем исследовании первые признаки нейротоксичности появлялись после проведения 5-6 курсов лечения. Нейротоксичность I-III степени наблюдалась у 38,2% больных на 24,8% курсов.
Редукция доз цитостатиков проведена у 17 (50%) из 34 больных: у 6 (50%) из группы А, у 4 (36,6%) из группы В и у 7 (63,3%) из группы С. Анализируя данные по редукции доз в группе С (цисплатин/таксотер/5фу) как наиболее обширной, мы получили, что причинами редукции доз группе С послужили: исходная тяжесть состояния – 2 больных, исходное снижение клиренса креатинина – 2 больных, исходное повышение уровня аминотрансфераз и щелочной фосфатазы – 1 больной, фебрильная нейтропения в процессе лечения – 1 больной, нефротоксичность в процессе лечения – 1 больной.
2 пожилым больным в процессе лечения была произведена повторная редукция доз: 1 больному – вследствие повторяющейся неконтролируемой диареи II степени, потребовавшей в конечном итоге отмены 5-ФУ, и 1 больному – вследствие нейротоксичности.
Полученные результаты лечения пожилых больных сопоставимы с эффективностью основных комбинаций, применяемых в мировой практике для различных возрастных категорий. Объективный эффект – 56,3%, медиана времени до прогрессирования болезни – 4,8 мес., медиана выживаемости – 8,8 мес.
Возрастное снижение клиренса креатинина и ограниченные возможности применения гипергидратации лимитировали использование цисплатина у лиц пожилого возраста. Однако наши исследования свидетельствуют о том, что и цисплатин может успешно применяться для лечения пожилых больных. Введение в клиническую практику цитостатиков последнего поколения (таксаны, оксалиплатин, кселода и т. д.) и создаваемые на их основе режимы расширили возможности применения химиотерапии у лиц пожилого возраста.
Результаты нашего исследования подтверждают возможность проведения активной химиотерапии лицам пожилого возраста. Адаптация доз в соответствии с объективным статусом больного и функциональным состоянием организма позволяет проводить стандартную химиотерапию без снижения эффективности и увеличения токсичности лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.