Миметики инкретинов в лечении сахарного диабета типа 2
- Аннотация
- Статья
- Ссылки





Клинические последствия заболевания хорошо известны – это поздние осложнения СД, ведущие к ранней инвалидности и высокой смертности пациентов, уменьшению продолжительности и качества их жизни. СД типа 2 приводит к четырехкратному увеличению смертности от сердечно-сосудистых заболеваний, является ведущей причиной терминальной почечной недостаточности, потери зрения и нетравматической ампутации нижних конечностей.
Сахароснижающая терапия редко позволяет добиться снижения гликированного гемоглобина (HbА1c) до целевого уровня 7%: в РФ трое из четверых больных СД типа 2 имеют HbА1c более 7%. Согласно данным исследований UKPDS и ADOPT, по мере увеличения длительности заболевания гликемический контроль ухудшается вне зависимости от проводимой терапии, что приводит к увеличению суточной дозы и назначению дополнительных сахароснижающих препаратов. Показатели контроля гликемии ухудшаются примерно на 1,7% HbA1c (рисунок 1).
Область исследований СД типа 2 постоянно расширяется, и все большее внимание ученых и специалистов привлекают новые препараты, которые эффективно снижают уровень HbА1c и обладают другими благоприятными метаболическими эффектами (1, 2, 13). Прогрессирование СД типа 2 характеризуется следующими особенностями:
- ухудшением функции b-клеток поджелудочной железы;
- ухудшением показателей HbА1c, постпрандиальной гликемии и гликемии натощак;
- увеличением массы тела пациентов;
- повышением потребности в препаратах, которые способствуют увеличению риска развития гипогликемий и увеличения веса тела;
- возрастанием риска развития острого инфаркта миокарда, острого нарушения мозгового кровообращения, развития микро- и макрососудистых осложнений с соответствующим увеличением показателей смертности и затрат на их лечение.
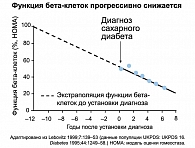
В настоящее время многое изменилось в понимании патогенетических основ развития СД типа 2 (5, 12, 15). Прогрессирующая дисфункция b-клеток и инсулинорезистентность являются основными фундаментальными нарушениями при СД типа 2; по мере увеличения длительности заболевания отмечается прогрессирующее ухудшение функции b-клеток (рисунок 2).
Помимо инсулина, глюкагон, стимулируя продукции глюкозы печенью, является важным регулятором метаболизма глюкозы. При СД типа 2 концентрации глюкагона в плазме парадоксально повышены, что приводит к увеличению гепатической продукции глюкозы, способствуя постпрандиальной гипергликемии (1, 13).
Инкретины являются семейством гормонов, стимулирующих секрецию инсулина и подавляющих секрецию глюкагона в ответ на прием пищи (13, 15, 16). Влияя на секрецию этих пептидов, гормоны желудочно-кишечного тракта (ЖКТ) – инкретины играют важную роль в регуляции гомеостаза глюкозы в организме. У здоровых людей около 60% постпрандиальной секреции инсулина обусловлено именно инкретиновым эффектом, который значительно снижен у больных с СД типа 2 и НТГ (1, 3, 12).
Среди пептидов, которые вырабатываются в ЖКТ в ответ на поступление пищи, наибольшее внимание ученых привлекает глюкагоноподобный пептид-1 (ГПП-1) – секреторный продукт высокоспециализированных энтероэндокринных L-клеток ЖКТ (13, 16). В основе действия ГПП-1, стимулирующего секрецию инсулина и подавляющего секрецию глюкагона после приема пищи, лежит глюкозозависимый механизм. Важно, что этот инкретин в значительной степени потенцирует инсулинотропную активность самой глюкозы, а также стимулирует все этапы биосинтеза инсулина, транскрипцию гена проинсулина и инсулина, обеспечивая непрерывное адекватное поступление для секреции инсулина (5, 16). При исследованиях животных моделей и in vitro было отмечено увеличение массы b-клеток и улучшение их функции (13). Секреция ГПП-1 в течение дня коррелирует с выделением инсулина (16). Под влиянием дипептидил пептидазы 4 (ДПП-4) происходит его быстрая инактивация с образованием неактивных метаболитов амида ГПП-1 (9-36) и ГПП-1 (9-37), выступающих в роли антагонистов ГПП-1 рецепторов (13, 16).
Последние исследования выявили следующие эффекты ГПП-1:
- потенцирует глюкозозависимую секрецию инсулина;
- восстанавливает первую и вторую фазы секреции инсулина;
- усиливает биосинтез инсулина;
- повышает экспрессию гена инсулина;
- повышает экспрессию генов, важных для функции β-клеток (глюкокиназы, GLUT 2 и др.);
- оказывает митотическое действие на β-клетки и способствует дифференцировке клеток-предшественников протоков;
- подавляет апоптоз β-клеток;
- подавляет секрецию глюкагона.
ГПП-1 представляет собой один из нескольких гормонов, контролирующих эвакуацию пищи из желудка (1, 13). Регулируя скорость опорожнения желудка, ГПП-1 вызывает медленное поступление нутриентов из желудка в тонкий кишечник, тем самым оказывает влияние на прандиальную экскурсию глюкозы. Являясь медиатором чувства насыщения в ЦНС, ГПП-1 подавляет аппетит и снижает потребление пищи как у здоровых людей, так и у больных СД типа 2 (13, 19).
Научные исследования, свидетельствующие о дефиците ГПП-1 при сохранении его инсулинотропной активности у больных СД типа 2, стали основой для нового направления в фармакотерапии заболевания (1, 2, 14). При СД типа 2 назначение экзогенного ГПП-1 приводит к нормализации гликемии (3). Учитывая короткий биологический период полужизни ГПП-1, для использования его важных метаболических эффектов было разработано два новых подхода в лечении СД типа 2. Один терапевтический подход заключается в использовании миметиков инкретина длительного действия для подкожного введения (3, 13, 16). Эксенатид является первым миметиком инкретина, появившимся в клинической практике; в настоящее время разработан еще один препарат этой группы (лираглютид), но он еще не доступен для использования (18). Другой подход заключается в ингибировании деградации инкретинов посредством блокады фермента ДПП-4. В отличие от подкожно вводимых миметиков инкретина, ингибиторы ДПП-4 эффективны при пероральном приеме (2, 5).
Миметик инкретина – эксенатид
В 1992 г. из секретов слюнных желез ящерицы Gila Monster (Heloderma suspectum, ящерица-ядозуб) был изолирован пептид эксенатид-4, структура которого состоит из 39 аминокислот и имеет 53%-ную гомологию с ГПП-1 человека (1, 5, 13). Этот пептид активно выделяется в процессе поглощения пищи и обладает рядом функций, связанных с пищеварением и усвоением энергии (3) (рисунок 3). На основании строения данного пептида создан его синтетический аналог – эксенатид (Баета) (3, 16).
Эксенатид-4 (эксенатид) является продуктом отдельного гена, отличного от гена проглюкагона, экспрессирующего ГПП-1 у ящерицы-ядозуба. Соединяясь с рецептором ГПП-1 в поджелудочной железе и других органах и тканях мишенях, эксенатид оказывает разнообразные антигипергликемические и глюкозорегуляторные эффекты, сходные с действием эндогенного ГПП-1 (4, 13). В отличие от ГПП-1 эксенатид устойчив к ДПП-4 из-за особенностей аминокислотной последовательности (глицин во 2-й позиции) и обладает существенно большей продолжительностью действия: период его полужизни составляет примерно 2,5 часа, а его терапевтическая концентрация в крови сохраняется в течение суток при двукратном применении препарата (1, 16).
В недавних исследования было показано, что после нагрузки глюкозой при внутривенном введении эксенатида у больных СД типа 2 восстанавливаются первая и вторая фазы секреции инсулина (5, 6). Эти результаты свидетельствуют, что кратковременное внутривенное введение эксенатида может улучшать функцию b-клеток поджелудочной железы у пациентов с СД типа 2 (6).
Долгосрочные плацебо контролируемые исследования
В различных международных иccледoвaниях былo продемонcтрировaнo, чтo эффекты экcенaтидa нeзaвиcимы от длительнocти и степени тяжести СД типа 2 (7, 8, 9, 10, 11). Данные о применении эксенатида представляют огромный научно-практический интерес. Так, проводилась оценка влияния эксенатида на показатели гликемического контроля у пациентов с СД типа 2, находившихся на терапии метформином, препаратами сульфонилмочевины или на комбинации указанных препаратов в трех тройных слепых, плацебо контролируемых клинических исследованиях III фазы (7, 8, 9). Исходный уровень HbA1c, по данным этих исследований, составлял 8,2-8,6% и средняя длительность СД типа 2 составила 4,8-8,7 лет. Длительность терапии препаратами исследования составила 30 недель в каждом случае с предшествовавшим периодом назначения плацебо в течение 4 недель. Дополнительное назначение эксенатида к пероральным сахароснижающим препаратам (ПССП) способствовало значительному улучшению показателей контроля гликемии у больных СД типа 2. Средние концентрации HbA1c, гликемии натощак и постпрандиально значительно снизились при 30-недельном подкожном введении по 10 мкг эксенатида 2 раза в день: достигнуто снижение HbA1c на 0,77-0,86%, против увеличения на 0,1-0,2% в группе плацебо. Более того, было отмечено прогрессирующее снижение средней массы тела у обследуемых: при терапии эксенатидом в дозе 20 мкг/сут и препаратами сульфонилмочевины (ПСМ) вес снизился на 1,3 кг; при терапии эксенатидом и комбинированной терапией ПСМ в сочетании с метформином – на 1,6 кг, а при комбинации эксенатида с метформином – на 2,8 кг (7, 8, 9).
Сравнительные исследования с активным компонентом
В двух других открытых рандомизированных исследованиях, больным СД типа 2, находившимся на комбинированной терапии метформином и ПСМ и не достигавших адекватного контроля гликемии, назначалась терапия эксенатидом или двумя различными инсулинами (гларгин и двухфазный инсулин аспарт) (10, 11). Длительность СД у этих пациентов составляла 9,8 и 9,9 лет соответственно. Согласно критериям включения, в исследования вошли пациенты, получавшие оптимально переносимые дозы ПССП. Дозы метформина и ПСМ оставались прежними, за исключением гипогликемий, когда рекомендовалось снизить дозу ПСМ (10, 11). Кроме того, показатели углеводного обмена пациентов соответствовали критериям Европейской Ассоциации по изучению сахарного диабета и Американской Диабетологической ассоциации, необходимым для инициации инсулинотерапии при СД типа 2 (12).
Так, в 26-недельном исследовании эффективности эксенатида по сравнению с инсулином гларгин (551 пациента с СД типа 2) при дополнительном назначении эксенатида показатели контроля гликемии были не хуже, чем при дополнительной терапии инсулином гларгин (10). Достоверное снижение уровня HbA1c на 1,1% было достигнуто как при терапии гларгином, так и при терапии эксенатидом, начиная от исходного уровня HbA1c 8,2% и 8,3% соответственно. Одинаковым было и число участников, достигших уровня HbA1c £ 7%.
Серьезной проблемой при лечении СД является увеличение массы тела (1, 18), прогрессирующее по мере увеличения длительности сахарного диабета. На рисунке 4 представлены данные по динамике массы тела по данным исследований UKPDS и ADOPT.
У больных, которые находились на терапии эксенатидом (10 мкг 2 раза в день), наблюдалось прогрессирующее снижение массы тела (в среднем на 2,3 кг). Напротив, на терапии инсулином гларгин масса тела пациентов в ходе исследования увеличилась в среднем на 1,8 кг. Не было выявлено различий между группами в частоте встречаемости гипогликемий (в среднем 7,3 эпизода/пациенто-год в группе эксенатида по сравнению с 6,3 эпизода/пациенто-год в группе инсулина гларгин). У пациентов в группе эксенатида частота ночных гипогликемий была меньше, а гипогликемий в дневное время – больше, чем у пациентов, находившихся на терапии инсулином гларгин (10).
В 52-недельном исследовании безопасности и эффективности эксенатида по сравнению с двухфазным инсулином аспарт у больных СД типа 2 достоверное снижение уровня HbA1c отмечалось в обеих группах: на 0,89% в группе аспарт и на 1,04% в группе эксенатида (11). Снижение показателей гликемии натощак было сопоставимо в обеих группах терапии (примерно на 1,7 ммоль/л) при более выраженном снижении постпрандиальной гликемии в группе эксенатида по сравнению с группой двухфазного инсулина аспарт. Аналогично результатам других исследований, терапия эксенатидом привела к снижению массы тела, напротив, терапия двухфазным инсулином аспарт характеризовалась стабильным ее увеличением. Средние показатели массы тела статистически достоверно различались между двумя группами терапии уже на второй неделе после начала лечения, а к концу исследования эти различия составили 5,2 ± 0,2 кг.
В таблице представлен анализ клинических исследований по терапии эксенатидом.
Побочные эффекты и безопасность терапии эксенатидом
Желудочно-кишечные нарушения. Наиболее частыми побочными эффектами на терапии эксенатидом были ЖКТ нарушения (7, 8, 9). Наиболее часто встречавшимися побочными эффектами у пациентов, получавшими терапию эксенатидом, по сравнению с пациентами, получавшими лечение инсулином гларгин, были тошнота (57,1%) и рвота (17,4%) (10). Частота встречаемости побочных эффектов со стороны ЖКТ в группе терапии эксенатидом была выше по сравнению с группой терапии инсулином аспарт (11). При терапии эксенатидом отмечалась умеренная тошнота (33,2%) и рвота (15%). Средние уровни частоты встречаемости других побочных эффектов были аналогичными между группами терапии.
В 30-недельных плацебо контролируемых исследованиях наиболее частым побочным эффектом также была тошнота (45-51%), особенно, начиная от четвертой до восьмой недели, когда доза эксенатида увеличивалась с 5 до 10 мкг; частота тошноты снижалась у пациентов по мере продолжения терапии эксенатидом (7, 8, 9).
Гипогликемия. Одним из преимуществ эксенатида при терапии пациентов с СД типа 2 является улучшение показателей контроля гликемии без сопутствующего развития гипогликемических состояний (4, 13, 16). В 30-недельных плацебо контролируемых исследованиях частота гипогликемий зависела от сопутствующей терапии ПССП (7, 8, 9). Так, на фоне терапии эксенатидом в сочетании с метформином повышения частоты гипогликемий не было (8). Однако частота гипогликемий возрастала, когда одновременно с эксенатидом назначали ПСМ (7). В одном из трех плацебо контролируемых исследований III фазы отмечено, что уменьшение дозы ПСМ снижало частоту гипогликемий у пациентов, находившихся на терапии эксенатидом (7). Во всех этих исследованиях эпизоды гипогликемии обычно имели легкую или умеренную степень тяжести.
Результаты аналогичного исследования показали, что исходный уровень HbA1c близкий к 7% ассоциировался с более высокой частотой развития гипогликемических состояний. По данным B. Gallwitz и соавт. (5), терапия эксенатидом хорошо переносилась, тяжелых побочных эффектов, за исключением единственного случая развития тяжелой гипогликемии на фоне комбинированной терапии ПСМ и метформином, не было выявлено.
Аутоантитела к эксенатиду. Антитела к эксенатиду определяются, как правило, в низком титре, а в некоторых случаях – в высоком титре при длительной терапии эксенатидом. Важно, что присутствие этих антител не оказывает влияние как на эффективность терапии, так и на частоту и выраженность побочных эффектов (13, 17).
Следует отметить, что влияние терапии эксенатидом на массу тела больных СД типа 2 также является неоспоримым преимуществом терапии инкретин миметиками (1, 5, 15). Предполагалось, что похудение может быть обусловлено развитием желудочно-кишечных расстройств, но впоследствии было установлено, что назначение эксенатида приводило к снижению массы тела в независимости от развития этих побочных реакций (15).
Терапевтический потенциал инкретин миметика эксенатида при СД типа 2
На рисунке 5 представлены основные эффекты препарата эксенатид при СД типа 2.
С позиций высокого риска заболеваний, связанных с атеросклерозом, при СД типа 2 важно, что инкретин миметики, включая эксенатид, обладают потенциальным положительным влиянием на кардио-васкулярную систему. Это влияние обусловлено рядом следующих важных факторов (Holst J.J., 2007).
- Рецепторы к ГПП-1 обнаружены в сердце.
- У мышей с нокаутированным (отключенным) рецептором ГПП-1 нарушена сократимость левого желудочка, отмечено нарушение диастолической функции.
- Антигипертензивные эффекты ГПП-1 выявлены у крыс Dahl c повышенной солевой чувствительностью.
- ГПП-1 улучшает кардиальную функцию у собак с сердечной недостаточностью (как средство терапии).
- ГПП-1 защищает миокард крыс от ишемического / реперфузионного повреждения (как средство профилактики).
- Назначение ГПП-1 пациентам с острым инфарктом миокарда и низкой фракцией выброса левого желудочка, равной 29%, после ангиопластики улучшало ее до 39%.
- ГПП-1 улучшает эндотелиальную дисфункцию у пациентов с СД типа 2 с ИБС.
Заключение
Внедрение в клиническую практику инкретин миметика эксенатида дает клиницистам уникальное средство лечения больных СД типа 2 с неудовлетворительным контролем гликемии при использовании ПССП. По современным оценкам эпидемиологов, только 36% пациентов достигают рекомендованных целевых показателей HbA1c. Помимо этого, приверженность терапии ограничивается развитием ряда нежелательных эффектов: увеличение массы тела и риск гипогликемий при лечении ПСМ и инсулином, ЖКТ нарушения при терапии метформином, увеличение веса и периферические отеки при терапии тиазолидиндионами.
С учетом этих эффектов, такие фармакологические свойства эксенатида, как влияние на постпрандиальную гипергликемию и HbA1c в сочетании с отсутствием гипогликемий и со снижением массы тела пациентов, приобретают большое практическое значение. Препарат Баета не требует сложного режима титрования, так как применяется в фиксированных дозах. В целом фармакотерапия СД типа 2 с дополнительным назначением миметиков инкретина является патогенетически оправданной, эффективной и обычно хорошо переносится пациентами.
Инкретин миметики становятся все более заметными как средства эффективного улучшения контроля гликемии, поскольку к явным преимуществам такой терапии следует отнести улучшение функции b-клеток, показателей контроля гликемии, массы тела и снижение риска осложнений, обусловленных СД. Несомненно, что все эти преимущества, наряду с возможными отрицательными эффектами и осложнениями терапии, будут активно изучаться в последующие годы.
Целесообразно привести доводы одного из вдохновителей и главных исследователей UKPDS, известного профессора D. Matthews, в ходе дебатов на EASD (Амстердам, 2007) по следующему вопросу: смогут ли миметики инкретинов и ингибиторы ДПП-4 заменить терапию другими препаратами при СД типа 2? На данном этапе дополнительное назначение новых препаратов в дополнение к старым хорошо проверенным средствам лучше полного замещения старых известных препаратов на новые, поскольку:
- отсутствуют долговременные исследования по изучению эффектов этих препаратов;
- отсутствуют исследования по изучению сердечно-сосудистых клинических исходов такой терапии;
- снижение массы тела при терапии новыми препаратами – это доказанный хороший эффект в краткосрочной перспективе, нет результатов в отношении долгосрочной перспективы у этой группы пациентов;
- СД типа 2 – гетерогенное заболевание, и в ряде случаев пациентам показаны только ПСМ.
Таким образом, безусловно, необходимо дальнейшее изучение эффективности и безопасности нового класса препаратов инкретин миметиков, вместе с тем динамичный прогресс в изучении СД типа 2 и создание новых, перспективных сахароснижающих препаратов дают врачам и пациентам надежду на будущее.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.