Иммунология и иммунотерапия рака молочной железы
- Аннотация
- Статья
- Ссылки
- English

Введение
Роль опухоль-инфильтрирующих лимфоцитов (TILs) при раке молочной железы (РМЖ) подробно изучалась на протяжении последнего десятилетия. Результаты множества исследований продемонстрировали взаимосвязь между высокими уровнями TILs при постановке диагноза и лучшим ответом на химиотерапию [1–3], а также лучшим прогнозом при адъювантной химиотерапии [4, 5], особенно при трижды негативном и HER2-позитивном РМЖ. Лишь в нескольких исследованиях оценивали TILs в резидуальной опухоли после неоадъювантной химиотерапии (NAC) и их прогностическую значимость.
Прогностическое значение TILs
A. Hamy и соавт. [6] оценивали связь между уровнями TILs (до, во время и после неоадъювантной химиотерапии) и ответом на лечение, а также их прогностическое значение у 175 пациентов с HER2-позитивным РМЖ.
Образцы опухоли, полученные при трепанбиопсии до лечения, и хирургические препараты после неоадъювантной терапии оценивали на предмет мононуклеарного клеточного инфильтрата (в том числе лимфоциты и плазматические клетки, за исключением полиморфноядерных лейкоцитов), согласно рекомендациям международной группы TILs Working Group [7]. Чтобы убедиться, что инфильтрат мононуклеарных клеток, считающийся TILs, относится к лимфоцитам, A. Hamy и соавт. [6] провели CD3+-иммуноокрашивание выборочно из 20 хирургических препаратов, что в значительной мере коррелировало с уровнями неокрашенных.
Исходная медиана уровня TILs составила 25% (размах – 2–70%). Исходные уровни TILs у пациентов с большими размерами (> 5 мм) метастазов в лимфатических узлах были выше, чем у всех пациентов с метастазами (36,8 vs 22,9%; p = 0,02).
После химиотерапии средний процент TILs снизился до 10 (1–90). В целом уровень TILs уменьшился у 136 (78%) пациентов, не изменился у 18 (10%), увеличился у 21 (12%) больного. Разнообразие показателей TILs в высокой степени ассоциировалось с достижением pСR (p < 10-5). При этом максимальное снижение уровня TILs чаще наблюдалось при достижении полного патоморфологического ответа (pCR).
В одномерном анализе исходные уровни TILs не были связаны с достижением pCR. Никакие исходные характеристики пациента или опухоли статистически значимо не ассоциировались с уровнем TILs, наблюдаемым после неоадъювантной химиотерапии. В то же время уровень инфильтрации TILs существенно коррелировал с параметрами опухоли после неоадъювантной химиотерапии и был выше в опухолях с агрессивными свойствами (отсутствие pCR, высокий класс RCB, высокий митотический индекс и значительная резидуальная опухолевая клеточность (p < 0,001), вовлечение лимфатических узлов (p = 0,054), наличие более крупных (> 5 мм) метастазов в лимфатических узлах (p = 0,001)).
Связь между большей частотой достижения pCR и значительным снижением уровня TILs после неоадъювантной химиотерапии, которую обнаружили A. Hamy и соавт. [6], была также установлена H.R. Ali и соавт. [8], которые первыми указали на взаимосвязь между высокой плотностью лимфоцитов и относительной химиорезистентностью. S. Ladoire и соавт. [9] предположили, что более высокая частота pCR может быть обусловлена исчезновением FOXP3+ Т-лимфоцитов.
Интересно, что M.V. Dieci и соавт. получили противоположные результаты [10]. Показано, что при трижды негативном раке высокий уровень TILs в резидуальной опухоли ассоциируется с отсутствием метастатического поражения подмышечных лимфатических узлов.
Вероятно, значение TILs может быть неодинаковым при разных подтипах РМЖ. При трижды негативном РМЖ исходные уровни TILs коррелируют с pCR [3, 11], в то время как при HER2-позитивном раке данный эффект неоднозначен [7, 12–14].
Нелинейная ассоциация между уровнями TILs и достижением pCR показана в исследованиях NeoSPHERE [12] и NeoALTTO. В исследовании A. Hamy и соавт. [6] исходный уровень TILs не ассоциировался с pCR, что соответствовало результатам исследований NeoSPHERE [12], NeoALTTO [7] и Gepar Septo [13]. При этом он коррелировал с ответом на химиотерапию в исследованиях GeparQuattro и GeparQuinto [14].
По мнению исследователей, полноценная характеристика лимфоцитарной инфильтрации, присутствующей в резидуальной опухоли и определяемой подгруппами TILs, в дальнейшем будет способствовать пониманию механизмов химиорезистентности и противоопухолевой иммунной активности. Кроме того, иммунное окрашивание PD-1, PD-L1, CTLA4 способно предоставить лечебно-диагностическую информацию для определения пациентов, у которых наиболее вероятен эффект от лечения с восстановлением чувствительности к противоопухолевой терапии.
Поиск предиктивных биомаркеров иммунотерапии HER2-позитивного РМЖ
Амплификация гена HER2 наблюдается приблизительно у 20% пациентов с РМЖ и ассоциируется с низкой выживаемостью. В настоящее время предиктивных биомаркеров, подходящих для клинической практики у пациентов с HER2+ РМЖ, нет. Хелпер Т-лимфоцитов 1-го типа (Th1) необходим для активации противоопухолевых цитотоксических Т-лимфоцитов (CTL) для клиренса и воздействия на опухоль. При этом для развития CTL-опосредованного противоопухолевого ответа необходимо также наличие фактора интерферона гамма, секретируемого Th1-клетками. Как известно, трастузумаб может индуцировать антителозависимую клеточно-опосредованную цитотоксичность, осуществляемую клетками – естественными киллерами (NK, natural killer cels). В этом механизме активированные трастузумабом NK-клетки могут подталкивать Th1-клетки, стимулируя их дифференциацию и созревание. Более того, опосредованная NK-клетками антителозависимая цитотоксичность может усилить проницаемость мембран опухолевых клеток через образование пор, индуцированных перфоринами, секретируемыми NK-клетками.
Как показали результаты исследования NOAH, увеличение бессобытийной выживаемости при добавлении трастузумаба к химиотерапии таксанами и антрациклинами связано не только с достижением полного патоморфологического регресса, но и с иммунологическим механизмом действия этого моноклонального антитела [15].
Иммуногистохимическая экспрессия PD-L1
PD-L1 является внеклеточным протеином. Он тормозит иммунные ответы, связывая два своих рецептора – PD-1 и B7-1.
В исследовании NeoSphere продемонстрирован вклад иммунной системы в вероятность ответа на различные виды терапии. В частности, экспрессия иммунной контрольной точки PD-L1 имеет значение в развитии резистентности ко всем схемам, используемым в исследовании, и на эту резистентность также влияет экспрессия генов, связанных с MHC1 и ингибирующих антителозависимую клеточную цитотоксичность.
При многофакторном анализе высокая экспрессия метагенов PD-L1, MHC1 и IF-I коррелировала с резистентностью (низкие уровни pCR) к режимам TH, HP и TP, тогда как высокая экспрессия PD-1, STAT1 и MHC2 была связана с более высокой частотой pCR. В однофакторном анализе данные маркеры также ассоциировались с частотой pCR, но такая взаимосвязь оказалась более выраженной на многофакторной модели.
В настоящее время экспрессия белка PD-L1 изучается в качестве прогностического маркера при назначении препаратов пембролизумаб, атезолизумаб, направленных на PD-1/PD-L1, в некоторых клинических ситуациях. Следует отметить, что в испытании NeoSphere только в небольшом количестве образцов показана экспрессия PD-L1 на опухолевых клетках. Данное наблюдение и выраженная взаимосвязь между экспрессией PD-L1 и TIL согласуются с концепцией о том, что иммуносупрессивные сигнальные пути могут быть индуцированы по механизму отрицательной обратной связи в большей степени, чем напрямую управляемыми самими опухолевыми клетками [12].
Иммунология трижды негативного РМЖ
Что приводит к повышению частоты инфильтрации иммунокомпетентными клетками опухоли при трижды негативном РМЖ по сравнению с другими биологическими подтипами?
Одним из потенциальных механизмов иммуногенности трижды негативного РМЖ является генетическая нестабильность, а также высокая частота мутаций. Мутантные гены способны кодировать белки, которые воспринимаются иммунной системой как измененные. Пептидные эпитопы, содержащие мутацию и представленные Т-клетками в главном комплексе гистосовместимости, могут восприниматься как более чужеродные, чем немутированные последовательности.
При трижды негативном РМЖ чаще, чем при других подтипах, наблюдаются хромосомная нестабильность и потенциально более высокая частота мутаций [16]. При изучении свыше 300 опухолей РМЖ, хотя хромосомная нестабильность – фактор худшего прогноза для большинства подтипов, при трижды негативном РМЖ это явление не оказывало клинически значимого эффекта.
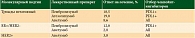
Комбинация ингибиторов контрольных точек атезолизумаба и наб-паклитаксела продемонстрировала высокую эффективность при трижды негативном РМЖ (табл. 1).
Поскольку трижды негативный РМЖ представляется биологическим подтипом, наиболее часто ассоциированным с наличием TILs, были проведены клинические исследования целесообразности применения иммунных чекпойнт (контрольно-пропускных) ингибиторов в качестве потенциально эффективного лечебного подхода. Иммунные чекпойнт-протеины экспрессируются на нормальных клетках, клетках системы врожденного иммунитета и лимфоцитах. Т-клетка при взаимодействии через белковый рецептор иммунного чекпойнта (например, PD-1) c соответствующим рецептором на антиген-презентирующих клетках (АПК) или опухолевой клетке (в частности, PD-L1) подвергается инактивации. Иммунные чекпойнт-ингибиторы в монотерапии распространенного РМЖ представлены в табл. 2 [1].
В настоящее время продолжается ряд исследований, в которых оценивается вклад анти-PD-L1-терапии в комбинации с химиотерапией при метастатическом РМЖ. Так, в одном из исследований [17] объективный ответ зарегистрирован у 24 (42%) пациентов с метастатическим трижды негативным РМЖ на фоне терапии анти-PD-L1 (атезолизумаб) в комбинации с наб-паклитакселом. Комбинация эрибулина с анти-PD-1 у 39 пациентов, предлеченных по поводу метастатического трижды негативного РМЖ, вызвала ответ в 33% случаев [18]. До сих пор остается неясным, связана ли эта синергия между анти-PD-L1 и химиотерапией с прямым воздействием на рост опухоли или предположительными иммуномодулирующими аспектами химиотерапии [19].
В 2014 г. были представлены предварительные данные исследования первой фазы анти-PD-L1-моноклонального антитела MPDL3280A в лечении метастатического трижды негативного РМЖ. В настоящее время L. Emens и соавт. провели лечение 27 пациентов с PD-L1-позитивным трижды негативным РМЖ с использованием атезолизумаба.
Атезолизумаб (atezo; MPDL3280A) – гуманизированное анти-PD-L1-
антитело, ингибирующее присоединение PD-L1 к PD-1 и В7.1, но оставляющее сцепление PD-L2/PD-1 интактным. Трижды негативный РМЖ характеризуется высокими уровнями инфильтрирующих опухоль иммунных клеток, увеличенной экспрессией PD-L1 и высокой частотой мутаций, что может генерировать иммуногенные неоантигены, делая их привлекательными для PD-L1-таргетной терапии атезолизумабом. Монотерапия с использованием атезолизумаба показала устойчивые ответы при метастатическом трижды негативном РМЖ [20]. Кроме того, атезолизумаб в комбинации с наб-паклитакселом продемонстрировал многообещающую толерантность и активность при метастатическом трижды негативном РМЖ. Собственно наб-паклитаксел характеризуется высокой противоопухолевой активностью, что может обеспечить благоприятные изменения иммунного микроокружения опухоли.
Впервые за многие годы удалось превзойти эффективность действующей стандартной терапии трижды негативного РМЖ, мелкоклеточного рака легкого, уротелиального рака. Атезолизумаб стал первым зарегистрированным в России препаратом для первой линии терапии метастатического трижды негативного РМЖ. Решение о регистрации препарата принято на основании данных клинического исследования III фазы IMpassion131, проведенного D. Miles и соавт. совместно со специалистами НМИЦ онкологии им. Н.Н. Петрова [17]. В исследование были включены 902 пациента с местнораспространенным или метастатическим трижды негативным РМЖ. Больные были рандомизированы на две группы – группу атезолизумаба в комбинации с наб-паклитакселом и группу плацебо и наб-паклитаксела. В группе атезолизумаба в комбинации с наб-паклитакселом отмечалось достоверное снижение риска прогрессирования или смерти на 38%, а также клинически значимое увеличение общей выживаемости (25 vs 15,5 месяца) по сравнению с монотерапией наб-паклитакселом у пациентов с экспрессией PD-L1 > 1%.
Трижды негативный РМЖ трудно поддается лечению. Только в 20–30% случаев наблюдается ответ на неоадъювантную химиотерапию. В то же время у пациентов, не ответивших на лечение, исход заболевания остается неблагоприятным. Подключение иммунной системы в перспективе ассоциируется с оптимальной персонализированной противоопухолевой терапией. Имеющиеся данные свидетельствуют о том, что иммунотерапия, основанная на использовании ингибиторов контрольных точек, может стать терапевтическим выбором для пациентов с трижды негативным РМЖ. Так, наличие CD8+ T-клеток можно считать ключевым компонентом цитотоксической ветви адаптивного иммунного ответа, ассоциированного с хорошим клиническим исходом у пациентов с трижды негативным РМЖ. В частности, выраженная инвазия и инфильтрация CD8+ Т-клетками в опухоли коррелируют с хорошим исходом. Вместе с тем некоторые опухоли аккумулируют CD8+ Т-клетки в связанной с опухолью строме, но со слабой инфильтрацией в опухолевом эпителии. Пациенты с такими опухолями характеризуются неблагоприятным исходом.
Обсуждение
Потенциальная чувствительность каждого вида рака к иммуноонкологическому воздействию зависит от способности опухоли к запуску ответа иммунной системы (то есть от ее иммуногенности).
Рак характеризуется накоплением генетических мутаций, многие из которых приводят к экспрессии специфичных антигенов опухоли, способных связываться с белковыми молекулами класса I основного комплекса гистосовместимости (МНС) на поверхности раковой клетки. Эти комплексы (антиген – МНС) могут быть распознаны цитотоксическими CD8+ и CD4+ Т-лимфоцитами через антиген-представляющие или дендритные клетки. Только после активации CD8+-лимфоциты могут создать иммунный ответ против опухоли. В результате опухоли с высокой концентрацией соматических мутаций становятся более восприимчивы к иммуноонкологическому воздействию, чем опухоли с низкой скоростью мутаций. Концентрация соматических мутаций заметно различается как между типами опухолей, так и внутри индивидуального типа опухоли: частота мутаций может различаться более чем в 1000 раз между опухолями с самой высокой и самой низкой частотой мутаций.
В сфере иммунотерапии получено официальное одобрение на применение ингибиторов PD-1 и PD-L1 (пембролизумаб, атезолизумаб) для лечения ряда злокачественных новообразований.
Формируется важная концепция о том, что опухолевые антигены должны быть представлены лимфоцитам-киллерам антиген-представляющими дендритными клетками специализированной линии. Такое подмножество дендритных клеток могут представлять антигены «секонд хенд», полученные из других клеток, таких как опухолевые клетки первичного и CD8 Т-клеточного ответа.
R. Sanchez-Paulete и соавт. [21] уже описали главных «игроков» подобной кросс-презентации на клеточном и молекулярном уровнях и проанализировали, как они влияют на активность различных видов противоопухолевой терапии, в частности химио- и радиотерапии, посредством иммуногенной клеточной гибели (апоптоза) и кросс-прайминга. Такое количество терапевтических механизмов, включая ингибиторы контрольных точек и адаптивную T-клеточную терапию, необходимо для того, чтобы иммунотерапия работала.
Возможность уничтожения опухоли связана с активацией 1-го типа иммунного ответа. При 1-м типе иммунного ответа CD4 T-хелперы, Th1-лимфоциты секретируют цитокины – интерферон гамма и фактор некроза опухоли альфа, которые активируют и усиливают литическую функцию CD8 Т-лимфоцитов. Цитокины, вырабатываемые Т-клетками 1-го типа, улучшают экспрессию молекул на АПК, что позволяет им более эффективно презентировать (поставлять) иммуногенные протеины. CD8 Т-клетки являются цитотоксическими, и после присоединения к клетке-мишени и взаимодействия с антигенными пептидами, содержащими главный комплекс гистосовместимости, запускают процессы старения клетки-мишени (вплоть до апоптоза) или напрямую осуществляют лизис клетки за счет последовательных ферментных реакций.
При РМЖ могут секретироваться вещества, влияющие на АПК и нарушающие процесс «обучения» Т-клеток, что приводит к их превращению в клетки 2-го, но не 1-го типа [22]. Большинство антигенов, выделяющихся при РМЖ, – собственные протеины. Это та группа антигенов, которая с наибольшей частотой стимулирует Т-клетки на развитие регуляторного иммунного ответа 2-го типа [23], обеспечивающего беспрепятственный рост опухоли. Кроме того, в 30–50% случаев РМЖ отмечается повышенная экспрессия рецептора лиганда программируемой клеточной гибели 1 (PD-L1) на поверхности клеточных мембран [24]. При связи PD-L1 с белком программируемой клеточной гибели 1 (PD-1) на поверхности Т-клетки происходит инактивация лимфоцита. Это лишь малая часть механизмов, предотвращающих быстрый иммунный ответ 1-го типа при РМЖ.
В популяционных исследованиях инфильтрирующих опухоль лимфоцитов установлено, что заболевание является иммуногенным, а при трижды негативном РМЖ и HER2+ РМЖ наблюдается наибольший эффект эндогенного иммунного ответа. Первые исследования иммуномодулирующей терапии четко указывают на то, что эти опухоли чувствительны к новому классу иммуноонкологических препаратов, ранее продемонстрировавших эффективность в лечении опухолей с известной иммуногенностью, таких как меланома. Данное наблюдение призвано помочь осуществить быстрый переход от клинического исследования к стандарту терапии при некоторых подтипах РМЖ.
Заключение
Комбинирование традиционных химиотерапевтических агентов и ингибиторов контрольных точек иммунитета, таких как атезолизумаб и пембролизумаб, должно повысить частоту ответа на лечение. У пациентов с низкой Т-клеточной инфильтрацией при использовании вакцины до или одновременно с ингибиторами чекпойнта может наблюдаться дополнительный эффект.
Расширение знаний о структуре и функции иммунной микросреды опухоли, а также понимание, почему одни виды РМЖ более иммуногенные, другие менее иммуногенные, позволят ускорить клиническое применение иммуномодулирующих препаратов у пациентов с РМЖ.
V.F. Semiglazov, PhD, Prof., A.I. Tseluyko, R.V. Donskikh, PhD, V.O. Smirnova, PhD, A.S. Artemyeva, PhD, P.V. Krivorotko, PhD
N.N. Petrov National Medical Research Center of Oncology
Contact person: Vladimir F. Semiglazov, vsemiglazov@mail.ru
Historically, breast cancer has long been considered a low immunogenic tumor. Nevertheless, the accumulated data on the value of immune cells associated with breast tumors, as well as the results of studies on the effectiveness of immune check-point inhibitors such as anti-PD (L) 1 in metastatic breast cancer, have led to a revision of this point of view. PD-L1 inhibitors (in particular atesolizumab) are currently being studied in patients with breast cancer, and encouraging response rates to treatment have already been presented. In order to prescribe the right immunomodulating therapy to the right patients, biomarkers are needed that could predict the response to the therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.