Новые средства для лечения сахарного диабета типа 2: миметики инкретина и ингибиторы дипептидилпептидазы-4 (ДПП-4). Что выбрать?
- Аннотация
- Статья
- Ссылки



Введение
С 70‑х гг. ХХ века в мире отмечается значительный рост распространенности сахарного диабета (СД) типа 2, темпы которого в настоящее время не только не имеют тенденции к снижению, но, напротив, продолжают экспоненциально увеличиваться. По оценкам специалистов число случаев СД (из которых 90–95% приходится на СД типа 2) в мире за 30‑летний период (2000–30 гг.) возрастет более чем вдвое и составит 366 млн [1].
Параллельно с ростом заболеваемости СД типа 2 появляются новые данные о патофизиологии данного состояния, влиянии различных терапевтических стратегий на темпы прогрессирования заболевания, возникновение осложнений и исходы у пациентов, разрабатываются принципиально новые сахароснижающие препараты. В результате этого во многом пересматриваются традиционные взгляды на цели и подходы к лечению пациентов с СД типа 2. Помимо достижения контроля гликемии лечение также должно быть направлено на предупреждение прогрессирования диабета за счет уменьшения инсулинорезистентности и улучшения функции β-клеток, а также коррекции других нарушений, имеющих место при данном заболевании.
В дополнение к трем ключевым дефектам (резистентность к инсулину печени и мышечной ткани, недостаточность функции β-клеток), при СД типа 2 имеют место еще, как минимум, пять существенных метаболических дефектов: гиперглюкагонемия; дефицит продукции и/или резистентность к инкретинам, вырабатываемым в желудочно-кишечном тракте; ускоренный липолиз в жировой ткани; повышение реабсорбции глюкозы в почках и резистентность к инсулину в мозге [2]. Этот «зловещий патологический октет» (по образному выражению профессора Р. ДеФронзо) диктует необходимость применения новых патофизиологически обоснованных подходов к лечению больных СД типа 2, включающих, в частности, применение препаратов, действие которых основано на «эффектах инкретинов» [2].
Препараты для лечения СД типа 2 с действием, основанным на эффектах инкретинов
В настоящее время разрабатываются два основных класса препаратов, направленных на восстановление нарушенных эффектов инкретинов у пациентов с СД типа 2: 1) миметики инкретина, или аналоги глюкагоноподобного пептида-1 (ГПП-1) и 2) пероральные ингибиторы фермента дипептидилпептидазы-4 (ДПП-4), пролонгирующие активность эндогенного ГПП-1.
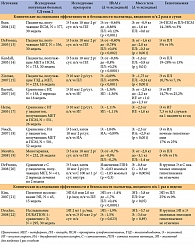
Среди миметиков инкретина наиболее изученным является эксенатид (Баета®, Эли Лилли энд Компани), применяющийся в клинической практике в США с апреля 2005 г., а в России с ноября 2006 г. Второй препарат данного класса – лираглутид, получивший разрешение на применение в США только 25 января 2010 г., в Европе применяется около года (с июля 2009 г.), а в России был зарегистрирован в текущем 2010 году. Из пероральных ингибиторов ДПП-4 наиболее изучены ситаглиптин (Янувия®, Мерк Шарп и Доум), вилдаглиптин (Галвус®, Новартис Фарма) и саксаглиптин. Ситаглиптин и вилдаглиптин зарегистрированы в РФ в октябре 2007 и в октябре 2008 г., соответственно. Официальные показания к применению зарегистрированных в РФ препаратов представлены в таблице 1 [3].
Появление миметиков инкретина и ингибиторов ДПП-4 в клинической практике, с одной стороны, открывает новые уникальные возможности патофизиологически обоснованной терапии у пациентов с СД типа 2, но, с другой стороны, требует от врачей четкого понимания преимуществ и возможных рисков применения этих препаратов для принятия обоснованного решения в каждой конкретной клинической ситуации.
В российских медицинских изданиях ранее уже была представлена информация по эффективности и безопасности эксенатида, ситаглиптина и вилдаглиптина при лечении пациентов с СД типа 2 [4, 5, 6, 7], поэтому в данном обзоре основное внимание будет уделено рассмотрению наиболее интересных новых данных об этих препаратах, позволяющих определить их место в терапии. Кроме того, весьма перспективной не только с точки зрения удобства для пациентов, но и с позиций эффективности и безопасности представляется новая пролонгированная лекарственная форма эксенатида для введения 1 раз в неделю, которая может появиться в клинической практике в ближайшем будущем [8].
Сравнительная характеристика миметиков инкретина и ингибиторов ДПП-4
Как известно, большинство применяемых в практике при СД типа 2 сахароснижающих препаратов, как в виде монотерапии, так и в различных комбинациях, не способны обеспечить длительное сохранение контроля гликемии в процессе лечения, поддержание функции β-клеток и предупредить прогрессирование заболевания. Более того, применение «традиционных» сахароснижающих препаратов (особенно препаратов сульфонилмочевины – ПСМ и инсулина) чревато риском возникновения гипогликемий и увеличения массы тела пациентов [2]. Способность замедлять прогрессирование СД типа 2 при длительном лечении продемонстрирована только в долгосрочных исследованиях тиазолидиндионов и эксенатида. Для ингибиторов ДПП-4 также получены обнадеживающие данные, которые, однако, пока не подтверждены результатами долгосрочных клинических исследований этих препаратов [2].
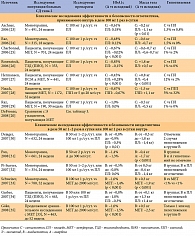
В таблице 2 приведена краткая сравнительная характеристика миметиков инкретина и ингибиторов ДПП-4 [9, 10].
Эффективность эксенатида и ингибиторов ДПП-4 в клинических исследованиях
Результаты основных клинических исследований эксенатида и ингибиторов ДПП-4 у пациентов с СД типа 2 представлены в таблицах 3 и 4, соответственно [11].
Представленные в таблицах 3 и 4 данные свидетельствуют, что как эксенатид, так и ингибиторы ДПП-4 обеспечивают снижение уровня HbA1 c на 0,4–1,36% и на 0,45–1,4% соответственно. В то же время отмечаются значительные различия, касающиеся влияния эксенатида и ингибиторов ДПП-4 на массу тела пациентов. Применение эксенатида приводит к достоверному прогрессирующему снижению массы тела пациентов (на 0,8 кг уже через 2 недели лечения [20] и до –3,1–3,6 кг при более длительной терапии [19, 22]), в то время как ингибиторы ДПП-4 не влияют на данный показатель. Аналогичные данные были получены при проведении систематических обзоров и метаанализов рандомизированных клинических исследований (РКИ) эксенатида и ингибиторов ДПП-4.
Результаты метаанализов РКИ эксенатида и ингибиторов ДПП-4
Метаанализ результатов РКИ эксе-натида, опубликованный в 2007г., показал, что применение данного препарата приводит к статистически достоверному снижению показателей HbA1 c в сравнении с плацебо (в среднем, на 1,01%; 95% доверительный интервал – ДИ от –1,18% до –0,84%) [36]. Применение ингибиторов ДПП-4 обеспечивает снижение HbA1 c на 0,74% (95% ДИ от –0,85% до –0,62%) в сравнении с плацебо, при этом эффективность ситаглиптина и вилдаглиптина в отношении снижения HbA1 c является эквивалентной (–0,74% и –0,73%, соответственно, в сравнении с плацебо) [36]. Кроме того, результаты данного метаанализа свидетельствуют, что эксенатид по эффективности не уступает инсулинам, а ингибиторы ДПП-4 обеспечивают меньшее снижение уровня HbA1 c, чем исследованные препараты сравнения (глипизид, розиглитазон, пиоглитазон и метформин) [36].
Результаты метаанализа также подтвердили, что эксенатид вызывает статистически достоверное прогрессирующее снижение массы тела пациентов с СД типа 2, при этом наиболее значительные различия отмечены при сравнении эксенатида с инсулином (в среднем –4,76 кг, 95% ДИ от –6,03 до –3,49 кг) [36]. Для ингибиторов ДПП-4 отмечено статистически достоверное, но клинически не значимое увеличение массы тела на 0,48 кг (95% ДИ от 0,30 до 0,66 кг) в сравнении с плацебо [36].
В Кокрейновском систематическом обзоре, посвященном применению ингибиторов ДПП-4 при СД типа 2, были проанализированы 11 РКИ ситаглиптина и 14 РКИ вилдаглиптина, включавшие 6743 и 6121 пациентов, получавших указанные препараты соответственно [37]. В результате оказалось, что терапия ситаглиптином или вилдаглиптином обеспечивает снижение HbA1 c в сравнении с плацебо на 0,7% и 0,6%, соответственно, и не имеет преимуществ по данному показателю перед другими сахаро-снижающими препаратами [37].
Результаты долгосрочных клинических исследований эксенатида
Значительный интерес представляют результаты долгосрочных клинических исследований эксенатида, в которых терапия препаратом и наблюдение за пациентами продолжалось до 3,5 лет [38].
Длительная терапия эксенатидом обеспечивает стойкое клинически значимое улучшение контроля гликемии и прогрессирующее снижение массы тела (не зависящие от возраста пациентов [38]), а также оказывает благоприятный эффект на факторы сердечно-сосудистого риска (дислипидемия, артериальная гипертензия), имеющие место у большинства больных СД типа 2. Кроме того, лечение эксенатидом может способствовать уменьшению проявлений неалкогольной жировой болезни печени у пациентов с СД типа 2 [5].
В когорте пациентов (n = 217), продолжавших терапию эксена-тидом на протяжении 3 лет, отмечено стойкое сохранение достигнутых уровней контроля гликемии со снижением HbA1 c – на 1% от исходного уровня (р < 0,0001), при этом значения HbA1 c < 7% удалось добиться у 46% пациентов, а уровня < 6,5% – у 30% больных [38]. В данной группе пациентов отмечено также постепенное снижение массы тела, достигшее – 5,3 ± 0,4 кг через три года применения препарата (по сравнению с исходной, p < 0,0001) [38], причем график динамики снижения массы тела за указанный период не имел видимого плато. Снижение массы тела отмечено у 84% больных, при этом у половины отмечено снижение массы тела, по меньшей мере, на 5% от исходной. У больных с исходными значениями ИМТ < 30 кг/м 2 среднее уменьшение массы тела составило – 3,9 кг (p < 0,0001), а у пациентов с ожирением (ИМТ > 30 кг/м 2) – 5,8 кг (p < 0,0001) [38].
Влияние эксенатида и ингибиторов ДПП-4 на факторы сердечно-сосудистого риска
Учитывая сложные патофизиологические связи между СД типа 2, ожирением, дислипидемией, артериальной гипертензией и атеросклерозом, особое значение для всех имеющихся в практике и появляющихся на рынке новых сахароснижающих препаратов приобретает не только их способность обеспечивать контроль гликемии, но и их влияние на факторы сердечно-сосудистого риска у больных СД типа 2.
В результате длительного (182 нед.) лечения эксенатидом [38] было отмечено статистически достоверное улучшение показателей липидного спектра крови, заключающееся в снижении уровней триглицеридов, общего холестерина и липопротеидов низкой плотности (ЛПНП) и повышении уровня липопротеидов высокой плотности (ЛПВП) (таблица 5).
В краткосрочных (24 нед.) клинических исследованиях ситаглиптина положительного влияния данного препарата на липидный спектр крови не выявлено, напротив, отмечены повышения уровней общего холестерина, ЛПНП и триглицеридов [25, 26] (таблица 5). Полученные данные, несомненно, требуют дальнейшего тщательного изучения в аспекте безопасности длительной терапии ситаглиптином в отношении риска сердечно-сосудистых событий у пациентов с СД типа 2.
У пациентов, получавших вилдаглиптин, отмечены некоторые благоприятные изменения липидного спектра крови (таблица 5). В частности, монотерапия вилдаглиптином в дозе 50 мг 2 раза в сутки на протяжении 24 недель обеспечила снижение общего холестерина на 4,5% по сравнению с применением плацебо [30].
Помимо благоприятного влияния на липидный спектр крови терапия эксенатидом в течение 3,5 лет также обеспечивала достоверное снижение систолического (на 3,5 мм рт.ст.) и диастолического (на 3,3 мм рт.ст.) артериального давления [38].
Влияние эксенатида и ингибиторов ДПП-4 на функцию β-клеток
Значительный практический интерес представляет потенциальная способность эксенатида и ингибиторов ДПП-4 предотвращать ухудшение или даже восстанавливать нарушенную функцию β-клеток поджелудочной железы, обнаруженная в исследованиях на животных. В настоящее время этот вопрос интенсивно изучается при применении указанных препаратов у пациентов с СД типа 2.
В клинических исследованиях о восстановлении функции β-кле-ток обычно судят по улучшению индекса HOMA-B (гомеостатической модели оценки функционирования β-клеток) на фоне применения препарата. В подгруппе пациентов, завершивших 3‑летний курс терапии эксенатидом, отмечено достоверное улучшение показателя HOMA-B по сравнению с исходным значением (70,1% vs 52,4%; p < 0,0001) [38]. Аналогичные результаты были получены в сравнительных исследованиях эксенатида с плацебо (на фоне терапии тиазолидиндионом) [15] и с инсулином аспарт [18] – в группах терапии эксенатидом отмечено улучшение индекса HOMA-B на 19% относительно исходных уровней [15, 18].
В рандомизированном исследовании, результаты которого были опубликованы в мае 2009 г., пациентам, получавшим терапию метформином, назначали эксенатид или инсулин гларгин [40]. В обеих группах через 1 год лечения было отмечено одинаковое снижение уровня HbA1 c до 6,8% [40]. Однако в группе терапии эксенатидом было отмечено достоверное уменьшение массы тела пациентов, а при лечении инсулином гларгином – ее увеличение (–3,6 кг vs +1,0 кг; р < 0,0001). Оценка функции β-клеток показала, что аргинин-стимулированная секреция С-пептида во время гипергликемии увеличилась в 3,19 раза относительно исходных показателей после 52 недель лечения эксенатидом и только в 1,31 раза после терапии инсулином гларгином (различие между группами в 2,46 раза, р < 0,0001) [40].
Однако через 4 недели после отмены терапии эксенатидом и инсулином гларгином показатели функции β-клеток вернулись к исходным значениям и достоверно не отличались между группами лечения. Показатели HbA1 c и массы тела также вернулись к исходным цифрам через 3 месяца после прекращения терапии [40]. Полученные результаты позволяют предположить, что для сохранения благоприятных эффектов на функцию β-клеток необходимо продолжение терапии эксенатидом.
Результаты мета-анализа [41] показали, что ситаглиптин достоверно улучшает индекс HOMA-B на 12,03% [95% ДИ 9,45–14,60], а также соотношение «проинсулин/инсулин» (–0,06; 95% ДИ от –0,08 до –0,04) в сравнении с плацебо. В то же время в исследованиях с активным контролем ситаглиптин уступал препаратам сравнения по влиянию на индекс HOMA-B и не отличался от них по воздействию на соотношение «проинсулин/инсулин» [41].
По данным рандомизированного плацебо-контролируемого исследования у пациентов с СД типа 2 вилдаглиптин также оказывал некоторые благоприятные эффекты на функцию β-клеток. В частности, после 52 недель терапии ритм секреции инсулина натощак и чувствительность β-клеток к инсулину значительно улучшались в группе лечения исследуемым препаратом по сравнению с исходными показателями и результатами в группе применения плацебо, что косвенно свидетельствует об улучшении функции β-клеток на фоне терапии вилдаглиптином [42]. Однако указанные изменения исчезали через 4 недели после отмены препарата [42].
Выявленные косвенные данные о влиянии ингибиторов ДПП-4 на функцию β-клеток у пациентов с СД типа 2 требуют дальнейшего изучения в долгосрочных клинических исследованиях с целью определения способности препаратов данного класса предупреждать прогрессирование β-клеточной недостаточности.
Нежелательные лекарственные реакции и потенциальные риски применения эксенатида и ингибиторов ДПП-4
Наиболее частыми нежелательными лекарственными реакциями (НЛР) эксенатида являются тошнота и рвота, которые имеют дозозависимый характер. По данным мета-анализа [36] отношение рисков (ОР) составило 3,17 (95% ДИ 2,16–4,64) для возникновения тошноты и 3,52 (95% ДИ 2,64–4,70) для возникновения рвоты относительно таковых при использовании препаратов сравнения. Однако у большинства пациентов тошнота была легкой или средней степени выраженности, в наибольшей степени проявлялась в первые 8 недель лечения и уменьшалась при снижении дозы препарата или самопроизвольно при продолжении лечения [14, 15]. Перечисленные НЛР со стороны желудочно-кишечного тракта (ЖКТ) приводили к несколько более частому прекращению терапии пациентами, получавшими эксенатид (~4%), чем при использовании плацебо [36].
У ситаглиптина и вилдаглиптина не описаны НЛР со стороны ЖКТ – частота тошноты, рвоты и диареи при лечении ингибиторами ДПП-4 не отличается от таковой в контрольных группах (плацебо или активный препарат сравнения). При мета-анализе данных РКИ выявлено, что ингибиторы ДПП-4 могут несколько повышать риск развития инфекций (носоглотки и мочевыводящих путей) и возникновения головной боли [36]. Учитывая, что ДПП-4 представляет собой белок клеточной мембраны, обнаруживаемый во многих тканях организма, включая лимфоциты, существуют теоретически обоснованные опасения в отношении долговременных эффектов ингибиторов ДПП-4 и безопасности применения препаратов этой группы в клинической практике [9].
Частота возникновения гипогликемии при применении эксенатида и ингибиторов ДПП-4, в целом, является низкой, что обусловлено глюкозозависимым действием инкретинов. Данная особенность миметиков и активаторов инкретина составляет их важное преимущество перед другими антидиабетическими препаратами. Повышение риска гипогликемий было отмечено только при комбинированной терапии эксенатидом и ПСМ (таблица 2, [12]), в связи с чем в инструкцию по применению препарата было внесено соответствующее предупреждение.
При применении эксенатида в клинической практике были отмечены случаи возникновения острого панкреатита у пациентов с СД типа 2, получавших данный препарат. Однако анализ данных системы фармаконадзора за безопасностью применения различных сахароснижающих препаратов показал, что частота возникновения острого панкреатита в течение 1 года после начала терапии эксенатидом составила 0,13% (37 случаев у 27996 пациентов), что эквивалентно частоте развития данного состояния у пациентов, получающих терапию ситаглиптином, метформином или глибуридом (ОР = 1,0; 95% ДИ 0,6–1,7 относительно препаратов сравнения) [43].
Результаты прямого сравнения эффектов эксенатида и ситаглиптина у пациентов с СД типа 2
В октябре 2008 г. были опубликованы результаты первого и пока единственного исследования с перекрестным дизайном, непосредственно сравнивающего эффекты эксенатида (5, затем 10 мкг 2 р./сут. п/к) и ситаглиптина (100 мг/сут. внутрь) на постпрандиальные уровни гликемии (ППГ), секрецию инсулина и глюкагона, скорость опорожнения желудка и потребление калорий у пациентов с СД типа 2 [20]. Несмотря на короткий период лечения (2 недели), результаты исследования убедительно показали, что эксенатид обеспечивает более значительное снижение уровней ППГ по сравнению с ситаглиптином (7,38 + 0,33 vs 11,44 + 0,33 ммоль/л, p < 0,0001). Перевод пациентов с терапии эксенатидом на лечение ситаглиптином приводил к повышению ППГ на 4,05 + 0,61 ммоль/л, в то время как замена ситаглиптина на эксенатид обеспечивала дальнейшее снижение ППГ на 4,22 + 0,55 ммоль/л [20]. Изменения уровней глюкозы плазмы натощак (ГПН) были эквивалентными при применении обоих препаратов. В сравнении с ситаглиптином эксенатид вызывал достоверное улучшение инсулиногенного индекса секре-ции инсулина (соотношение «эксенатид/ситаглиптин» – Э/С = 1,5 + 0,26; p = 0,0239), уменьшение пост-прандиального уровня глюкагона (p = 0,0011) и триглицеридов (p = 0,0118), а также замедлял опорожнение желудка (p < 0,0001) [20]. Эксенатид значительно уменьшал потребление калорий пациентами с СД (–134 + 97 ккал) в сравнении с ситаглиптином (+ 130 + 97 ккал, p = 0,0227), в результате чего после 2 недель терапии эксенатидом отмечалось достоверное уменьшение массы тела больных (–0,8 кг vs –0,3 кг в группе ситаглиптина, р = 0,0056). Результаты данного исследования демонстрируют явные отличия эксенатида и ситаглиптина при лечении пациентов с СД типа 2: более выраженную способность эксенатида уменьшать ППГ, повышать секрецию инсулина и снижать постпрандиальную секрецию глюкагона; а также уникальные свойства эксенатида – способность замедлять опорожнение желудка и уменьшать количество потребляемых калорий [20]. Эти различия необходимо учитывать при назначении миметиков инкретина или ингибиторов ДПП-4 пациентам с СД типа 2.
Интересны также результаты фармакоэкономического исследования затрат на лечение больных СД типа 2 с использованием эксенатида или ситаглиптина [44]. Оказалось, что несмотря на некоторое повышение затрат, связанных с лечением диабета, в целом терапия эксенатидом приводит к достоверному (р < 0,0001) уменьшению общих медицинских расходов в сравнении с ситаглиптином, при этом экономия составляет около 500 долларов США на 1 пациента за 6 месяцев лечения [44].
Новые данные о результатах лечения эксенатидом и инсулином гларгином у пациентов с СД типа 2
Учитывая, что на сегодняшний день многие практические врачи рассматривают эксенатид исключительно в качестве альтернативы инсулинотерапии при невозможности достижения компенсации пероральными сахароснижающими препаратами (ПСП) у больных СД типа 2, стоит остановиться на сравнении результатов вышеуказанных вариантов лечения. В рандомизированном исследовании HEELA пациентам с СД типа 2, избыточной массой тела (ИМТ > 27 кг/м 2) и повышенным риском сердечно-сосудистых событий, у которых не удавалось добиться контроля гликемии двумя или тремя ПСП, назначали эксенатид или инсулин гларгин [45]. Через 26 недель лечения доля пациентов, у которых удалось добиться снижения HbA1 c до целевого уровня (< 7,4%) без повышения массы тела, в группе терапии эксенатидом составила 53,4%, а в группе лечения инсулином гларгином только 19,8% (p < 0,001) [45]. Изменения уровней HbA1 c в сравнении с исходными были одинаковыми в обеих группах (–1,25 и –1,26%, соответственно), в то время как эффекты на массу тела пациентов были прямо противоположными (–2,73 кг в группе эксенатида и +2,98 кг в группе инсулинотерапии, p < 0,001) [45].
При анализе фармакоэкономических показателей оказалось, что терапия эксенатидом (n = 4090), несмотря на более высокую стоимость самого препарата, сопровождается достоверно (p < 0,0001) меньшими общими медицинскими затратами и расходами на обслуживание пациентов в амбулаторной практике и в стационаре, на оказание неотложной медицинской помощи, а также обеспечивает сокращение затрат, связанных с лечением СД, по сравнению с инсулином гларгином (n = 1660) [46]. При этом общая экономия составляет почти 4,5 тыс. долларов США на пациента в год [46].
Новая лекарственная форма эксенатида для п/к введения 1 раз в неделю
Одним из перспективных направлений дальнейшего развития терапии СД типа 2, основанной на эффектах инкретинов, является создание пролонгированных форм препаратов – миметиков инкретина. В этой связи интересны результаты непосредственного сравнения эффективности и безопасности новой лекарственной формы эксенатида для п/к введения в дозе 2 мг 1 раз в неделю и обычной формы препарата (10 мкг 2 р./сут.) (исследование DURATION-1) [22].
В пролонгированной лекарственной форме эксенатид инкорпорирован в микросферы, матрицей которых служит медицинский биодеградируемый полимер – поли (D, L-лактид-ко-гликолид) – PLG. После введения PLG постепенно расщепляется в подкожной клетчатке, обеспечивая медленное высвобождение эксенатида и длительное поддержание его терапевтических концентраций в крови [8].
Результаты исследования DURA-TION-1 показали, что пролонгированная форма эксенатида в сравнении с обычной обеспечивает достоверно более выраженное снижение уровней HbA1 c (-1,9 vs –1,5%; p = 0,0023), ГПН (-2,3 vs –1,4 ммоль/л) и глюкагона [22]. Доля пациентов, у которых удалось достичь целевого уровня HbA1 c (< 7,0%), составила 77% и 61% в указанных группах лечения соответственно (p = 0,0039). Кроме того, в группе применения пролонгированной формы эксенатида уровня HbA1 c < 6,5% удалось добиться у 49% пациентов, а уровня < 6,0% – у 25% больных [22]. В обеих группах лечения было отмечено эквивалентное снижение массы тела пациентов (-3,7 и –3,6 кг, соответственно), а также достоверное уменьшение показателей общего холестерина, ЛПНП и триглицеридов, систолического и диастолического артериального давления по сравнению с исходными [22].
После 52 недель применения пролонгированной лекарственной формы эксенатида у пациентов сохранялось стойкое снижение уровня HbA1 c на 2%, а массы тела – на 4 кг от исходных значений [8].
Примечательно, что пролонгированная форма эксенатида отличается от обычной не только более высокой эффективностью, но и лучшей переносимостью. Частота тошноты и рвоты была ниже в группе лечения эксенатидом для п/к введения 1 раз в неделю (26% vs 35% и 11% vs 19% соответственно), при этом только 2 из 148 пациентов в данной группе прекратили терапию по причине указанных НЛР [22]. У пациентов, получавших эксенатид в дозе 2 мг 1 раз в неделю и не принимавших ПСМ, случаев гипогликемии отмечено не было. У больных, получавших комбинированную терапию пролонгированной формой эксенатида и ПСМ, легкие эпизоды гипогликемии были отмечены в 15% случаев, тяжелых случаев гипогликемии не было [22].
Таким образом, новая пролонгированная лекарственная форма эксенатида для введения 1 раз в неделю обеспечивает не только дополнительные удобства для пациентов, связанные со значительным уменьшением числа инъекций, но и обладает достоверными преимуществами по эффективности и переносимости в сравнении с традиционной формой препарата для п/к введения 2 р./сут.
Заключение
Появление новых классов лекарственных средств, действие которых основано на эффектах инкретинов (миметиков и активаторов инкретина), открывает новые перспективы проведения «патофизиологически обоснованной» терапии СД типа 2. На сегодняшний день алгоритмы лечения больных с СД типа 2 предусматривают ступенчатый подход, ориентированный, прежде всего, на нормализацию показателей гликемии, а не на коррекцию известных патофизиологических дефектов, лежащих в основе данного заболевания. В то же время, среди экспертов‑диабетологов все более крепнет убеждение, что оптимальная терапия СД типа 2 должна быть направлена, в первую очередь, на предупреждение прогрессирования заболевания, его микро- и макроваскулярных осложнений и, что важно, предотвращение развития β-клеточной недоста-точности.
В связи с этим профессором Ральфом ДеФронзо предложен принципиально новый патогенетически обоснованный алгоритм терапии СД типа 2, предусматривающей раннее назначение комбинированной «тройной» терапии, включающей метформин, тиазолидиндион и миметик инкретина (эксенатид). В настоящее время уже появились первые результаты клинических исследований такой комбинации при СД типа 2, подтвердившие значительное улучшение контроля гликемии за счет благоприятного влияния препаратов на функцию β-клеток и уменьшения инсулинорезистентности при отсутствии нежелательного эффекта на массу тела пациентов [47]. Несомненно, необходимы дальнейшие исследования отдаленных эффектов применения миметиков инкретина и ингибиторов ДПП-4 для четкого определения роли этих классов препаратов в лечении СД типа 2.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.