Новый базальный инсулин длительного действия Туджео СолоСтар®: преимущества для пациента
- Аннотация
- Статья
- Ссылки
- English
Введение
По прогнозам экспертов Международной федерации диабета (International Diabetes Federation – IDF), к 2035 г. количество пациентов с сахарным диабетом (СД) увеличится на 55% и составит 592 млн [1]. Рост популяции больных СД, прежде всего СД 2 типа, и частоты его хронических осложнений – одни из самых актуальных проблем здравоохранения, с которыми сегодня сталкивается мировое сообщество.
Скачкообразное повышение числа больных обусловливает увеличение общих расходов [2]. В связи со сказанным для выявления экономичной и результативной программы лечения необходимо прямое сравнение эффективности и стоимости сахароснижающих препаратов.
Инициация коррекции гликемии у большинства пациентов с СД 2 типа начинается с изменения образа жизни и приема одного или нескольких пероральных сахароснижающих препаратов. Однако по мере прогрессирования заболевания назначение инсулинотерапии становится неизбежным.
С учетом данных о связи между компенсацией углеводного обмена и частотой сосудистых осложнений, а также необходимости защиты бета-клеток от воздействия проапоптических стимулов использование инсулина, при наличии показаний, остается наиболее эффективным вариантом терапии СД 2 типа и единственным патогенетически обоснованным и жизненно необходимым вариантом терапии СД 1 типа.
Результаты исследования ACHIEVE, проведенного в России, показали, что у пациентов при инициации базальной инсулинотерапии средний уровень гликированного гемоглобина (HbA1c) составлял 9,7%, терапии готовыми смесями – 10,1%, базис-болюсной терапии – 10,4%. Полученные данные свидетельствуют о том, что инсулинотерапия, как правило, назначается при уровне HbA1c > 9,0% [3].
В последние годы показания к инсулинотерапии при СД 2 типа расширились. Она назначается при недостаточности функционирования бета-клеток поджелудочной железы, выраженной глюкозотоксичности, непереносимости и недостаточной эффективности пероральных препаратов [4, 5]. Согласно консенсусу Американской диабетической ассоциации (American Diabetes Association – ADA) и Европейской ассоциации по изучению диабета (European Association for the Study of Diabetes – EASD) [6] базальная инсулинотерапия признана терапией первой линии при недостаточном контроле СД 2 типа в связи с более низким риском развития гипогликемий и увеличения массы тела.
Необходимо подчеркнуть, что при рассмотрении эффективности, переносимости и затратности разных вариантов лечения СД инсулинотерапия признана не только самой мощной, но и наиболее экономически выгодной [7].
Нежелательные эффекты инсулинотерапии, такие как повышение массы тела и эпизоды гипогликемии, можно минимизировать с помощью коррекции питания, уровня физической активности [8] и более разумного подхода к выбору целевых значений гликемии – в зависимости от возраста пациента, наличия у него осложнений и сопутствующей сердечно-сосудистой патологии.
Использование базальных инсулинов с меньшей вариабельностью, более продолжительным периодом действия, стабильным высвобождением из подкожно-жировой клетчатки является предпочтительным в силу низкого риска развития гипогликемии. Такими свойствами обладают аналоги инсулина длительного действия [9].
Для инсулина гларгин минимальный риск гипогликемий и сердечно-сосудистая безопасность доказаны в исследовании ORIGIN [10]. Установлено также, что применение гларгина вместо детемира снижает стоимость лечения на 36–39% [11, 12].
Необходимость в препаратах, которые обладают меньшей вариабельностью, медленным высвобождением инсулина из преципитата, минимальным риском развития эпизодов гипогликемии, побудила к разработке новых аналогов базального инсулина длительного действия, таких как гларгин 300 ЕД/мл, деглюдек и пеглизпро.
Туджео СолоСтар®
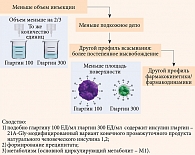
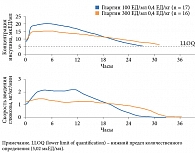
В настоящее время в России зарегистрирован новый препарат, содержащий молекулу инсулина гларгин, Туджео СолоСтар® (компания «Санофи», Германия). Однако в отличие от Лантуса (100 ЕД/мл) концентрация гларгина в нем составляет 300 ЕД/мл. Для одного и того же количества единиц инсулина гларгин вводимый объем препарата 300 ЕД/мл составляет одну третью часть от вводимого объема препарата 100 ЕД/мл (рис. 1). Это приводит к уменьшению площади поверхности преципитата и, как следствие, более постепенному высвобождению инсулина из преципитата. Гларгин 300 ЕД/мл отличается от гларгина 100 ЕД/мл более плавным фармакокинетическим профилем и длительностью действия (до 36 часов) за счет снижения объема вводимого препарата (рис. 2), уменьшения площади поверхности подкожного депо и более медленного и плавного высвобождения из депо [13].
Эффективность и безопасность инсулина гларгин 300 ЕД/мл по сравнению с таковыми инсулина гларгин 100 ЕД/мл изучались в исследовании EDITION [14–16]. Фармакокинетические и фармакодинамические профили инсулина гларгин 300 ЕД/мл у пациентов с СД 1 типа – в исследованиях R.H. Becker и соавт. [17, 18].
Эффективность и безопасность
Исследование EDITION – многоцентровое рандомизированное открытое шестимесячное клиническое исследование фазы IIIа. В него было включено более 3500 пациентов с неконтролируемым СД. Исследование состояло из четырех частей. Участниками исследований EDITION 1–3 стали пациенты с СД 2 типа (n = 2496), исследования EDITION 4 – пациенты с СД 1 типа.
Критерии исключения из исследования – уровень HbA1c < 7% во всех четырех исследованиях, HbA1c > 10% в EDITION 1 и > 11% в EDITION 3.
В исследование EDITION 1 были включены пациенты, получавшие базальный инсулин и инсулин короткого действия [14], в EDITION 2 – базальный инсулин в комбинации с пероральными сахароснижающими препаратами [15], в EDITION 3 – принимавшие только пероральные препараты [16]. В группу инсулина гларгин 300 ЕД/мл рандомизировано 1247 пациентов, в группу инсулина гларгин 100 ЕД/мл – 1249.
В исследованиях использовались модифицированные шприц-ручки: в EDITION 1 и 2 – шприц-ручка СолоСтар, в EDITION 3 – ТактиПен или СолоСтар.
В исследованиях с участием пациентов с СД 2 типа минимальным шагом титрации была доза 3 ЕД для обеих ручек. Шаг 1,5 ЕД был возможен только в исследованиях с участием пациентов с СД 1 типа (EDITION 4, EDITION JP1). Титрация дозы препарата проводилась до достижения целевого уровня гликемии натощак 4,4–5,6 ммоль/л.
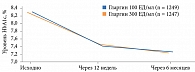
Результаты исследования EDITION продемонстрировали сопоставимость эффектов гларгина 300 и 100 ЕД/мл по показателю «достижение гликемического контроля». Среднее снижение уровня HbA1c в группах составило -1,02 ± 0,03% (95%-ный доверительный интервал (ДИ) -0,08–0,07%) (рис. 3) [19].
Необходимо также отметить, что через шесть месяцев терапии значимой разницы по вариабельности гликемии натощак между группами не зафиксировано (0,02% при 95% ДИ 0,89–0,93): 20,0 ± 0,32% для гларгина 300 ЕД/мл и 20,0 ± 0,33% для гларгина 100 ЕД/мл.
Тяжелая гипогликемия в обеих группах отмечалась редко. Тем не менее в группе гларгина 300 ЕД/мл кумулятивное количество эпизодов ночной подтвержденной или тяжелой гипогликемии было меньше на 31%. Так, в исследовании EDITION 2 снижение кумулятивной частоты ночной подтвержденной или тяжелой гипогликемии за период наблюдения было статистически значимым и составило 48%. В исследовании EDITION 3 кумулятивная частота ночной подтвержденной и тяжелой гипогликемии между двумя группами статистически значимо не различалась. В исследовании EDITION 1 снижение кумулятивной частоты ночной подтвержденной или тяжелой гипогликемии за период исследования было статистически значимым и составило 25%. Снижение частоты случаев гипогликемии наблюдалось уже в первые восемь недель лечения и продолжалось в дальнейшем. Это объясняется более плавным и длительным фармакокинетическим и фармакодинамическим профилями.
За период исследования доза базального инсулина увеличивалась в обеих группах, особенно в первые 12 недель. Средняя доза гларгина 300 ЕД/мл составила 0,85 ± 0,36 ЕД/кг/день, гларгина 100 ЕД/мл – 0,76 ± 0,32 ЕД/кг/день. Таким образом, в группе гларгина 300 ЕД/мл доза оказалась выше на 12%, что было отмечено во всех трех исследованиях EDITION. Предполагают, что это может быть связано с более длительным депонированием гларгина 300 ЕД/мл в подкожной клетчатке и увеличением ферментативной инактивации тканевыми пептидазами в месте инъекции.
При увеличении дозы препаратов регистрировалось незначительное увеличение массы тела – на 0,51 ± 0,10 кг для гларгина 300 ЕД/мл и 0,79 ± 0,10 кг для гларгина 100 ЕД/мл. Разница между группами по данному показателю составила 0,28 кг (95% ДИ -0,55– -0,01, p = 0,039).
Частота побочных эффектов была сопоставима во всех трех исследованиях EDITION. Нежелательные явления отмечались у 57,3% пациентов, получавших гларгин 300 ЕД/мл, и 53,7% пациентов, получавших гларгин 100 ЕД/мл. Осложнения в местах инъекций в группе гларгина 300 ЕД/мл выявлены в 2,4% случаев, в группе гларгина 100 ЕД/мл – в 3,1%. Серьезные нежелательные явления зафиксированы у 5,2% пациентов, получавших гларгин 300 ЕД/мл, и 5,0% пациентов, получавших гларгин 100 ЕД/мл, летальный исход – у 4 (0,3%) и 3 (0,2%) пациентов соответственно. Однако летальные исходы авторы не связывали с приемом препаратов [14–16].
Таким образом, в исследованиях EDITION 1–3 инсулин гларгин 300 ЕД/мл продемонстрировал сопоставимый с инсулином гларгин 100 ЕД/мл гликемический контроль с меньшей частотой эпизодов гипогликемии и риском увеличения массы тела.
Фармакологическая активность
Оценка фармакологической активности инсулина гларгин 300 ЕД/мл проведена в клиническом исследовании R.H. Becker и соавт. Пациентам с СД 1 типа (n = 50) вводили инсулин в дозе 0,4 ЕД/кг один раз в день на протяжении шести дней. На шестой день проводили 24-часовой эугликемический клэмп [17]. Авторами выявлена низкая вариабельность концентраций инсулина. Кумулятивное действие характеризовалось практически линейным графиком в течение 24 часов, срединное колебание концентрации составляло 3,3 (2,7–4,7) мкЕД/мл. Срединная вариабельность за 24 часа – 1,8 (1,6–2,1) мкЕД/мл, перепад – 0,8 (0,6–1,1) мкЕД/мл, колебание между максимальной и минимальной концентрациями в равновесном состоянии – 0,6 (0,4–0,8) мкЕД/мл. Средний показатель внутрииндивидуальной вариабельности концентрации инсулина в течение суток составил 17,4% с коэффициентом вариабельности концентрации препарата между участниками 34,8%. Сделан вывод: после введения инсулина гларгин 300 ЕД/мл наблюдаются низкие колебания концентраций препарата с высокой воспроизводимостью его действия.
В другом исследовании R.H. Becker и соавт. [18] изучены фармакокинетические и фармакодинамические профили инсулинов гларгин 300 и 100 ЕД/мл у пациентов с СД 1 типа (С-пептид плазмы < 0,3 нмоль/л) методом эугликемического клэмпа в равновесном состоянии после введения препарата один раз в день в течение восьми дней.
Так, после последнего введения инсулинов в дозе 0,4 ЕД/кг эугликемия сохранялась в течение 32,7 и 28,7 часа соответственно. При введении гларгина 300 ЕД/мл в дозе 0,6 ЕД/кг эугликемия сохранялась до 35,3 часа. Экспозиция гларгина 300 ЕД/мл характеризовалась более ровным распределением на протяжении всего клэмпа. При введении гларгина 300 ЕД/мл жесткий гликемический контроль (≤ 105 мг/дл) поддерживался на 5 часов дольше (медиана 30 часов), чем при введении гларгина 100 ЕД/мл. У первого препарата также наблюдалась низкая 24-часовая и междневная вариабельность экспозиции.
Таким образом, в равновесном состоянии гларгин 300 ЕД/мл обладает более стабильным и пролонгированным фармакокинетическим профилем по сравнению с гларгином 100 ЕД/мл.
Заключение
Учитывая положительные фармакодинамические, фармакокинетические эффекты инсулина гларгин 300 ЕД/мл, а также достижение на его фоне эугликемии с меньшим риском гипогликемий, можно рекомендовать препарат в качестве базального инсулина пациентам с СД 1 и 2 типов.
A.M. Mkrtumyan, L.V. Yegshatyan
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Ashot Musaelovich Mkrtumyan, vagrashot@mail.ru
A novel human insulin analog glargine (rDNA origin) for injections 300 U/ml (Toujeo SoloStar®) is discussed in the paper. A volume of glargine injected to patients for the same amount of insulin 300 U/ml units was equal to one third of the volume of insulin 100 U/ml. It results in decreasing precipitate surface area and, subsequently, gradual insulin release. Clinical study Phase IIIа EDITION demonstrated that insulin analog glargine applied at dose of 300 U/ml was comparable with glargine 100 U/ml in terms of efficacy and safety in patients with type 1 and type 2 diabetes mellitus, with lower risk of developing hypoglycemic conditions and body weight gain.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.