Опыт применения наружного средства Glatte (крем-пена 5%-ной мочевины) в терапии больных атопическим дерматитом
- Аннотация
- Статья
- Ссылки
- English
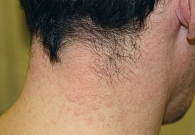
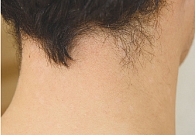
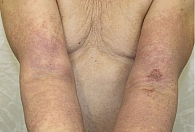
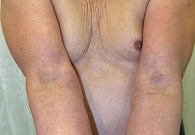




Атопический дерматит (АтД) – хронический зудящий рецидивирующий воспалительный дерматоз, характеризующийся возрастной морфологией клинических проявлений. Заболевание развивается у пациентов с наследственной предрасположенностью.
В настоящее время АтД рассматривается как крупная медицинская и социальная проблема в связи с высокой распространенностью, хроническим рецидивирующим течением, возможностью формирования тяжелых форм с проградиентным течением и торпидных к традиционной терапии [1–3].
В развитии АтД важную роль играет сочетание нарушений барьерных функций кожи и изменения иммунологической реактивности организма.
Нарушение целостности кожного барьера обусловлено дефектом генов структурных белков, участвующих в образовании рогового слоя эпидермиса (филаггрина и лорикрина), недостаточным синтезом липидов кожи (керамидов) и антимикробных пептидов. Дефицит жироподобных компонентов приводит к истончению гидролипидной пленки рогового слоя эпидермиса. Как следствие, повышается его проницаемость и увеличивается трансэпидермальная потеря влаги, что приводит к сухости кожи.
Снижение антимикробной защиты сопровождается повышенной колонизацией кожи условно-патогенными и патогенными бактериями (стафилококками) и грибами (Candida, Malassezia), что в свою очередь увеличивает риск развития инфекционных заболеваний.
Проникающие в эпидермис раздражающие вещества (бытовая химия), аллергены (клещи домашней пыли, плесневые грибы) и микроорганизмы вызывают воспаление, появление зуда и высыпаний [4].
Иммунные нарушения у больных АтД обусловлены врожденной гиперчувствительностью к пищевым (белок коровьего молока, рыбы, яиц), аэроаллергенам (клещи домашней пыли, пыльца растений) и избыточным образованием реагиновых антител класса IgE. Повышенное содержание IgE в крови обнаруживается более чем у 50% больных.
Указанные иммуноглобулины, адсорбируясь в коже, связываются своим Fc-фрагментом с тучными клетками и базофильными лейкоцитами, инициируя под воздействием аллергенов высвобождение этими клетками биологически активных веществ (гистамина, серотонина, простагландинов и лейкотриенов).
В эпидермисе IgE фиксируются на эпидермальных дендритных клетках (клетках Лангерганса), имеющих высокое сродство с IgE. Дендритные клетки реагируют на различные аллергены, микробные антигены, проникающие в эпидермис, длительное механическое воздействие (расчесывание), высвобождая главные медиаторы воспаления – фактор некроза опухоли альфа и интерлейкин 1 бета. Далее происходит накопление Т-лимфоцитов, усиливающих воспалительную реакцию за счет секреции провоспалительных цитокинов и хемокинов. В начальной (острой) стадии воспаления отмечается преобладание Т-хелперов 2-го типа, продуцирующих интерлейкины 4, 5, 13, усиление синтеза IgE. В хронической стадии воспалительный процесс поддерживается Т-хелперами 1-го типа, которые в большом количестве синтезируют провоспалительный цитокин – интерферон гамма [2, 4, 5].
Следовательно, топическая терапия является обязательной частью комплексного лечения АтД. Она должна быть патогенетически обоснованной и проводиться с учетом патологических изменений кожи.
Базовая топическая терапия направлена на предупреждение развития воспаления кожи, вторичного инфицирования, восстановление поврежденного эпителия и улучшение барьерных функций кожи [6–8].
Несмотря на достигнутые в последние годы успехи в лечении АтД, его профилактика и реабилитация больных относятся к труднейшим задачам практической дерматологии. В связи с этим особое внимание уделяется средствам лечебной дерматологической косметики.
Правильно выбрать средство лечебной дерматологической косметики для пациента поможет знание основных его свойств, потенциальных возможностей и побочных эффектов.
Так, некоторые увлажняющие средства в виде эмульсий, кремов и мазей могут оказывать раздражающее воздействие из-за наличия в их составе стабилизаторов, растворителей и отдушек. Эмульсии содержат воду, и у некоторых пациентов их применение может привести к подсушиванию кожи (эффект испарения). Эмульсии и кремы, в состав которых входит спирт, способны вызывать обострение заболевания вследствие повышенной чувствительности кожи в местах воспаления. Именно поэтому увлажняющие и смягчающие средства, применяемые для ухода за кожей больных АтД, не должны содержать стабилизаторов, отдушек, спирта и других компонентов, растворяющих липиды, а также минеральных масел, вазелина, ланолина [6–8].
Сегодня в арсенале врача-дерматовенеролога появились новые топические агенты – средства лечебной косметики для атопичной кожи Glatte. Крем-пена Glatte предназначен для быстрого и длительного увлажнения кожи.
Средство содержит 5%-ную мочевину, масло авокадо, сквалан, молочную кислоту. Оно глубоко проникает во все слои кожи, сохраняет собственный гидролипидный слой эпидермиса, восстанавливает эластичные свойства кожи.
Крем-пена Glatte не содержит в качестве жировой основы вязких веществ, таких как вазелин, ланолин, воск, парафин. Следовательно, не обладает комедогенностью. Крем-пена Glatte гипоаллергенный: не содержит красителей, ароматических веществ и парабенов.
Благодаря уникальной форме – крем-пена – средство легко наносится на большие участки кожи и моментально впитывается.
Нами проведено открытое несравнительное исследование, целью которого стала оценка эффективности, безопасности и переносимости наружных средств Glatte в терапии больных АтД.
Материал и методы
В исследовании приняли участие 35 больных АтД.
Критерии включения в исследование:
-
желание больного участвовать в исследовании;
-
пациенты мужского и женского пола старше 14 лет;
-
АтД в анамнезе, подтвержденный медицинской документацией;
-
отсутствие системной и топической терапии за месяц до начала исследования;
-
возможность выполнять требования протокола исследования.
Критерии исключения:
-
повышенная чувствительность к любому из компонентов препарата;
-
участие в других клинических исследованиях.
В случайном порядке больных разделили на две группы. Первая группа – 23 человека (из них 11 женщин, 12 мужчин), вторая – 12 (из них 5 женщин, 7 мужчин). Средний возраст пациентов первой группы – 21,4 ± 4,2 года, второй – 22,8 ± 5,3 года.
Все пациенты получали системную и топическую патогенетическую терапию.
Системная терапия включала:
-
раствор натрия тиосульфата 30%-ный – 10,0 мл внутривенно, струйно один раз в сутки, курс 10 дней;
-
эбастин – 20 мг в сутки перорально, курс 14 дней; гидроксизина гидрохлорид – 12,5 мг два раза в сутки перорально, курс 28 дней.
В качестве топической патогенетической терапии использовали мометазона фуроат (крем 0,1%-ный) – 15 г два раза в сутки на очаги поражения.
Кроме топических глюкокортикостероидов пациенты использовали наружные увлажняющие средства: первая группа – крем-пену Glatte, вторая – индифферентный крем (кольд-крем: ланолин, персиковое масло, вода в равных пропорциях). Режим применения – два раза в день через 1–1,5 часа после нанесения глюкокортикостероидов.
Исследование предполагало шесть визитов: один скрининговый и пять в период лечения и наблюдения. Продолжительность исследования составила 28 дней.
До начала терапии и по ее окончании проводились оценка клинических проявлений заболевания, клинический и биохимический анализ крови (общий белок, холестерин, общий билирубин, аланинаминотрансфераза, аспартатаминотрансфераза, глюкоза, мочевина, креатинин), общий анализ мочи.
Эффективность лечения АтД оценивалась по SCORAD (scoring of Atopic Dermatitis – шкала атопического дерматита), интенсивность зуда – по VAS (Visual Analogue Scale – визуальная аналоговая шкала), изменение качества жизни больных – по DLQI (Dermatology Life Quality Index – дерматологический индекс качества жизни).
Начиная со второго визита анализировались изменения клинической картины заболевания и дерматологических индексов. Дерматологический статус устанавливался по следующим критериям:
-
полное исчезновение первичных элементов сыпи – клиническое выздоровление;
-
разрешение высыпаний не менее чем на 70% по сравнению с исходными данными – значительное улучшение;
-
снижение выраженности патологического процесса не менее чем на 25% от исходных показателей – улучшение;
-
снижение выраженности патологического процесса менее чем на 25% по сравнению с исходными данными – отсутствие эффекта;
-
отрицательная динамика по сравнению с исходным состоянием – ухудшение.
Результаты
Исследование завершили все пациенты. Отклонение от нормы показателей крови и мочи у пациентов в обеих группах не зафиксировано. Не отмечено также побочных эффектов.
На фоне проводимой терапии наблюдалось улучшение состояния больных в группах (рис. 1–4).
Так, индекс SCORAD снизился в первой группе в 3,8 раза, во второй – в 2,2 раза.
До начала терапии медиана значения SCORAD в обеих группах статистически значимо не различалась – 38,2 и 37,9 балла соответственно (p > 0,05) (табл. 1, рис. 5). По окончании комплексного лечения медиана значения SCORAD в первой группе составила 10,4 балла, во второй – 17,1 балла (p < 0,05). Таким образом, показатель в первой группе оказался ниже показателя во второй группе в 1,7 раза.
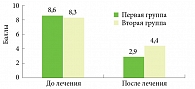
При оценке интенсивности зуда по VAS отмечено статистически значимое его снижение в обеих группах (p < 0,05) (табл. 2, рис. 6). При этом в первой группе снижение показателя было более выраженным – 2,9 против 4,4 балла соответственно (p < 0,05), то есть меньше в 1,5 раза.
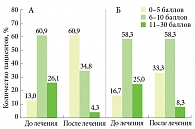
Анализ результатов по DLQI в первой группе показал, что на фоне комплексной терапии уменьшилось количество пациентов, на которых заболевание оказывало сильное и чрезвычайно сильное влияние (11–30 баллов по DLQI), – с 6 (26,1%) до 1 (4,3%) (р < 0,05), а также количество пациентов, на которых заболевание оказывало умеренное влияние (6–10 баллов по DLQI), – с 14 (60,9%) до 8 (34,8%) (р > 0,05). Более чем в четыре раза увеличилось число больных, на которых АтД не оказывал или оказывал незначительное влияние (0–5 баллов по DLQI), – с 3 (13,0%) до 14 (60,9%) (р < 0,05) (табл. 3, рис. 7). Во второй группе отмечена аналогичная динамика: количество пациентов, на которых заболевание оказывало сильное и чрезвычайно сильное влияние, уменьшилось с 3 (25,0%) до 1 (8,3%) (р > 0,05). Не изменилось число больных, на которых АтД оказывал умеренное влияние, – 7 (58,3%) и 7 (58,3%) соответственно (р > 0,05). При этом в два раза увеличилось количество тех, на кого болезнь не оказывала или оказывала незначительное влияние, – с 2 (16,7%) до 4 (33,3%) (р > 0,05).
Однако по окончании лечения количество пациентов, на которых заболевание не оказывало или оказывало незначительное влияние, в первой группе было почти в два раза больше, чем во второй (р < 0,05).
Выводы
Результаты проведенного исследования свидетельствуют о высокой терапевтической эффективности крема-пены Glatte в комплексном лечении АтД, а также о высоком уровне его безопасности и хорошей переносимости. На фоне применения крема-пены Glatte значительно улучшились и значения DLQI. Таким образом, крем-пену Glatte можно рекомендовать для базового ухода за кожей при АтД.
Ye.S. Savchenko, V.V. Verderenko, V.R. Khayrutdinov, A.V. Statsenko, A.V. Samtsov
Military Medical Academy named after S.M. Kirov, Saint Petersburg
Contact person: Vladislav Rinatovich Khayrutdinov, haric03@list.ru
Despite progress in recent years, advances in the treatment of atopic dermatitis (AD), its prevention and rehabilitation of patients are the most difficult tasks of practical dermatology. In connection with this, opportunities of using dermatologic cosmetics are of particular interest. Experience of applying topical agent Glatte (5%-urea foaming cream) in a combination therapy of AD revealed that SCORAD index decreased from 38.2 down to 10.4 score (p < 0.05), itch intensity according to VAS – from 8.6 down to 2.9 score (p < 0.05), quantity of patients with severe, extremely severe and moderate impact was reduced, whereas quantity of patients with no/modest impact was reduced by more than 4-fold. The data obtained allow to recommend foaming cream Glatte for basal skin care during AD.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.