Опыт применения пеметрекседа в терапии немелкоклеточного рака легкого
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Пациенты получали пеметрексед в дозе 500 мг/м2 в комбинации с цисплатином 75 мг/м2 и бевацизумабом в дозе 7,5 мг/м2 каждые три недели до четырех курсов. У пациентов, достигших частичной регрессии, терапия пеметрекседом и бевацизумабом продолжилась в поддерживающем режиме до прогрессирования или непереносимости.
Результаты. Объективный ответ на терапию в виде частичной регрессии достигнут у 14 пациентов, еще у пяти получена стабилизация. Медиана выживаемости без прогрессирования составила восемь месяцев, общей выживаемости – 24 месяца. Наиболее частым нежелательным явлением была гематологическая токсичность. Нейтропения 3–4-й степени зафиксирована у 24% больных.
Заключение. Комбинация пеметрекседа, цисплатина и бевацизумаба характеризуется высокой эффективностью, приемлемым профилем токсичности и ассоциируется с высокой общей выживаемостью при неплоскоклеточном немелкоклеточном раке легкого.
Материал и методы. Пациенты получали пеметрексед в дозе 500 мг/м2 в комбинации с цисплатином 75 мг/м2 и бевацизумабом в дозе 7,5 мг/м2 каждые три недели до четырех курсов. У пациентов, достигших частичной регрессии, терапия пеметрекседом и бевацизумабом продолжилась в поддерживающем режиме до прогрессирования или непереносимости.
Результаты. Объективный ответ на терапию в виде частичной регрессии достигнут у 14 пациентов, еще у пяти получена стабилизация. Медиана выживаемости без прогрессирования составила восемь месяцев, общей выживаемости – 24 месяца. Наиболее частым нежелательным явлением была гематологическая токсичность. Нейтропения 3–4-й степени зафиксирована у 24% больных.
Заключение. Комбинация пеметрекседа, цисплатина и бевацизумаба характеризуется высокой эффективностью, приемлемым профилем токсичности и ассоциируется с высокой общей выживаемостью при неплоскоклеточном немелкоклеточном раке легкого.
Введение
Рак легкого является одной из наиболее распространенных злокачественных опухолей в России и ведущей причиной смерти при онкологических заболеваниях [1]. Последние годы в Иркутской области показатели заболеваемости и смертности находятся на уровне 50 и 40 человек на 100 000 населения соответственно. При этом запущенность злокачественных новообразований составляет 60%, а одногодичная летальность – 63% [2].
Проведенные в 1990-х гг. исследования и их метаанализы показали улучшение результатов лечения при использовании химиотерапии платиносодержащими комбинациями в сравнении с поддерживающей терапией при распространенном немелкоклеточном раке легкого (НМРЛ) [3, 4]. Однако медиана выживаемости составила менее года, а время до прогрессирования – четыре – шесть месяцев. Улучшение результатов стало возможно благодаря внедрению новых химиопрепаратов и таргетной терапии при наличии активирующих мутаций генов EGFR и ALK.
Применение бевацизумаба в первой линии терапии позволило существенно увеличить продолжительность времени до прогрессирования и общей выживаемости [5–7]. Пеметрексед также оказался эффективен при НМРЛ. Продолжение лечения пеметрекседом после индукционной терапии комбинацией «цисплатин и пеметрексед» привело к увеличению медианы общей выживаемости с 11,0 до 13,9 месяца (р = 0,02) по сравнению с группой поддерживающей терапии [8]. Комбинация пеметрекседа и бевацизумаба в качестве поддерживающей терапии была эффективнее монотерапии бевацизумабом в отношении выживаемости без прогрессирования [9].
Ранее нами описаны случаи продолжительных, более четырех лет, ремиссий при использовании пеметрекседа и бевацизумаба в качестве поддерживающей терапии при аденокарциноме легкого [10]. Мы обобщаем наш опыт использования комбинации цисплатина, пеметрекседа и бевацизумаба с последующей поддерживающей терапией при данной патологии.
Материал и методы исследования
Исследование выполнено на базе Областного онкологического диспансера г. Иркутска. Набор пациентов проводился в 2009–2014 гг.
Основными критериями включения в исследование стали возраст старше 18 лет, наличие неоперабельного распространенного неплоскоклеточного НМРЛ, подтвержденного результатами морфологического исследования (цитологического или гистологического), наличие по крайней мере одного измеряемого очага по критериям RECIST, состояние на момент включения по ECOG 0–2, удовлетворительные лабораторные показатели. Не включались в исследование пациенты с плохо контролируемой артериальной гипертензией и метастазами в центральной нервной системе.
Все участники исследования подписали информированное согласие.
Пациенты получали полихимиотерапию по схеме: пеметрексед 500 мг/м2 в виде десятиминутной инфузии в первый день каждого 21-дневного цикла, цисплатин 75 мг/м2 на фоне гипергидратации в первый день цикла и бевацизумаб в дозе 7,5 мг/кг инфузия 30–90 минут в первый день каждого 21-дневного цикла. Лечение проводилось на фоне профилактической противорвотной терапии, а также терапии фолиевой кислотой 1000 мкг ежедневно и витамином В12 1000 мг (каждые два-три введения пеметрекседа). После четырех курсов индукционной терапии пациентам, достигшим стабилизации или объективного ответа, лечение было продолжено пеметрекседом и бевацизумабом до прогрессирования опухоли или неприемлемой токсичности.
Проведена оценка объективного ответа по данным мультиспиральной компьютерной томографии (МСКТ) с внутривенным контрастированием согласно критериям RECIST v. 1.1. Анализ токсичности выполнен с помощью критериев CТC АЕ v.4. Определены выживаемость без прогрессирования (время с момента регистрации до документального подтверждения прогрессирования) и общая выживаемость (время с момента регистрации до даты смерти от любой причины). Функцию выживаемости определяли методом Каплана – Мейера.
Результаты
В исследование с сентября 2009 г. по декабрь 2014 г. был включен 21 пациент. Один пациент прекратил лечение после первого курса вследствие ухудшения общего состояния. У 20 пациентов проведена объективная оценка ответа.
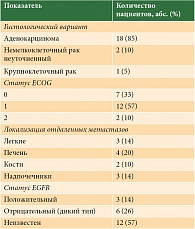
Характеристики пациентов представлены в табл. 1. Среди пациентов в возрасте от 28 до 72 лет (средний возраст – 56 лет) было 12 (57%) женщин и девять (43%) мужчин. В большинстве случаев при гистологическом исследовании выявлена аденокарцинома. В одном случае имел место крупноклеточный рак и в двух – НМРЛ без уточнения. Наличие мутации гена EGFR (делеция в 19-м экзоне) обнаружено у трех (14%) больных. У 12 (57%) пациентов статус EGFR не исследовали. Общее состояние 91% больных расценивалось как удовлетворительное – ECOG 0–1.
Пациенты получили от одного до 72 курсов терапии (в среднем 11 курсов). Четыре курса индукционной терапии завершили 19 (90,4%) пациентов. Из двух пациентов, не получивших программу индукционной терапии, у одного отмечались симптоматическое ухудшение и снижение ECOG после первого курса терапии, у другого – прогрессия опухоли после двух курсов химиотерапии при проведении контрольной МСКТ. Поддерживающую терапию пеметрекседом 500 мг/м2 и бевацизумабом 15 мг/м2 с интервалом три недели получали 18 больных.
Объективный ответ на терапию, по данным МСКТ, в соответствии с критериями RECIST v. 1.1, получен у 20 пациентов. Частичная регрессия достигнута у 14 (70%) больных, еще у пятерых (25%) – стабилизация. У одного (5%) пациента при первой МСКТ после двух курсов терапии зафиксирована прогрессия. Случаев полной регрессии опухоли не зарегистрировано.
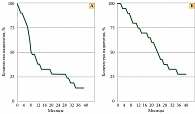
Медиана выживаемости без прогрессирования и медиана общей выживаемости составили восемь и 24 месяца соответственно (см. рисунок).
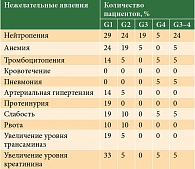
Один пациент умер после третьего курса индукционной терапии от пневмонии единственного легкого на фоне нейтропении и тромбоцитопении 4-й степени и развившейся дыхательной и почечной недостаточности. Других случаев негематологической токсичности 3–4-й степени не отмечалось. Чаще имела место гематологическая токсичность. Нейтропения 3–4-й степени зафиксирована у пяти (24%) пациентов (табл. 2).
Обсуждение
Медиана выживаемости без прогрессирования составила восемь месяцев, а общая выживаемость – 24 месяца. Это значительно превышает показатели, которые обычно имеют место при проведении стандартных платиновых дуплетов [3, 4].
В исследовании AVAPERL сравнивали эффективность комбинации пеметрекседа и бевацизумаба с таковой бевацизумаба в монорежиме в качестве поддерживающей терапии при неплоскоклеточном НМРЛ [9]. Получено достоверное увеличение выживаемости без прогрессирования с 6,6 месяца в группе бевацизумаба до 10,2 месяца в группе комбинированной терапии. Однако достигнутое четырехмесячное различие в общей выживаемости (15,9 против 19,8 месяца) оказалось статистически недостоверным (р < 0,32).
В настоящее время проводится исследование ECOG 5508, посвященное оценке различных режимов поддерживающей терапии – пеметрекседа, бевацизумаба и их комбинации. Результаты позволят разработать оптимальную схему поддерживающей терапии при неплоскоклеточном НМРЛ [11].
При выборе и проведении терапии распространенного неплоскоклеточного НМРЛ следует учитывать, что заболевание на этой стадии неизлечимо. Именно поэтому основными задачами лечения являются увеличение продолжительности жизни больных (одно- и двухлетняя выживаемость), улучшение качества жизни (облегчение симптомов заболевания, профилактика и лечение осложнений терапии), сбалансированность терапевтического эффекта (в том числе выживаемости) и качества жизни пациентов [12, 13].
Полученные нами данные о переносимости поддерживающей терапии демонстрируют хороший профиль безопасности и согласуются с данными других исследований по оценке комбинации пеметрекседа и бевацизумаба в качестве поддерживающей терапии [9, 14].
Заключение
Поддерживающая терапия пеметрекседом и бевацизумабом хорошо переносится пациентами, приводит к значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению со стандартными схемами терапии. Подобная терапия высокоэффективна у пациентов с распространенным неплоскоклеточным НМРЛ, у которых не отмечено прогрессирования после индукционной терапии.
D.M. Ponomarenko, D.Yu. Yukalchuk, A.V. Shevchuk, M.V. Demchenkova, D.A. Bogomolov, I.D. Klimova, N.A. Kravchenko, S.S. Sidorova, Ye.A. Likhova
District Oncologic Dispensary (Irkutsk)
Contact person: Dmitry Mikhaylovich Ponomarenko, ponomarenkodm@gmail.com
Objective – to examine efficacy and safety of the first-line chemotherapy with pemetrexed, cisplatin, and bevacizumab followed by supportive therapy with pemetrexed and bevacizumab in 21 patients with unresectable, advanced stage non-small cell lung cancer.
Materials and Methods. Patients were treated with pemetrexed at dose of 500 mg/m2 in combination with cisplatin (75 mg/m2) and bevacizumab (7.5 mg/m2) every three weeks, for up to four courses. Patients with partial regression were then kept at supportive therapy with pemetrexed and bevacizumab until progression or intolerance.
Results. Objectively, a therapeutic response as a partial regression or stabilization was reached in 14 and 5 patients, respectively. Median progression-free and total survival was eight and 24 months, respectively. Hematological toxicity was the most common adverse event, grade ¾ neutropenia was documented in 24% patients.
Conclusion. A combination of pemetrexed, cisplatin, and bevacizumab was characterized by high direct efficiency, acceptable toxicity profile and associated with high total survival during non-small cell lung cancer.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.