Рациональное лечение болевого синдрома в практике терапевта: фокус на эффективность и безопасность
- Аннотация
- Статья
- Ссылки
- English


Введение
Боль – субъективное ощущение, которое заставляет пациента обращаться за медицинской помощью. Часто она вызвана поражением опорно-двигательного аппарата: патологией суставов (остеоартроз), мышечно-суставно-связочного аппарата (неспецифическая боль в спине) или околосуставных мягких тканей (тендиниты, бурситы, теносиновиты). В популяции широко представлены хронические скелетно-мышечные болевые синдромы: в среднем они встречаются у каждого пятого человека. Суставные боли беспокоят треть людей в возрасте от 25 до 75 лет и уже 80% в возрасте 75 лет и старше. Несмотря на то что боль – основная жалоба у данных пациентов, ее локализация может быть различной: кисти, позвоночник, коленные или тазобедренные суставы [1]. Еще одна широко распространенная клиническая, социальная и экономическая проблема, затрагивающая население во всем мире, – неспецифическая боль в спине. Она встречается примерно у 60–80% людей в разные периоды их жизни, в том числе в детстве [2].
К основным причинам неспецифической боли в спине относятся спондилез, спондилоартроз, мышечная дисфункция, воспаление, повреждения связочного аппарата позвоночника на фоне перегрузок и нарушения биомеханики. По данным Всемирной организации здравоохранения, в Российской Федерации распространенность боли в спине составляет 56%. Установлено, что в среднем боль в спине чаще встречается у женщин (35%), сельских жителей (32%) и людей с абдоминальным типом ожирения (36%). И если интенсивность боли, функциональные нарушения и качество жизни не коррелируют с рентгенологическими изменениями в поясничном отделе, то их связь с возрастом и коморбидными заболеваниями прослеживается четко [3]. Среди пациентов с двумя или более хроническими заболеваниями распространенность болей в спине составляет 59% [3, 4]. Поэтому клинический успех лечения болевого синдрома основан на своевременной и правильной диагностике с учетом коморбидных факторов конкретного пациента с последующим назначением адекватной комплексной терапии и ранним началом реабилитационных мероприятий. Именно они являются залогом длительной ремиссии.
Далее будет представлен короткий алгоритм рациональной тактики ведения пациентов с болью при патологии опорно-двигательного аппарата на примере боли в спине в ограниченных условиях амбулаторного приема [5].
Алгоритм диагностики и лечения боли в спине
Шаг 1. Жалобы, анамнез
Основная жалоба в таких случаях – боль, которая локализуется в нижней части спины: поясничном отделе позвоночника (люмбалгия) или поясничном отделе позвоночника с иррадиацией в ногу (люмбоишиалгия). При этом произвольные движения в поясничном отделе совершаются в неполном объеме из-за усиления боли. Боль может возникать после физической нагрузки, неловкого движения или переохлаждения и длительного нахождения в вынужденном положении. Боль носит стягивающий, ноющий характер, усиливается при движении, определенных позах, ходьбе и уменьшается после отдыха, растирания, разминания и растяжения мышцы.
Шаг 2. Физикальное обследование
Основные цели физикального обследования – воспроизвести симптомы, локализовать поражение и определить (если возможно) причину боли с помощью функциональных проб.
Уже на этапе общего осмотра можно провести дифференциальную диагностику и выявить лихорадку, похудение, изменение формы суставов или цвета кожных покровов, лимфоаденопатии, гепатолиенальный синдром и др.
При первичном обращении необходимо исключить «красные флажки» (симптомы угрожающей жизни патологии) (табл. 1), а при их наличии провести дополнительные обследования и/или направить на консультацию к специалистам [6]:
- неврологу (при наличии «красных флажков»);
- ревматологу (при симптомах воспалительного характера заболевания);
- травматологу-ортопеду (при патологических изменениях в тазобедренных суставах, костях таза);
- урологу, проктологу, гинекологу, хирургу (при локализации боли, указывающей на возможность заболевания органов малого таза).
Кратность осмотра – один раз в три-четыре дня.
Шаг 3. Лабораторная и инструментальная диагностика
Назначаются лабораторные исследования:
- клинический анализ крови;
- клинический анализ мочи (при подозрении на почечную патологию и/или при сохраняющемся болевом синдроме на протяжении одной недели).
Проводятся инструментальные исследования:
- рентгенография пояснично-крестцового отдела позвоночника;
- рентгенография костей таза с захватом тазобедренных суставов;
- ультразвуковое исследование почек (при подозрении на почечную патологию);
- магнитно-резонансная томография пояснично-крестцового отдела позвоночника (при сохраняющемся болевом синдроме на протяжении одной недели, при наличии общей инфекционной симптоматики или онкологического процесса в анамнезе).
Шаг 4. Определение терапевтической стратегии
В некоторых случаях необходимы консультации специалистов:
- невролога (при симптомах, указывающих на поражение корешка или спинного мозга, отсутствии эффекта от лечения или нарастании болевого синдрома в течение четырех недель);
- онколога (при подозрении на онкологический процесс на рентгеновском снимке);
- травматолога (при костно-травматических изменениях на рентгеновском снимке).
Шаг 5. Рациональная терапия болевого синдрома
Медикаментозная терапия острого болевого синдрома в спине предусматривает применение средств, влияющих на основные патогенетические механизмы: воспаление, болезненный мышечный гипертонус, нарушение трофики нервной ткани и др.
Нестероидные противовоспалительные препараты в лечении болевого синдрома
Нестероидные противовоспалительные препараты (НПВП) до сих пор остаются актуальным средством лечения острого болевого синдрома при патологии опорно-двигательного аппарата. Как в монотерапии, так и в составе комплексной терапии они воздействуют на воспаление и тем самым снижают интенсивность болевого синдрома, что важно для начала лечебных и реабилитационных мероприятий [7].
В настоящее время известно около 50 международных непатентованных наименований НПВП, которые представлены в виде форм для системного (внутримышечного, перорального, ректального) или местного (эмульгель, мазь, гель) применения. Курс лечения не должен превышать 10–14 дней. Системные формы не используются в комбинации друг с другом и требуют параллельного назначения гастропротекторов.
Принципы назначения
Следует остановиться на некоторых важных моментах терапии НПВП [6]. Длительность курса НПВП определяется временем, необходимым для максимально полного купирования боли и восстановления функции опорно-двигательного аппарата. О достаточной эффективности НПВП можно говорить при уменьшении боли не менее чем на 50% от исходного уровня и не позднее пяти – семи дней после начала приема лекарственного средства в полной терапевтической дозе. Неэффективность лечения (уменьшение интенсивности боли менее 20% от исходного уровня) с помощью адекватных доз НПВП в течение двух – четырех недель служит основанием для того, чтобы проконсультироваться с неврологом.
При назначении НПВП всегда нужно учитывать риск развития нежелательных явлений. Не следует комбинировать два и более разных препаратов этой группы, а также использовать дозы, превышающие рекомендованные. Во всех случаях для предупреждения нежелательных реакций НПВП должны использоваться ингибиторы протонной помпы (например, омепразол, рабепразол).
Выделяют следующие противопоказания для назначения системных НПВП:
- высокий риск сердечно-сосудистых осложнений;
- язва или эрозии желудочно-кишечного тракта (по результатам эндоскопического исследования);
- хроническая болезнь почек при скорости клубочковой фильтрации < 30 мл/мин;
- воспалительные заболевания кишечника (язвенный колит, болезнь Крона);
- аллергия на НПВП;
- беременность.
Особенности применения топических форм
С учетом более высокого риска нежелательных явлений у системных форм НПВП (побочные эффекты со стороны желудочно-кишечного тракта, сердечно-сосудистой системы, почек и др.) местные формы, эквивалентные системным по эффективности, но при этом обладающие хорошим профилем безопасности, активно используются в клинической практике. Топические формы НПВП в виде мазей и гелей локально воздействуют на очаг боли и воспаления. Их применение показано в следующих случаях:
- пораженный участок располагается на небольшой глубине в ткани;
- трансдермальная диффузия обеспечит в этой области достаточную концентрацию для получения лечебного эффекта препарата;
- необходимо снизить риск системного воздействия на организм (при использовании топических форм НПВП системная абсорбция минимальна) [8].
Таким образом, если можно непосредственно воздействовать на очаг боли и воспаления, то назначают местные формы НПВП в виде мазей и гелей. Поэтому в международных рекомендациях топические НПВП указываются как первая линия терапии боли при патологии суставов [9–23]. Следует отметить, что 75% пациентов предпочитают топическое нанесение в сравнении с пероральным приемом [14].
Преимущества топических НПВП и случаи, когда их применение ограничено, приведены в табл. 2 [24].
Диклофенак и его топические формы
С 1966 г. в клинической практике используется диклофенак, который в течение многих десятилетий считался золотым стандартом среди НПВП. Его противовоспалительное действие реализуется за счет нескольких механизмов. Он неселективно ингибирует циклооксигеназу 1 и 2, нарушая синтез простагландинов – медиаторов воспаления, уменьшает миграцию лейкоцитов в очаг воспаления и ограничивает повреждающее действие окислительного стресса на ткани. За счет центрального и периферического воздействия на механизмы восприятия боли одновременно реализуется анальгетический потенциал диклофенака [25].
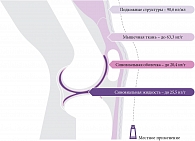
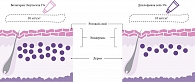
Большой клинический интерес вызывают топические формы диклофенака. И в первую очередь это препараты линейки Вольтарен Эмульгель с активным веществом диклофенака диэтиламин в форме эмульгеля (масляной эмульсии в гидрогеле) [26–28]. Такая форма при топическом нанесении позволяет диклофенаку воздействовать на источник боли, глубоко проникая в ткани через кожу (рис. 1) [29]. Сравнительные экспериментальные исследования in vitro по проникновению через кожный барьер для препарата Вольтарен Эмульгель 1% и геля диклофенака 5% показали, что для топических НПВП большее значение имеет форма, а не концентрация действующего вещества. Благодаря форме эмульгель диклофенак в составе препарата Вольтарен в семь раз активнее проникает через кожу по сравнению с обычным гелем диклофенака 5% (в процентном соотношении) (рис. 2) [30].
Фармакокинетика диклофенака диэтиламина в составе препарата Вольтарен Эмульгель хорошо изучена. Количество диклофенака, всасывающегося через кожу, пропорционально площади обрабатываемой поверхности и зависит как от суммарной дозы наносимого препарата, так и от степени гидратации кожи. На седьмой день относительная биодоступность препарата составляет 4,5% (для эквивалентной дозы натриевой соли диклофенака). При ношении влагопроницаемой повязки всасывание не изменяется [27].
Линейка топических препаратов Вольтарен
Для безопасного клинического применения разработаны три топические формы:
- Вольтарен Эмульгель 1% (1,16 г диклофенака диэтиламина соответствуют 1 г диклофенака натрия на 100 г геля);
- Вольтарен Эмульгель 2% 12 часов (2,32 г диклофенака диэтиламина соответствуют 2 г диклофенака натрия на 100 г геля);
- Вольтарен трансдермальный пластырь (15 мг и 30 мг диклофенака).
Указанные формы обладают следующими ключевыми преимуществами:
- высокая противовоспалительная и анальгетическая эффективность по сравнению с большинством стандартных НПВП и селективных ингибиторов циклооксигеназы 2 [31];
- низкий уровень системной абсорбции;
- многообразие лекарственных форм;
- отсутствие лекарственных взаимодействий (вследствие малой системной абсорбции);
- благоприятный профиль переносимости;
- широкий спектр показаний [26, 27, 32, 33].
Вольтарен Эмульгель 1%. Диклофенак проникает в кожу на глубину 1 см непосредственно к очагу воспаления и боли. Это позволяет воздействовать на боль, воспаление и отек, что способствует ускорению выздоровления и улучшению объективных показателей (по индексу выраженности остеоартроза, разработанному университетами Западного Онтарио и МакМастера – WOMAC) [34]. Благодаря водно-спиртовой основе Вольтарен Эмульгель оказывает успокаивающий и охлаждающий эффект. Он обладает легкой текстурой, поэтому быстро впитывается, не требует длительного и интенсивного втирания в кожу. Характеризуется низким риском системных побочных эффектов в сравнении с системными формами НПВП: не более 6% диклофенака попадает в системный кровоток [26, 35]. Стоит отметить также удобство применения препарата: крышка-аппликатoр позволяет наносить препарат на кожу, не пачкая руки. Его удобно взять с собой в офис, на тренировку, в поездку. Взрослым и детям старше 12 лет показано нанесение препарата на кожу три-четыре раза в сутки с легким втиранием. Необходимое количество препарата зависит от размера болезненной зоны. Разовая доза препарата составляет 2–4 г [26].
Вольтарен Эмульгель 2% 12 часов. Благодаря уникальной формуле с двойной концентрацией диклофенака и включением усилителя проницаемости (олеилового спирта) этот препарат достаточно наносить один раз в 12 часов для снижения выраженности боли [27, 28, 36]. Концентрация диклофенака диэтиламина в тканях сустава в 20 раз выше, чем в плазме [27]. Эффективность данной топической формы сопоставима с пероральным приемом НПВП [37, 38]. Клинический эффект сопровождается также снятием отека и улучшением подвижности суставов [27]. Более 90% пациентов, применявших препарат, удовлетворены лечением [32]. У 70% пациентов с хронической болью в суставах отмечено уменьшение болевого синдрома на 50% и более [32, 39]. Вольтарен Эмульгель 2% 12 часов также удобен в использовании: туба имеет треугольную крышку, которая легко открывается даже при боли и нарушении функции суставов кисти. Препарат разрешен взрослым и детям старше 12 лет, его наносят на кожу два раза в сутки (утром и вечером), слегка втирая. Необходимое количество препарата зависит от размера болезненной зоны. Разовой дозы препарата (2–4 г) достаточно для обработки зоны площадью 400–800 см2 [27].
Вольтарен трансдермальный пластырь. Выпускается два типа пластыря: с содержанием диклофенака 15 мг (размер 70 × 100 мм) или 30 мг (размер 100 × 140 мм). Оба предназначены для однократного применения в течение 24 часов. Количество диклофенака, абсорбируемое из пластыря за это время, сходно с таковым при применении эквивалентного количества препарата Вольтарен Эмульгель 1%. Трансдермальный пластырь может назначаться пациентам с нарушениями функции почек, поскольку не приводит к кумуляции диклофенака и его метаболитов. У пациентов, страдающих хроническим гепатитом или недекомпенсированным циррозом, кинетика и метаболизм диклофенака такие же, как и у пациентов, не имеющих заболеваний печени. Данная форма удобна молодым и активным людям, а кроме того, пациентам пожилого возраста, которым сложно самостоятельно наносить НПВП из тубы [33].
Показания к применению трансдермальных форм препарата Вольтарен:
- боли в суставах, в том числе суставах пальцев рук, коленных суставах, при ревматоидном артрите, остеоартрозе;
- боли в мышцах вследствие растяжений, перенапряжений, ушибов, травм;
- воспаление и отечность мягких тканей и суставов в результате травм и при ревматических заболеваниях (тендовагините, бурсите, поражениях периартикулярных тканей);
- боли в спине при воспалительных и дегенеративных заболеваниях позвоночника (радикулите, остеоартрозе, люмбаго, ишиасе) [26, 27, 33].
Клиническая эффективность топических препаратов Вольтарен
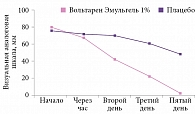
В рандомизированных клинических двойных слепых плацебоконтролируемых исследованиях была продемонстрирована активность препарата Вольтарен Эмульгель 1% в облегчении боли при остром шейном болевом синдроме:
- быстрый терапевтический эффект (уже через час после нанесения);
- значительно более выраженное снижение показателей «боль при движении» (рис. 3), «боль в покое», «нарушение функции шейного отдела» по сравнению с плацебо в течение всего периода наблюдения (пять дней);
- сокращение срока восстановительного периода на 50% по сравнению с плацебо, то есть ослабление интенсивности боли и улучшение двигательной функции в шейном отделе [40].
К пятому дню применения препарата Вольтарен Эмульгель 2% с частотой два-три раза в день более чем у 70% пациентов было достигнуто значительное уменьшение интенсивности болевого синдрома (на 50% и более) (в группе плацебо – только у 20,7%). К восьмому дню 93,8% пациентов заявили об удовлетворенности терапией Вольтареном Эмульгелем [36].
Профиль безопасности топических препаратов Вольтарен
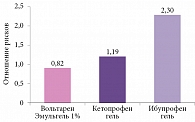
Топические формы Вольтарен Эмульгель имеют низкий уровень системной абсорбции (менее 6%), что снижает риск системного воздействия на организм, а также вероятность межлекарственных взаимодействий [29]. Относительный риск (в сравнении с плацебо) развития местных нежелательных явлений при наружном применении НПВП представлен на рис. 4 [41]. Вольтарен Эмульгель характеризуется хорошей переносимостью и наиболее низким риском развития побочных эффектов. При сравнении с плацебо этот риск составляет 0,82, что меньше, чем у кетопрофена и ибупрофена в виде геля [41].
Еще один немаловажный критерий безопасности НПВП – его влияние на метаболизм гиалинового хряща НПВП. По этому параметру все НПВП можно классифицировать на препараты, обладающие хондронегативным, хондронейтральным и хондропротективным действием. Хондронегативными являются индометацин, пироксикам, напроксен и некоторые другие традиционные НПВП. К хондронейтральным относятся ибупрофен и диклофенак [42]. В исследованиях in vitro продемонстрировано, что молекула диклофенака не влияет на метаболический баланс протеогликанов и гиалуроновой кислоты в суставном хряще при остеоартитре [43, 44].
Сравнение клинической эффективности топических форм
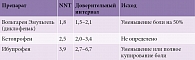
Несмотря на то что прямые сравнительные исследования препаратов проводятся редко, можно выполнить непрямое сравнение их клинической эффективности и безопасности при условии, что в исследованиях каждого из них использовался одинаковый препарат сравнения (или плацебo). Основным показателем, который позволяет оценивать эффективность препаратов в таких исследованиях, является число больных, которых необходимо пролечить (number needed to treat – NNT) исследуемым препаратом, чтобы достигнуть одного благоприятного исхода, которого пациент бы не достиг при применении плацебо. Показатель NNT для идеального препарата равен 1. Это означает, что 100% больных выздоравливают от его применения, а в контрольной группе никто не выздоравливает. Поэтому чем ближе значение NNT к 1, тем лучше [45].
Такое непрямое сравнение диклофенака в форме эмульгель, кетопрофена и ибупрофена было проведено на основании клинических данных для каждого препарата, полученных в плацебоконтролируемых исследованиях с участием пациентов с острой болью, вызванной растяжением связок, вывихами суставов, спортивными травмами и травмами, связанными с перенапряжением. Продолжительность наблюдения составила семь дней. Критерием эффективности было уменьшение боли не менее чем на 50% [45]. Результаты исследования показали, что в случае терапии диклофенаком индекс NNT составил 1,8, при применении кетопрофена – 2,5, а ибупрофена – 3,9 (табл. 3). Таким образом, вероятность положительного клинического эффекта среди НПВП для местного использования, определенная с помощью NNT, была выше у диклофенака в форме эмульгель [45].
Нестероидные противовоспалительные препараты в комбинированной терапии
Комбинация с нейротропными витаминами. Нейротропные витамины стимулируют процессы, которые улучшают функцию нервной системы и ослабляют интенсивность болевого синдрома. В частности, витамин В1 улучшает энергообеспечение нейронов, витамин В6 контролирует синтез транспортных белков в осевых цилиндрах, витамин В12 активирует синтез липопротеинов, служащих структурным элементом миелиновых волокон. Комплекс витаминов В1, В6, В12 тормозит прохождение болевых импульсов не только на уровне заднего рога, но и в таламусе.
Витамины группы В потенцируют действие НПВП. Наиболее эффективны трехкомпонентные комплексы, содержащие витамин В1 (тиамин), В6 (пиридоксин) и В12 (цианокобаламин) в высоких дозах в одной таблетке или ампуле. Используется ступенчатая терапия – сначала инъекционная форма (по одной ампуле в сутки) до снятия острых симптомов, далее пероральный прием (по одной таблетке три раза в день). Витамины назначаются на длительный срок (до двух месяцев).
Комбинация с миорелаксантами. При наличии признаков выраженного мышечного спазма и неэффективности монотерапии НПВП рекомендованы миорелаксанты. Назначаются короткими курсами (на 7–14 дней).
Немедикаментозная терапия болевого синдрома
В большинстве случаев боль в спине имеет благоприятный прогноз. Это определяет приоритетность консервативной терапии, которая включает:
- информирование пациента о доброкачественном характере заболевания и высокой вероятности быстрого выздоровления при соблюдении рекомендаций врача;
- изменение образа жизни;
- отсутствие необходимости в соблюдении постельного режима и выбора кровати с жесткой поверхностью;
- избегание как чрезмерной двигательной и физической активности, так и длительных статических нагрузок;
- коррекцию биомеханики движений;
- ходьбу три – семь раз в неделю по 45–60 минут;
- снижение массы тела;
- профилактику запоров;
- консультацию врача физиотерапевта, рефлексотерапевта;
- привлечение других специалистов (кинезитерапевта, мануального терапевта, психолога и др.), которое осуществляет невролог.
Важно, чтобы врач обучил пациентов безопасным движениям для самообслуживания дома, на работе и в других местах. В частности, как садиться и ложиться на кровать и вставать с нее, садиться на стул и вставать с него, держать осанку и голову, поднимать тяжести. Кроме того, пациенты должны знать основы защиты спины (посредством автоприспособлений, ортезов, вспомогательных и переносных устройств, организации сна, быта, питания) [7]. Им может быть полезна ранняя реабилитация с помощью кинезитерапии по авторской программе лечения и реабилитации пациентов с болью в спине и суставах «Давайте жить без боли» [46]. В ней представлены комплексы упражнений (в период обострения и между обострениями) в зависимости от локализации боли, в том числе при боли в шее, шейно-грудном отделе и руках, грудном и пояснично-крестцовом отделе, тазобедренных и коленных суставах.
Немедикаментозная терапия играет важную роль в комплексном лечении пациентов с болью, и уменьшение выраженности боли – не единственный ее эффект. Регулярные занятия с техникой динамической мышечной стабилизации (статодинамический стрейчинг на основе йоги и пилатеса в рамках аэробной нагрузки) составляют основу терапии, реабилитации и профилактики боли в спине, это способствует повышению сил и выносливости мышц позвоночника [47]. Доказанный клинический эффект в немедикаментозном лечении и реабилитации имеют такие виды кинезитерапии, как йога и тай чи. Регулярные занятия не только положительно влияют на структуры опорно-двигательного аппарата и приносят обезболивающий эффект, но и ослабляют симпатоадреналовую активность, что благоприятно сказывается на общем самочувствии пациентов [48, 49], способствуют улучшению баланса [50], лучшему контролю артериальной гипертензии [51], повышению когнитивных способностей [52] и снижению депрессии [53], а также уменьшают страх перед падением [54], повышают силу в ногах [55], улучшают общее физическое функционирование [56].
Заключение
Боль в спине – одна из наиболее распространенных моделей болевого синдрома при патологии опорно-двигательного аппарата. Представленный в статье пошаговый алгоритм адаптирован к современной клинической реальности и позволяет в ограниченных условиях амбулаторного приема выбрать адекватную тактику диагностики и ведения пациентов с болью в спине. В алгоритме обсуждаются топические формы НПВП, которые представляют собой эффективную и более безопасную альтернативу системным формам, а также могут сочетаться с ними и усиливать их эффект без повышения риска нежелательных явлений. Однако успех лечения зависит не только от скорости купирования или уменьшения болевого синдрома, но и длительности стойкой ремиссии, которая определяет безболевое качество жизни. Поэтому немедикаментозной терапии отводится важная роль на всех этапах лечения и реабилитации пациентов.
Ye.S. Akarachkova, MD, PhD, A.R. Artemenko, MD, PhD, A.A. Belyaev, D.V. Blinov, PhD, Ye.V. Bugorsky, L.R. Kadyrova, PhD, K.S. Kerimova, L.V. Klimov, PhD, O.V. Kotova, PhD, D.I. Lebedeva, PhD, A.S. Orlova, PhD, A.M. Tkachev, Ye.V. Tsareva, O.N. Yakovlev
International Society of Stress Under Control, Moscow
I.M. Sechenov First Moscow State Medical University
N.V. Sklifosovsky Clinical and Research Institute of Emergency Medicine, Moscow
Institute of Preventive and Social Medicine, Moscow
Rehabilitation Center Rehaline, Moscow region
Kazan State Medical Academy – Branch Campus of the FSBEI FPE RMACPE MOH Russia
MediSPA, Moscow
Scientific and Practical Center for Child Psychoneurology of the Moscow Healthcare Department
National Medical Research Center for Cardiology, Moscow
Tyumen State Medical University
DTC MIBS-Volgograd
Medical Center ‘Unison’, Moscow
Clinic ‘Median’, Germany
Contact person: Yelena S. Akarachkova, nevrorus@mail.ru
The treatment of pain that has developed as a result of diseases of the musculoskeletal system is still an urgent problem. Patients with pain often apply to medical care, use (sometimes uncontrollably) analgesics, experience anxiety, fear, and depression. Pain negatively affects their ability to work and social contacts. Often, pain is accompanied by non-painful somatic symptoms limiting the choice of painkillers, which increases the psychological distress from the pain and ultimately worsens the overall mental and somatic status of patients. In this regard, the main task of the doctor is to stop the pain syndrome quickly and safely, while maintaining the social activity of patients. The step-by-step algorithm proposed in the article allows choosing an adequate strategy for diagnosis and management of patients with back pain in limited outpatient settings. The algorithm involves the use of non-steroidal anti-inflammatory drugs, including their topical forms, which are an effective and safer alternative to systemic forms, and can also be combined with them and enhance their effect without increasing the risk of adverse events.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.