Респираторная аллергия: просто о сложном. Межрегиональный форум «Клиническая иммунология и аллергология – междисциплинарные проблемы»
- Аннотация
- Статья
- Ссылки
На симпозиуме, посвященном диагностике, лечению и профилактике респираторной аллергии, прозвучали доклады специалистов разных медицинских направлений – пульмонологов, иммунологов-аллергологов, отоларингологов. Эксперты проанализировали с научной и практической точки зрения эффективность, безопасность и целесообразность применения современных препаратов у пациентов с респираторными инфекциями на фоне отягощенного аллергологического анамнеза.
На симпозиуме, посвященном диагностике, лечению и профилактике респираторной аллергии, прозвучали доклады специалистов разных медицинских направлений – пульмонологов, иммунологов-аллергологов, отоларингологов. Эксперты проанализировали с научной и практической точки зрения эффективность, безопасность и целесообразность применения современных препаратов у пациентов с респираторными инфекциями на фоне отягощенного аллергологического анамнеза.





Коморбидные состояния при бронхиальной астме
К распространенным сопутствующим заболеваниям при бронхиальной астме относят прежде всего патологию верхних дыхательных путей – аллергический ринит, полипоз носа, синусит. Нередко имеют место дисфункция голосовых связок, хроническая обструктивная болезнь легких (ХОБЛ), сердечно-сосудистые заболевания (ишемическая болезнь сердца (ИБС), артериальная гипертензия), ожирение, сахарный диабет, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), психические расстройства (тревога, депрессия), респираторные инфекции и др. При тяжелой бронхиальной астме возрастает частота сопутствующих заболеваний, связанных с приемом системных глюкокортикостероидов (ГКС), – остеопороза, сахарного диабета, язвенной и неязвенной диспепсии, катаракты. Не случайно в основе лечения больных тяжелой астмой лежит использование минимальных доз ГКС.
В популяционном исследовании с участием 42 236 пациентов из стран с низким и средним уровнем доходов населения (Китай, Гана, Индия, Мексика, Россия, Южная Африка) оценивали распространенность мультиморбидности, двух и более хронических заболеваний – бронхиальной астмы, ИБС, артрита, артериальной гипертензии, инсульта и нарушения зрения. Согласно полученным данным, заболеваемость у таких больных составила 54,2%. Мультиморбидность зарегистрирована в 21,9% случаев. Уровень мультиморбидности в России оказался максимальным – 34,7%, в Китае минимальным – 20,3%. Наименьший показатель мультиморбидности зафиксирован в странах с более высоким уровнем дохода. Результаты исследования показали также, что на фоне мультиморбидности снижаются работоспособность, качество жизни пациентов и возрастает частота депрессий. Вероятность развития мультиморбидности увеличивается с возрастом1.
В последние годы медицинским сообществом активно обсуждается тема сочетания аллергического ринита и бронхиальной астмы. По данным эпидемиологических исследований, 80–99% больных астмой страдают аллергическим ринитом. В свою очередь у 38–56% пациентов с ринитом отмечается бронхиальная астма.
Аллергический ринит относится к факторам риска развития астмы. Оба заболевания имеют ряд схожих признаков. Речь, в частности, идет об этиологической роли ингаляционных аллергенов, развитии IgE-зависимых реакций, высвобождении медиаторов воспаления (гистамина, лейкотриенов и др.), активации и накоплении эозинофилов. Ряд биологических лекарственных препаратов, предназначенных для лечения бронхиальной астмы, эффективны в уменьшении выраженности симптомов сопутствующего ринита. При бронхиальной астме и аллергическом рините доказана эффективность ГКС, антилейкотриеновых препаратов, аллергенспецифической иммунотерапии (АСИТ).
Говоря о схожести проявлений заболеваний, нельзя не сказать и о различиях. Так, нарушение структуры эпителия и утолщение базальной мембраны, наблюдаемые при бронхиальной астме, отсутствуют при аллергическом рините. Для последнего характерно наличие венозных синусоидов. При аллергическом рините доказана эффективность Н1-блокаторов, при бронхиальной астме – бета-2-агонистов.
J. Bousquet и соавт. изучали влияние нелеченого аллергического ринита на течение астмы. Показано, что в отсутствие терапии аллергического ринита у больных бронхиальной астмой возрастают частота ее обострения и количество обращений за неотложной медицинской помощью. Отмечается высокая частота госпитализаций, а также высокая потребность в назначении бета-2-агонистов короткого действия. Таким образом, нелеченый аллергический ринит негативно отражается на течении сопутствующей астмы2.
Результаты исследования последних лет подтверждают, что наличие ожирения у больных бронхиальной астмой ухудшает контроль заболевания, повышает риск обострений, способствует развитию воспаления дыхательных путей нейтрофильного типа и снижает чувствительность к ингаляционным ГКС. Существует ряд гипотез взаимосвязи между ожирением и астмой. Во-первых, ожирение способно нарушать механику дыхания при бронхиальной астме. Во-вторых, патогенетическое значение воспаления жировой ткани для развития бронхиальной астмы имеют медиаторы воспаления, продуцируемые жировой тканью. При ожирении повышается риск развития других заболеваний, в частности ГЭРБ, сахарного диабета, ночного апноэ. Так или иначе, эти факторы ухудшают течение бронхиальной астмы.
В США анализировали влияние снижения массы тела на течение бронхиальной астмы у пациентов с ожирением. Как показали полученные данные, лечение ожирения улучшает контроль астмы и функцию легких, уменьшает выраженность симптомов и воспаление дыхательных путей. Следовательно, снижается частота госпитализаций, обращений за неотложной медицинской помощью. Исследователи отметили, что для достижения подобных эффектов показатель снижения массы тела должен быть не менее 10%3. Конечно, этого трудно достичь в реальной клинической практике. Поэтому лечение пациентов с ожирением и бронхиальной астмой остается чрезвычайно актуальной и сложной задачей.
Одним из опасных факторов риска развития и прогрессирования бронхиальной астмы является табакокурение. Доля курильщиков среди больных бронхиальной астмой составляет 25%, что сопоставимо с показателем распространенности курения в популяции в целом. Табакокурение ассоциируется с повышенным риском развития тяжелых форм заболевания, увеличением частоты обострений, ускорением прогрессирования, потерей контроля над бронхиальной астмой, снижением или отсутствием ответа на терапию ингаляционными ГКС. Среди курящих пациентов с бронхиальной астмой отмечаются высокая частота летальности, госпитализаций, более вероятное формирование малообратимой бронхиальной обструкции.
В российском исследовании изучали распространенность курения среди взрослого населения Санкт-Петербурга. На вопрос о курении положительно ответили 50,8% мужчин и 12,4% женщин (28,5% всей выборки). Из лиц мужского и женского пола, страдавших бронхиальной астмой, в табакокурении признались 35,2 и 18,5% соответственно (23,4% выборки)4.
Эффективность ингаляционных ГКС при лечении курящих пациентов с бронхиальной астмой снижается. Флутиказона пропионат у курильщиков менее эффективен, чем у некурящих больных бронхиальной астмой5.
В качестве возможных механизмов снижения чувствительности к ГКС у курящих больных бронхиальной астмой и пациентов с ХОБЛ рассматриваются:
- увеличение содержания нейтрофилов;
- уменьшение уровня эозинофилов;
- увеличение содержания цитокинов/медиаторов;
- изменение экспрессии рецепторов к ГКС;
- активация провоспалительных факторов транскрипции;
- повышение транскрипции воспалительных генов за счет уменьшения активности деацетилазы гистонов из-за окислительного стресса6.
Отказ от курения положительно влияет на течение астмы: улучшается контроль заболевания, уменьшается выраженность клинических симптомов, повышается качество жизни, чувствительность к ГКС7.
Несмотря на доказанное негативное влияние табачного дыма на течение бронхиальной астмы и рекомендации врачей, многие пациенты не отказываются от вредной привычки. Ведение таких больных подразумевает индивидуальный терапевтический подход и использование комбинаций современных препаратов.
В заключение профессор А.В. Емельянов подчеркнул, что своевременная терапия сопутствующих заболеваний способна улучшить контроль астмы. Именно поэтому актуальной задачей практических врачей остается лечение сопутствующих заболеваний у пациентов с бронхиальной астмой.
Иммунитет и атопия
Как известно, респираторные инфекции часто наблюдаются у больных бронхиальной астмой. Причем тяжесть и длительность симптомов респираторных инфекций значительно выше таковых в популяции в целом. Контролировать аутоиммунные заболевания, а также влиять на их течение позволяют методы, основанные на модуляции иммунных реакций.
В развитии атопических болезней (бронхиальной астмы, аллергического ринита, аллергического конъюнктивита и др.) участвуют как генетические, так и внешнесредовые факторы. К основным иммунным нарушениям при аллергопатологии относятся изменение соотношения Th2- и Th1-клеток, снижение активности Т-регуляторных клеток.
При аллергопатологии следует учитывать уровень антител аллергенспецифического IgЕ. Его общий уровень не всегда отражает степень аллергопатологии. Сывороточный уровень общего IgЕ может быть в норме или повышен. Имеют место изменения цитокинового профиля. Не исключено снижение уровня интерферона гамма и повышение уровней интерлейкинов (ИЛ) 4 и 5. Важным критерием аллергопатологии остается эозинофилия.
По данным отечественных исследований, основными изменениями в иммунном ответе у детей с аллергическими заболеваниями, ассоциированными с инфекцией, считаются снижение резервной функции фагоцитоза, нарушение дифференцировки иммунокомпетентных клеток и гиперпродукция маркеров активации (sCD4, sCD30, sCD95) – признаки эффекта негативной активации (активация Th2-лимфоцитов и супрессия Th1-ответа). У таких пациентов угнетается интерферонопродуцирующая активность лейкоцитов, повышаются уровни хемокинов, факторов миграции лейкоцитов в сыворотке, что говорит о выраженном воспалении в бронхах. При иммунологическом обследовании выявляются признаки функциональной недостаточности иммунной системы. Подтверждение тому – снижение уровней IgA и IgG в сыворотке крови и секреторных IgA8.
Защитные механизмы, составляющие основу мукозального иммунитета, подразделяют на врожденные и приобретенные. Нарушения в функционировании мукозального иммунитета чреваты развитием заболеваний инфекционной и аллергической природы. Развитие аллергического воспаления контролируется не только регуляторными клетками, но также цитокинами ИЛ-10 и трансформирующим фактором роста бета. Лиганды ряда рецепторов врожденного иммунитета контролируют развитие аллергического воспаления за счет индукции различных популяций регуляторных клеток.
По словам профессора А.В. Караулова, рецидивирующая инфекция препятствует контролю над симптомами аллергии даже на фоне проводимой стандартной терапии. Более трети детей с аллергопатологией можно отнести к группе часто болеющих острыми респираторными инфекциями, как правило сопровождающимися обострением основного заболевания.
Сегодня не вызывает сомнения необходимость использования препаратов, восстанавливающих нарушенный иммунный ответ, в первую очередь иммуномодуляторов. На фоне их применения снижаются частота и тяжесть респираторных заболеваний. Кроме того, иммуномодуляторы применяют в целях профилактики осложнений. В настоящее время изучается роль препаратов данной группы c высоким профилем безопасности в контроле течения аллергических заболеваний, прежде всего бронхиальной астмы.
К иммуномодуляторам, используемым в целях лечения и профилактики респираторных инфекций у детей, предъявляются следующие требования:
- высокий профиль безопасности и эффективности с точки зрения доказательной медицины;
- возможность применения в любом возрасте, при различных сопутствующих заболеваниях любой стадии и степени тяжести;
- хорошая совместимость с другими лекарственными средствами (антибактериальными, противовирусными, противогрибковыми, сердечно-сосудистыми и др.);
- возможность использования у пациентов с аллергическими заболеваниями.
Обратите внимание: предпочтение отдается препаратам, способным воспроизводить физиологические механизмы модуляции иммунитета9.
В клинической практике широко используют микробные (экзогенные) иммуномодуляторы, лизаты бактерий и синтетические аналоги экзогенных иммуномодуляторов микробного происхождения.
Иммуностимулирующие препараты на основе бактериальных лизатов повышают специфический и неспецифический иммунитет. В частности, препарат бактериального происхождения ОМ-85 (Бронхо-мунал, Бронхо-Ваксом) выпускается в форме капсул и представляет собой лиофилизированный лизат бактерий: Streptococcus pneumoniae, Haemophilus influenzae, Klebsiella pneumoniae, Klebsiella ozaenae, Staphylococcus aureus, Streptococcus viridans, Streptococcus pyogenes, Moraxella catarrhalis. ОМ-85 предотвращает развитие бактериальных осложнений острых респираторных инфекций, в том числе у детей с атопией за счет стимуляции врожденного и адаптивного иммунитета. Усиление противоинфекционного иммунитета позволяет снизить риск обострения сопутствующей аллергопатологии и активность иммунного ответа, опосредованного Th2 (IgE).
Иммунорегуляторная эффективность лиофилизированного лизата бактерий ОМ-85 подтверждена в экспериментальных исследованиях. На фоне перорального применения ОМ-85 с одновременной сенсибилизацией к овальбумину снижается уровень как специфического, так и общего IgЕ. В образцах клеток селезенки мышей экспериментальной группы выявлены повышенный уровень цитокинов Th1-профиля и пониженная концентрация цитокинов Th2-профиля10.
Лизат ОМ-85 уменьшает аллергическое воспаление и считается эффективным и безопасным в профилактике аллергических заболеваний у детей11.
Следует отметить роль иммуномодуляторов в терапии инфекций смешанной этиологии. Их использование в остром периоде инфекции позволяет усилить гуморальный (антибактериальный) иммунный ответ и тем самым оптимизировать работу иммунной системы. Как следствие – ускорение сроков выздоровления и предотвращение прогрессирования бактериальной суперинфекции.
В ряде случаев этиотропная терапия острых респираторных инфекций неприменима, поскольку идентифицировать возбудителя невозможно, а этиотропные препараты не воздействуют на все значимые звенья патогенеза заболевания. Однако выжидательная тактика у пациентов с атопией может обернуться обострением аллергического заболевания. Элиминации патогенов из организма, снижению вирусной и бактериальной нагрузки способствует своевременное назначение иммунотерапии.
Завершая выступление, профессор А.В. Караулов еще раз обратил внимание аудитории на эффективность препаратов, модулирующих иммунную систему, в комплексном лечении респираторных инфекций и аллергопатологии. Однако иммуномодуляторы с недоказанной эффективностью и безопасностью использовать не следует, равно как и применять их одновременно с препаратами, имеющими аналогичный механизм действия. В целях профилактики обострений и лечения аутоиммунных заболеваний иммуномодуляторы со стимулирующей активностью не назначают.
Аллергопатология верхних дыхательных путей. Место интраназальных ГКС
Для обозначения клинических проявлений при патологии слизистой оболочки полости носа и околоносовых пазух в сочетании с бронхиальной астмой был предложен новый термин – ринобронхиальный комплекс. Полипозный риносинусит – одно из наиболее распространенных хронических заболеваний полости носа и околоносовых пазух. Нередко следствием полипозного риносинусита в сочетании с бронхиальной астмой становятся более тяжелые поражения дыхательных путей, особенно в случае присоединения инфекции. Инфекционно-воспалительный процесс, возникший на неблагоприятном аллергическом фоне, приводит к формированию полипозно-гнойного риносинусита. Это заболевание негативно влияет на бронхолегочную систему. Гнойный воспалительный процесс в пазухах оказывает токсическое воздействие на другие структуры организма. Отсутствие нормального носового дыхания отрицательно сказывается на состоянии бронхолегочной системы. Под влиянием гнойного воспаления снижается иммунитет и развивается дополнительная сенсибилизация организма.
К факторам, вызывающим обострение бронхиальной астмы и/или способствующим персистенции симптомов, относятся аллергены, загрязнение воздуха, респираторные инфекции, физическая нагрузка, изменения погоды, чрезмерные эмоциональные нагрузки, риносинусит и хирургическое вмешательство. Хирургическое лечение ЛОР-органов при бронхиальной астме во многих случаях усугубляет бронхолегочный процесс, что может привести к возникновению бронхоспазма во время операции и в послеоперационном периоде. В клинической практике нередки ситуации, когда простая хирургическая манипуляция у пациента с бронхиальной астмой, например пункция верхнечелюстного синуса, требует реанимационных мероприятий. Именно поэтому инвазивное лечение больных астмой следует проводить после консультации с пульмонологом. Кроме того, необходимо разрабатывать методы щадящей хирургии для предотвращения ухудшения со стороны бронхолегочной системы и по возможности сокращать число оперативных вмешательств за счет увеличения эффективности консервативного лечения.
Российские специалисты провели комплексные клинико-инструментальные и лабораторные исследования 100 больных бронхиальной астмой в сочетании с полипозным риносинуситом, находившихся на стационарном лечении в отделении болезней уха, горла и носа Городской клинической больницы им. С.П. Боткина. Методика обследования пациентов включала стандартное оториноларингологическое обследование, рентгенографию и компьютерную томографию околоносовых пазух, цитологическое исследование мазков-отпечатков со слизистой оболочки полости носа, бактериологическое исследование мазка слизистой оболочки из среднего носового прохода и верхнечелюстной пазухи, в том числе диагностику атипичной микрофлоры методом полимеразной цепной реакции, исследование функции внешнего дыхания, ринопневмоманометрию. Больные проходили аллергологическое обследование и получали консультацию пульмонолога. В большинстве своем пациенты были в возрасте 40–60 лет. Бронхиальная астма средней степени тяжести отмечалась у 53% больных, легкой – у 29%, тяжелой – у 18%. Среди патогенетических вариантов бронхиальной астмы превалировал смешанный (атопическая и инфекционно-зависимая формы). По данным эндоскопического исследования, выраженность полипозного процесса третьей степени зафиксирована почти у половины пациентов. У большинства больных бронхиальной астмой разной степени тяжести наблюдался полипозно-гнойный риносинусит, что требовало хирургического лечения.
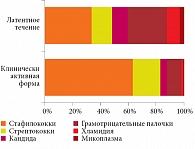
Следует отметить, что полипозно-гнойный риносинусит характеризуется не только клинически активной, но и латентной формой, и спектр возбудителей при этих двух формах различен (рис. 1).
На сегодняшний день применение интраназальных ГКС (Тафен назаль, Назонекс) признано золотым стандартом при аллергическом рините и полипозном риносинусите. По данным ряда исследований, из всех ингаляционных ГКС будесонид (Тафен назаль) имеет наиболее благоприятный терапевтический индекс, что связано с высоким сродством с ГКС-рецепторами и ускоренным метаболизмом после системной абсорбции в легких и кишечнике. Отличительными особенностями будесонида являются промежуточная липофильность, длительная задержка в ткани благодаря конъюгации с жирными кислотами и высокая активность в отношении ГКС-рецептора. Сочетание этих свойств определяет исключительно высокую эффективность и безопасность будесонида по сравнению с другими ингаляционными ГКС13. Будесонид депонируется и длительно удерживается в слизистой оболочке носа в виде эфиров жирных кислот. Последующее высвобождение из депо гарантирует пролонгированное противовоспалительное действие и высокую клиническую эффективность14.
Эфиры будесонида не адсорбируются и не попадают в системный кровоток. При длительном применении препарата (свыше пяти лет) не выявляются гистопатологические признаки повреждения носового эпителия. Даже после пяти лет использования препарата у детей в возрасте от шести лет концентрация кортизола в плазме не меняется, негативное влияние на развитие костной ткани отсутствует.
В 2010 г. в России было проведено многоцентровое открытое исследование эффективности и безопасности будесонида с участием свыше 6000 пациентов (из 14 городов) с сезонным и круглогодичным аллергическим ринитом, неаллергическим ринитом, полипозным риносинуситом, сочетанием этих нозологий15. Больным назначали будесонид в виде монотерапии и в сочетании с лоратадином. Частота побочных эффектов в разных регионах составила от 3 до 10%. Только в 0,44% случаев лечение было прекращено из-за нежелательных реакций, которые исчезали после отмены препарата и не требовали дополнительной терапии. В условиях реальной практики будесонид продемонстрировал эффективность и безопасность при широком спектре показаний.
Подводя итог, профессор А.Ю. Овчинников отметил, что лечебно-диагностический алгоритм терапии больных бронхиальной астмой, аллергическим ринитом и полипозным риносинуситом должен включать комплексное обследование с участием оториноларинголога, пульмонолога и аллерголога.
Антагонисты лейкотриеновых рецепторов: кому, когда, зачем
Лейкотриены играют важную роль в патогенезе бронхиальной астмы и аллергического ринита. При этих заболеваниях наблюдается экспрессия лейкотриеновых рецепторов на клетках гладкой мускулатуры бронхов и лейкоцитах периферической крови. Лейкотриены – одни из основных медиаторов формирования хронического воспаления дыхательных путей у больных бронхиальной астмой. Спазм гладкой мускулатуры бронхов, вызываемый цистеиниловыми лейкотриенами, в 100–1000 раз мощнее спазма, вызываемого гистамином.
Цистеиниловые лейкотриены (ЛТC4, ЛТD4, ЛТE4) участвуют в развитии бронхиальной и назальной обструкции, гиперреактивности и образовании воспалительного экссудата в дыхательных путях при бронхиальной астме благодаря основным механизмам:
- привлечению эозинофилов в дыхательные пути, сопровождающемуся повреждением эпителия и повышением бронхиальной реактивности;
- повышению проницаемости микрососудов, приводящему к экссудации плазмы в бронхиальную стенку и просвет и формированию отека;
- увеличению секреции слизи;
- возникновению выраженного бронхоспазма, обусловленного констрикторным действием лейкотриенов на гладкомышечные клетки дыхательных путей.
Кроме того, цистеиниловые лейкотриены могут способствовать гипертрофии и ремоделированию гладкой мускулатуры бронхов.
Для воздействия на разные звенья патогенеза бронхиальной астмы и аллергического ринита разработаны различные классы лекарственных препаратов. Антагонисты лейкотриеновых рецепторов – первые за последние 20 лет препараты нового класса с селективным действием. Они либо блокируют, либо тормозят синтез цистеиниловых лейкотриенов.
Механизм действия антагонистов лейкотриенов определяется точкой их приложения: антагонисты лейкотриеновых рецепторов (зафирлукаст, монтелукаст) блокируют цистеиниловые лейкотриеновые рецепторы первого типа, зилеутон тормозит 5-липоксигеназу. Эффект антагонистов рецепторов лейкотриенов выражается в уменьшении:
- привлечения эозинофилов в дыхательные пути;
- проницаемости сосудов;
- секреции слизи;
- проявлений бронхоспазма; гипертрофии и ремоделирования гладкой мускулатуры бронхов.
Как следствие, антагонисты цистеиниловых лейкотриенов оказывают противовоспалительное действие, подавляя клеточные и внеклеточные компоненты воспаления в дыхательных путях, вызываемого воздействием антигенов. Применение этих препаратов способствует снижению выраженности симптомов аллергического ринита и бронхиальной астмы в дневное и ночное время, предупреждает приступы астмы, вызванные антигенами, аспирином, физической нагрузкой и холодным воздухом.
Международный документ ARIA-2010 (Allergic Rhinitis and its Impact on Asthma – Аллергический ринит и его влияние на астму) рекомендует применять антилейкотриеновые препараты в базисной контролируемой терапии аллергического ринита любой степени тяжести наравне с H1-блокаторами и ингаляционными ГКС.
Основная цель лечения астмы – достижение и поддержание контроля над заболеванием. Антилейкотриеновые препараты успешно применяются в качестве основного средства базисной терапии при бронхиальной астме легкого течения и в сочетании с ГКС при более тяжелом течении. Одна из эффективных схем терапии бронхиальной астмы – низкие дозы ингаляционных ГКС и антилейкотриеновые препараты. Эффективность такой комбинации обусловлена тем, что данные лекарственные средства влияют на разные компоненты воспаления. Антагонисты цистеиниловых лейкотриенов блокируют синтез цистеинил-лейкотриенов, ингаляционные ГКС ингибируют стероидчувствительные провоспалительные медиаторы.
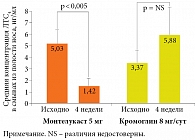
Монтелукаст – блокатор цистеиниловых лейкотриеновых рецепторов эпителия дыхательных путей – предотвращает избыточное образование секрета в бронхах, отек слизистой оболочки дыхательных путей. В исследовании B. Volovitz и соавт. показано, что монтелукаст подавляет высвобождение лейкотриенов в дыхательных путях при бронхиальной астме (рис. 2)17.
Монтелукаст – первый пероральный препарат этого класса, который можно применять у взрослых и детей с двух лет. Терапевтический эффект монтелукаста достигается после первой дозы и поддерживается на протяжении 24 часов.
В экспериментальных исследованиях монтелукаст вызывал обратное развитие резистентных к ГКС структурных изменений в рамках индуцированного аллергеном ремоделирования дыхательных путей у мышей. Монтелукаст и ГКС дексаметазон угнетали транспорт эозинофилов в дыхательные пути и метаплазии бокаловидных клеток бронхов. Однако только монтелукаст снижал ранее увеличенную массу гладкомышечных клеток стенок бронхов, экспрессию рецептора цистеиниловых лейкотриенов первого типа, субэпителиальное отложение коллагена и фиброз18.
Добавление монтелукаста к базисной терапии среднетяжелой бронхиальной астмы снижает количество обострений на 68%19.
Докладчик отметила, что на сегодняшний день актуальна проблема лечения астмы у детей раннего возраста. Постановка диагноза бронхиальной астмы у таких пациентов – задача достаточно сложная.
У детей выделяют следующие фенотипы бронхиальной астмы: вирусиндуцированную, аллергениндуцированную (атопическую), астму физического усилия и неаллергениндуцированную/неустановленную. При этом фенотипы часто сочетаются. Существенное влияние на фенотип могут оказывать сопутствующие заболевания. Вирусная инфекция – один из основных внешних факторов формирования и обострения астмы. Нельзя недооценивать и роль атипичных возбудителей – хламидийных и микоплазменных инфекций. Исходы обструкции у детей раннего возраста зависят от факторов риска развития бронхиальной астмы, частоты респираторных инфекций, генетического полиморфизма экспрессии генов.
Антагонисты лейкотриеновых рецепторов относятся к первой медиаторспецифической терапии бронхиальной астмы. В настоящее время подтверждена клиническая эффективность монтелукаста при различных формах бронхиальной астмы, в том числе у детей. Результаты исследований показали, что монтелукаст положительно влияет на все симптомы астмы у детей (кашель, свистящее и затрудненное дыхание), а также уменьшает ограничение деятельности20.
При использовании монтелукаста в течение двух дней у детей в возрасте от шести до 14 лет с бронхиальной астмой отмечалось статистически значимое уменьшение бронхоконстрикции, вызванной физической нагрузкой21.
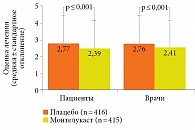
В клиническом исследовании с участием пациентов с бронхиальной астмой и сопутствующим аллергическим ринитом на фоне применения монтелукаста улучшались общая оценка симптомов аллергического ринита и качество жизни пациентов (рис. 3)22.
Профессор Т.Г. Маланичева констатировала, что препараты монтелукаста (Монтелар, Сингуляр) показаны для длительного лечения, могут применяться в монотерапии, а также в комбинации с ГКС при среднетяжелой и тяжелой бронхиальной астме.
Эффективная коррекция аллергических воспалений. Контроль глазных и назальных симптомов при аллергическом рините
По данным эпидемиологических исследований, распространенность атопии с каждым годом увеличивается на 5–6%23. Ведущее место в структуре аллергических болезней занимает аллергический ринит, характеризующийся IgE-зависимым мукозальным воспалением в ответ на контакт с аллергеном. Аллергический ринит ассоциирован с аллергическим конъюнктивитом и бронхиальной астмой.
Основные задачи лечения аллергического ринита – достижение контроля над аллергическим воспалением и индукция толерантности. Согласно последним международным документам, в частности консенсусу PRACTALL, критериями контроля аллергического ринита служат отсутствие симптомов (заложенность носа, ринорея, чихание, зуд, назальный затек), нарушений сна и дневной активности (учеба, работа, занятия в свободное время). Объективные измерения, характеризующие контроль воспаления при аллергическом рините, включают нормальные показатели назальной пиковой скорости вдоха, теста «дыхание с закрытым ртом» и тестов для оценки нормальной назальной проходимости. Для достижения контроля заболевания предусмотрена ступенчатая терапия аллергического ринита. Каждая из них предусматривает фармакологические варианты лечения в зависимости от выраженности симптомов аллергического ринита24.
Фармакотерапия аллергического ринита направлена прежде всего на эффективный контроль мукозального воспаления. Использование интраназальных ГКС, антигистаминных и антилейкотриеновых препаратов в комплексе или монотерапии на разных этапах лечения аллергического ринита позволяет контролировать симптомы заболевания и предупреждает развитие осложнений.
В ряде случаев аллергический ринит сопровождается глазной симптоматикой – зудом, покраснением и слезотечением. Глазные симптомы при аллергическом рините могут быть вызваны прямым контактом с аллергеном (IgE-зависимая аллергическая реакция) или рефлекторным механизмом (назоокулярный рефлекс)25.
По данным зарубежных исследователей, у 71,4% больных аллергическим ринитом наблюдаются одновременно и назальные, и глазные симптомы. При этом качество жизни пациентов значительно снижается26.
У 20–25% больных отмечаются аллергические конъюнктивиты. У большинства пациентов первые проявления аллергии начинаются в детстве. Второй пик заболеваемости приходится на постпубертатный период (18–35 лет).
Среди аллергических заболеваний глаз известны такие формы, как сезонный и круглогодичный аллергический конъюнктивит, весенний и атопический кератоконъюнктивит, гиганто-папиллярный конъюнктивит. Самым распространенным считается сезонный и круглогодичный аллергический конъюнктивит.
Ключевая точка аллергического ответа – тучные клетки. В конъюнктиве глаза их около 50 млн. Тучные клетки конъюнктивы играют важнейшую роль в патогенезе аллергических конъюнктивитов. Они продуцируют медиаторы воспаления на ранней и поздней фазе аллергической реакции. Основной посредник аллергического воспаления – гистамин. Он отвечает за формирование всей картины острой аллергической реакции: развитие зуда, покраснение глаз и отек конъюнктивы, появление серозно-слизистого отделяемого, обильное слезотечение.
Рациональный подход к лечению аллергического ринита с глазной симптоматикой и аллергического конъюнктивита включает элиминационные мероприятия, рациональную фармакотерапию и АСИТ. Современные препараты для лечения аллергических заболеваний должны эффективно контролировать аллергическое воспаление, устранять симптомы аллергии на продолжительное время. Обязательные требования к противоаллергическим препаратам – безопасность, отсутствие нежелательных реакций после приема, наличие доказательной базы и возможность использования в раннем детском возрасте.
К фармакологическим средствам контроля аллергического воспаления при аллергическом рините с глазной симптоматикой относят Н1-блокаторы (системные и местные), мембраностабилизирующие препараты, ГКС локального действия, препараты кромоглициевой кислоты и антилейкотриеновые препараты.
Препаратами номер один для контроля аллергического воспаления признаны антигистаминные средства, или Н1-блокаторы. Как известно, Н1-рецепторы опосредуют положительную секрецию IgE. Основной механизм действия Н1-блокаторов – конкурентное ингибирование Н1-рецепторов.
Олопатадин (Опатанол) благодаря двойному механизму действия позволяет эффективно контролировать аллергическое воспаление. Он блокирует H1-рецепторы к гистамину, обеспечивая быстрое уменьшение симптомов острого аллергического конъюнктивита, и стабилизирует мембраны тучных клеток, обеспечивая эффективность при долгосрочном контроле. Олопатадин эффективно воздействует на клинические симптомы аллергического конъюнктивита (зуд и покраснение). Сравнительные исследования клинической эффективности олопатадина гидрохлорида 0,1% и кетотифена фумарата при аллергическом конъюнктивите показали преимущество олопатадина.
Олопатадин рекомендован в качестве вспомогательного средства для контроля аллергического воспаления и уменьшения выраженной клинической симптоматики в комплексе с системными H1-блокаторами. Следует учитывать, что по клиническим показаниям необходимо ограничиться использованием только локальных лекарственных средств, без H1-блокаторов системного действия.
Заключение
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.