Самоконтроль гликемии – основа эффективного лечения сахарного диабета
- Аннотация
- Статья
- Ссылки
- English





Введение
Традиционными составляющими лечения сахарного диабета (СД) принято считать диету, таблетированные сахароснижающие препараты и инсулин. В последние десятилетия получил развитие еще один полноправный компонент лечения – обучение больных [1, 2]. Самые подробные рекомендации, полученные от врача, не могут охватить все разнообразие жизненных ситуаций, поэтому успешное лечение многих хронических заболеваний, в том числе и СД, невозможно без активного, грамотного и самостоятельного проведения лечения самими больными в амбулаторных условиях. В 1998 г. Всемирная организация здравоохранения официально признала терапевтическое обучение методом лечения хронических заболеваний [3], и в настоящее время оно стало неотъемлемой частью организации диабетологической помощи. Во многом это оказалось возможным благодаря техническому прогрессу, в частности появлению доступных средств самоконтроля обмена веществ.
Самоконтроль в широком смысле предусматривает учет больными СД, прошедшими обучение, субъективных ощущений, уровня гликемии и других показателей, а также режима питания и физической активности с целью принятия самостоятельных терапевтических решений [4]. Более корректным представляется использовать термин «самоконтроль» лишь для обозначения самоконтроля обмена веществ, то есть самостоятельного определения больными некоторых показателей в крови или моче. Используя современные методы экспресс-анализа, больные самостоятельно могут оценить уровень гликемии с точностью, близкой к лабораторной. Поскольку эти показатели определяются в повседневных, привычных больному условиях, они имеют большую ценность для коррекции терапии, чем полученные в стационаре или поликлинике.
Основное условие профилактики и лечения поздних осложнений СД – стабильное поддержание близкого к норме уровня гликемии. Но лишь немногие больные способны чувствовать перепады гликемии от 4 до 13 ммоль/л, а именно в этих пределах чаще всего оказываются показатели пациента. Кроме того, длительно декомпенсированные больные (с постоянным высоким уровнем глюкозы в крови) адаптируются к гипергликемии и чувствуют себя удовлетворительно, а снижение гликемии до нормы воспринимают на первых этапах лечения как гипогликемию. Следовательно, полагаться на субъективные ощущения пациента для оценки состояния углеводного обмена нельзя.
Высказывание одного из основоположников диабетологии Э. Джослина (США) о том, что инсулинотерапия – это потеря времени и средств, если больной не проводит самоконтроля, стало особенно актуальным после внедрения тест-полосок для экспресс-анализа гликемии. Согласно современным представлениям об эффективном лечении пациентов с СД неотъемлемой частью всех программ обучения и длительного наблюдения является регулярный самоконтроль гликемии (СКГ). Получаемые показатели используются пациентом для принятия самостоятельных решений в различных жизненных ситуациях (например, для коррекции дозы гипогликемизирующих препаратов в зависимости от характера питания, планирования двигательных нагрузок и т.д.) [5].
Терапевтические цели при сахарном диабете
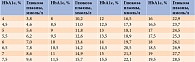
Никто не оспаривает утверждения, что содержание глюкозы в крови у больного СД должно быть максимально (насколько это возможно) приближено к норме, напротив, это основное условие профилактики и лечения осложнений СД. Но в то же время следует помнить о безопасном уровне гликемии. Именно поэтому индивидуальный подход к больному и, соответственно, определение индивидуального целевого уровня гликемического контроля должны являться основой выбора стратегии сахароснижающего лечения. Недавно завершившиеся рандомизированные исследования ACCORD [6], ADVANCE [7] и VADT [8] убедительно продемонстрировали важность выбора индивидуальных целей гликемического контроля для каждого пациента в зависимости от возраста, длительности СД, наличия сердечно-сосудистых осложнений. Целевые показатели гликемического контроля для пациентов с СД отражены во многих документах, таких как стандарты Американской диабетической ассоциации (American Diabetes Association – ADA) [9], руководство Международной диабетической федерации (International Diabetes Federation – IDF) по лечению СД 2 типа [10], российские Алгоритмы специализированной медицинской помощи больным сахарным диабетом [11]. Последние фактически являются национальными стандартами диагностики и лечения СД. В Алгоритмах даны рекомендации по индивидуализации целей лечения по уровню гликированного гемоглобина (HbA1с) в зависимости от возраста, риска развития тяжелой гипогликемии, выраженности поздних сосудистых осложнений СД, а также от ожидаемой продолжительности жизни пациентов (табл. 1).
Величина HbA1с в качестве интегрального показателя ежедневных колебаний гликемии на протяжении последних трех месяцев наиболее удобна для определения степени компенсации углеводного обмена у пациентов с СД. Определение HbA1с используется как своего рода оценка совместных усилий врача и больного, помогающая увидеть в динамике эффективность проводимого лечения. Получив результат, необходимо объяснить больному, какому среднему уровню глюкозы он соответствует (табл. 2) [11].
Однако не следует забывать, что за уровнем HbA1с стоят показатели препрандиальной (перед приемом пищи) и постпрандиальной (после приема пищи) гликемии. В связи с этим были рекомендованы следующие индивидуальные целевые значения данных показателей, соответствующие целевому HbA1c (табл. 3) [5].
Согласно Алгоритмам в связи с введением индивидуализированных целей лечения понятия «компенсация», «субкомпенсация», «декомпенсация» у взрослых пациентов не используются. После формулировки диагноза необходимо указать целевой уровень гликемического контроля [11]. Цели лечения у беременных с любым типом СД более строгие (табл. 4) [11].
В соответствии с Российским консенсусом по терапии сахарного диабета у детей и подростков [12], рекомендациями ADA [9] и Международного общества по сахарному диабету у детей и подростков (International Society for Pediatric and Adolescent Diabetes – ISPAD) [13] цели лечения данной категории пациентов зависят от возраста. При этом в российских рекомендациях остаются понятия «компенсация», «субкомпенсация» и «декомпенсация» (табл. 5) [11].
Оптимизация лечения с использованием показателя HbA1c требует понимания взаимосвязи между уровнем HbA1c, глюкозы плазмы натощак и постпрандиальной гликемией. Как показали L. Monnier и соавт., основной вклад (около 70%) в показатели HbA1c, превышающие 10,2%, вносит препрандиальная гипергликемия, а при HbA1c < 7,3% роль препрандиальной гликемии не превышает 30% [14]. Вклад пре- и постпрандиальной гликемии в итоговую величину HbA1c примерно одинаков при варьировании HbA1c от 7,3 до 8,4%. Таким образом, HbA1c может быть хорошим инструментом для формирования лечебной тактики в отношении наиболее первостепенных задач коррекции сахароснижающей терапии. Например, уровень HbA1c > 8,4% указывает на необходимость первоочередного влияния на препрандиальную гликемию, а уровень HbA1c < 7,3% – на постпрандиальную.
Частота самоконтроля гликемии
Профилактика поздних микро- и макрососудистых осложнений СД возможна только при условии длительного поддержания оптимальных показателей гликемии (соответствующих индивидуальным целям лечения) [15]. В свою очередь достижение индивидуальных целевых показателей гликемии возможно лишь путем адекватного СКГ со стороны пациента. При этом среди экспертов во всем мире до сих пор нет единого мнения, с какой частотой необходимо проводить СКГ у разных групп пациентов с СД [16]. Принято считать, что для больных СД 1 и 2 типа, получающих инсулинотерапию, достижение целей лечения прямо пропорционально зависит от частоты СКГ: чем чаще, тем лучше показатели гликемии. Так, в соответствии с Алгоритмами пациентам с СД 1 типа без осложнений рекомендовано проводить СКГ не менее 4 раз в сутки, а пациентам с СД 2 типа – в зависимости от вида принимаемого лечения и степени компенсации углеводного обмена [11] (табл. 6).
Дополнительное проведение СКГ рекомендуется в следующих случаях:
- острые заболевания, стресс;
- изменения в терапии;
- гипогликемия;
- беременность;
- ухудшение значений HbA1c;
- изменение образа жизни (необычное питание, физические нагрузки, путешествия, перемена часовых поясов и т.д.).
ISPAD дает следующие рекомендации по мониторингу показателей углеводного обмена [13]:
- пациентам, находящимся на интенсифицированной инсулинотерапии или на терапии с использованием инсулиновой помпы, рекомендуется проводить исследование гликемии от 4 до 6 раз в день;
- количество исследований может повышаться при подборе дозы инсулина у пациентов с декомпенсацией СД, при стрессах, интеркуррентных заболеваниях и физических нагрузках;
- определение кетонов в крови или моче должно проводиться при заболеваниях с лихорадкой и/или рвотой, плохом самочувствии и уровне глюкозы плазмы > 14 ммоль/л, особенно при помповой инсулинотерапии, полиурии, сонливости, болях в животе, одышке;
- частота проведения анализа на HbA1c зависит от местных условий и не должна быть реже раза в год. В идеале у маленьких детей необходимо проводить исследование 4–6 раз в год, у детей старшего возраста – 3–4 раза в год.
Значение самоконтроля гликемии
Контроль гликемии можно рассматривать с двух позиций: пациента и врача. Для пациентов цели СКГ (его смысл) различаются в зависимости от типа заболевания и вида лечения. Так, для больных СД 1 типа основная цель СКГ – расчет дозы инсулина, способной не только «распределить по тканям» содержащуюся в предстоящей еде глюкозу, но и нормализовать гликемию в случае неудовлетворительного исходного показателя (для этого рекомендовано проводить СКГ перед каждым приемом пищи). Существуют и другие цели, актуальные для пациентов с СД 1 типа:
- профилактика гипогликемии (рекомендовано дополнительно проводить СКГ перед физической нагрузкой и во время занятий, а также перед сном);
- профилактика гипергликемии (рекомендован более частый СКГ во время интеркуррентных заболеваний или травм, при сильном стрессе, в период беременности).
У пациентов с СД 2 типа цели СКГ (как и рекомендуемая частота измерений) зависят от вида получаемой терапии:
- при интенсифицированной базисно-болюсной инсулинотерапии цели проведения СКГ такие же, как и для пациентов с СД 1 типа;
- при лечении диетой и физическими нагрузками, пероральными сахароснижающими препаратами, агонистами рецепторов глюкагоноподобного пептида 1 (ГПП-1) в виде моно- или комбинированной терапии, а также при сочетании с препаратами инсулина продленного действия основной задачей СКГ считают обеспечение пациента и врача доказательствами необходимости изменения лечения или сохранения прежней терапии. Для пациентов этой группы результаты СКГ, как правило, не являются поводом для принятия немедленных решений об изменении лечения, но должны стать поводом для обращения к врачу с целью коррекции терапии.
Таким образом, частое проведение СКГ, безусловно, необходимо пациентам с СД, получающим интенсифицированную инсулинотерапию, независимо от типа заболевания как средство для принятия правильного решения в отношении дозы препарата. Правильность принятых решений в свою очередь зависит от качества обучения пациента. По результатам СКГ опытный врач может выявить и восполнить недостаток знаний больного об оптимальных способах поддержания целевых показателей гликемии в разных ситуациях.
Для врача результаты СКГ – основной источник информации для принятия решения о дальнейшем лечении СД или дополнительном обучении пациента. Результаты СКГ, проводимого регулярно по определенной схеме, представленные в удобном для понимания и интерпретации формате, позволяют понять индивидуальные закономерности изменения гликемии под действием различных факторов. Только путем анализа результатов СКГ возможно скорректировать сахароснижающую терапию, поведение пациента, его диету и другие аспекты жизни для длительного поддержания оптимальных показателей гликемии.
В 2007 г. IDF опубликовала Руководство по контролю постпрандиальной гликемии [17], которое было обновлено в 2011 г. [18]. Целью Руководства было представление данных, которые характеризуют взаимосвязь между уровнем постпрандиальной гликемии и развитием осложнений СД. На их основании были разработаны рекомендации по правильному контролю показателей постпрандиальной гликемии при СД 1 и 2 типа. Согласно Руководству СКГ в настоящее время является оптимальным методом оценки содержания глюкозы в плазме, уровень доказательности очень высокий. Однако для достижения целей гликемического контроля требуется обучение больных проведению СКГ, интерпретации полученных результатов и правильному составлению режима лечения. Кроме того, клиницисты должны обладать опытом интерпретации данных СКГ, назначать соответствующие препараты и осуществлять частое наблюдение в целях своевременной коррекции режима лечения, если это потребуется.
Технические вопросы самоконтроля гликемии
Особенности СКГ при помощи глюкометров
В настоящее время для быстрого определения гликемии применяют фотометрические и электрохимические приборы. Основными ферментами, использующимися в глюкометрах, являются глюкозооксидаза и глюкозодегидрогеназа. В фотометрических глюкометрах (Betachek, Accu-Chek Active) ферменты тест-полосок вступают в реакцию с глюкозой исследуемой крови, в результате меняется цвет тестовой зоны (пропорционально уровню гликемии). Это изменение регистрируется с помощью спектрометра. В других глюкометрах (OneTouch Ultra, OneTouch Ultra Easy, OneTouch Select, OneTouch Select Simple, OneTouch Verio Pro+, Contour TS, Accu-Chek Performa, Accu-Chek Performa Nano, IME-DC, Clever Chek, iCheck, Bionime, Сателлит Плюс, Сателлит Экспресс) используются электрохимические методы. В большинстве электрохимических систем применяется технология амперометрии, то есть измеряется сила тока, возникающая в ходе химической реакции между ферментом тестовой зоны и глюкозой крови.
Основными характеристиками работы глюкометров являются точность и воспроизводимость. Точность (правильность) прибора определяется как степень близости среднего значения, рассчитанного на основании серии результатов измерений, к принятому референсному показателю, полученному в лабораторных условиях. Показателем точности обычно является значение систематической погрешности. Следовательно, при высокой точности прибора каждое из измерений может не соответствовать референсному и разброс их может быть велик, однако среднее значение показателей максимально приближено к лабораторному. В свою очередь воспроизводимость – это степень близости друг к другу результатов измерений. В идеале значения, отражаемые прибором, должны быть и точными, и воспроизводимыми.
В 2003 г. Международная организация по стандартизации (International Organization for Standardization – ISO) предложила стандарт для систем мониторинга уровня глюкозы крови – ISO 15197 [19]. В соответствии с документом 95% результатов гликемии должны находиться в диапазоне ± 0,83 ммоль/л от результатов, полученных контрольным методом, при концентрации глюкозы крови < 4,2 ммоль/л и в диапазоне ± 20% при уровне глюкозы крови ≥ 4,2 ммоль/л. Подавляющее большинство представленных на рынке глюкометров отвечают этому требованию минимальной приемлемой точности. Однако стоит иметь в виду, что в 5% случаев регистрируемые прибором значения могут значительно выходить за обозначенные пределы, что крайне нежелательно в ситуациях, требующих частого СКГ. В 2013 г. ISO выпустила обновленную версию стандарта ISO 15197, в которую внесены следующие изменения [20]:
- в области высоких значений глюкозы крови требования к точности системы стали более строгими, а именно: 95% полученных результатов должны укладываться в диапазон ± 15% при концентрации глюкозы ≥ 5,55 ммоль/л и в диапазон ± 0,83 ммоль/л при концентрации глюкозы < 5,55 ммоль/л;
- впервые появились требования к гематокриту и интерферирующим веществам.
При оценке полученного показателя гликемии необходимо помнить, что на результат может влиять ряд факторов:
- содержание глюкозы в венозной, капиллярной и артериальной крови различно;
- концентрация глюкозы на 10–15% выше в плазме, чем в цельной крови, а подавляющее большинство глюкометров, представленных на российском рынке, откалиброваны по плазме. Именно поэтому врачам следует указывать целевые показатели глюкозы плазмы и не заставлять пациентов пересчитывать значения на цельную кровь;
- попадание на пальцы частиц глюкозы (из фруктов, сока, меда или таблеток глюкозы, например, при купировании гипогликемии) приводит к завышенному результату, поэтому перед проколом пальца необходимо вымыть руки;
- протирание пальца спиртовой салфеткой может повлиять на результат, поэтому лучше просто вымыть руки. Но если проводится дезинфекция кожи с помощью спирта (например, в медицинском учреждении), то перед проколом пальца необходимо дождаться, когда спирт испарится, или протереть палец сухой салфеткой;
- кодирование глюкометра под характеристики тест-полосок представляет определенную сложность. Значительное число пациентов допускают ошибки в установке кода тест-полосок, что может приводить к погрешности измерений уровня глюкозы крови в сторону как завышения, так и занижения показателя (в пределах от -37 до +29%) [21]. Следует отметить, что в настоящее время имеются глюкометры, не требующие установки кода (Contour TS, OneTouch Select Simple, Accu-Chek Mobile), или с заранее предусмотренным единым кодом 25 (OneTouch Select, OneTouch Ultra Easy);
- внешние условия – обычно приборы работают с приемлемой точностью на высоте до 3000 м над уровнем моря, при температуре 10–40°С и влажности 10–90%;
- гематокрит – наиболее точно большинство тест-полосок работает при гематокрите в диапазоне 30–55% [22]. При низких значениях гематокрита (анемия, применение диализа) результаты завышаются, при высоких (полицитемия, выраженная дегидратация) – занижаются;
- ацидоз может приводить к ложно заниженным результатам измерения глюкозы крови, тогда как алкалоз завышает значения глюкозы крови на глюкометре [23]. Это очень важно при диабетическом кетоацидозе, в связи с чем он является ограничением для использования практически всех глюкометров, за исключением нового госпитального глюкометра OneTouch Verio Pro+;
- гиперлипидемия – высокие концентрации холестерина (> 18 ммоль/л) и триглицеридов (> 34 ммоль/л) могут привести к занижению уровня гликемии [22];
- концентрация кислорода в крови – при хронических обструктивных заболеваниях легких (при снижении насыщения крови кислородом) отмечается завышение показателей гликемии [24], а у пациентов, получающих оксигенотерапию, уровень глюкозы в крови может оказаться заниженным;
- прием лекарственных препаратов – известен ряд лекарственных препаратов, прием которых должен учитываться при анализе данных СКГ. Влияние этих препаратов может быть разным в зависимости от используемого фермента. К ним относится аскорбиновая кислота в концентрациях, значительно превышающих физиологические, ацетаминофен, леводопа [25], лекарственные средства, содержащие другие углеводы (мальтоза, ксилоза, галактоза, икодекстрин), – растворы для перитонеального диализа, некоторые иммуноглобулины [26];
- истекший срок использования или неправильные условия хранения тест-полосок.
Стоимость аппаратов и тест-полосок для СКГ может показаться очень высокой. Однако необходимо признать, что достичь стабильной компенсации СД и проводить интенсивную инсулинотерапию возможно только при СКГ. В конечном итоге это позволит сократить затраты на госпитализацию больного и лечение осложнений, которые развиваются вследствие плохого контроля заболевания.
Получение образца крови
Для проведения СКГ прежде всего должна быть получена капля крови. Для забора крови удобно пользоваться специальным устройством (автоматической ручкой-прокалывателем), позволяющим регулировать глубину прокола и сделать его менее болезненным. Прокол лучше делать на боковых поверхностях концевой фаланги пальца, где меньше нервных окончаний. Если руки перед забором крови вымыть, нет необходимости дезинфицировать их спиртом или другим антисептиком. Примесь спирта или другой жидкости может искажать результаты исследования, кожа должна быть сухой.
Можно также использовать образцы капиллярной крови, полученные из альтернативных мест – плеча, предплечья, области большого пальца на ладони, бедра или икры ног [27]. Однако следует помнить, что капиллярная кровь из кончика пальца быстрее отражает изменения уровня глюкозы крови. В связи с этим измерение с использованием крови, полученной из альтернативных мест, рекомендуется только в стабильном состоянии (непосредственно перед приемом пищи или перед сном) и, наоборот, не рекомендуется в ближайшее время после приема пищи, когда уровень глюкозы крови быстро повышается, после введения инсулина короткого действия, когда уровень глюкозы крови может быстро снижаться, а также после физической нагрузки, во время сопутствующих заболеваний (повышенная температура тела), при гипогликемии.
Контроль гликемии в медицинских учреждениях
Применение глюкометров в медицинских учреждениях уже стало обычной практикой. Это объясняется возможностью быстрого и простого получения результата, зачастую прямо у постели больного, что значительно сокращает время на принятие решения о дальнейшем обследовании или лечении, поскольку больше не возникает задержек, связанных с транспортировкой образца крови и его подготовкой, а результаты теста оперативно становятся доступными непосредственно в месте наблюдения пациента.
Однако системы для мониторинга уровня глюкозы крови, которые подходят для персонального использования в домашних условиях, могут не отвечать требованиям для проведения тестирования в медицинском учреждении. Контаминация глюкометров кровью может способствовать распространению опасных инфекций. Так, результаты исследования свидетельствовали о передаче как минимум 20 различных гемоконтактных патогенов при использовании глюкометра для тестирования большого количества пациентов в медицинских учреждениях [28–31]. Как пациенты, так и персонал больниц подвергаются риску воздействия вирусов, передающихся с кровью, среди которых вирусы гепатита В и С, а также вирус иммунодефицита человека [30].
Данные, собранные в отношении распространенности видимой или скрытой контаминации кровью глюкометров для проведения анализа у постели больного, показали, что кровью были контаминированы в среднем 30,2% глюкометров, использовавшихся у большого количества пациентов, и 48,2% глюкометров, использовавшихся в отделениях интенсивной терапии [29].
В настоящее время существуют портативные глюкометры, специально разработанные для применения в условиях медицинских учреждений. На российском рынке это глюкометр OneTouch Verio Pro+, который сконструирован таким образом, чтобы максимально снизить риск контаминации и последующей передачи патогенных микроорганизмов. Он оснащен кнопочным инжектором тест-полоски, что минимизирует контакт с кровью. Но главное, что данный глюкометр можно дезинфицировать для минимизации риска передачи инфекции. Система позволяет анализировать уровень глюкозы в капиллярной, венозной и артериальной крови, что немаловажно для экстренной медицины. В глюкометре используется новая высокоспецифичная к глюкозе ферментная технология ФАД-ГДГ (флавин-адениндинуклеотид-глюкозодегидрогеназа), и проведенные исследования показали соответствие точности прибора требованиям ISO 15197 (2013 г.). Кроме того, глюкометр OneTouch Verio Pro+ учитывает влияние 57 наиболее часто встречающихся экзогенных и эндогенных веществ (интерферентов), таких как креатинин, молочная кислота, липиды, холестерин, мальтоза, галактоза, ксилоза и многие лекарственные вещества. Новая технология позволяет нивелировать влияние кислорода на результат, благодаря чему глюкометр можно использовать в условиях оксигенотерапии.
Дневник самоконтроля
Существуют различные способы учета и последующей оценки результатов СКГ, но основным является дневник самоконтроля, применяемый повсеместно. Для пациента он служит базисом для самостоятельного лечения и его последующего обсуждения с врачом. Определяя уровень глюкозы в разное время в течение суток, больной сам может менять дозы сахароснижающих препаратов или корректировать питание, добиваясь приемлемых значений глюкозы, позволяющих предотвратить развитие тяжелых осложнений.
Несмотря на простоту, значение такого способа учета результатов неоднозначно. Ведение дневника самоконтроля позволяет решить следующие задачи:
1) накопить данные о колебаниях гликемии в зависимости:
- от времени суток;
- приемов пищи, ее объема и состава;
- лечения (дозы сахароснижающих препаратов);
- физической активности и др.;
2) собрать данные о гликемии, рационе питания (в том числе количестве углеводов), дозах сахароснижающих препаратов, физической активности и других значимых для лечения СД событиях в удобной для понимания форме;
3) оценить частоту угрожающих здоровью и жизни пациентов событий, связанных с лечением СД, таких как гипогликемия, выраженная гипергликемия, кетоз и др.;
4) оценить действия, предпринимаемые пациентом для поддержания оптимальных показателей углеводного обмена.
У пациента с СД 1 типа в структуре дневника самоконтроля предусматривается несколько обязательных разделов: «Значения глюкозы крови», «Дозы вводимого инсулина», «Количество хлебных единиц» (углеводов пищи). В графе «Примечания» могут быть отражены эпизоды гипогликемии, сопутствующие заболевания, физическая активность, наличие кетоновых тел, уровень артериального давления и т.д. В дневнике больного СД 2 типа, не получающего инсулина, соответственно имеется графа «Сахароснижающие препараты», а графа «Хлебные единицы» отсутствует, кроме того, должна быть предусмотрена возможность периодической регистрации массы тела. При каждом посещении врача пациенту следует показывать дневник самоконтроля и обсуждать возникающие проблемы.
Эффективность самоконтроля гликемии
Эффективность СКГ можно оценить по суррогатным параметрам (например, по влиянию результатов СКГ на принятие решения об изменении лечения) или конечным точкам (степень улучшения показателей под влиянием того или иного режима СКГ). Самым крупным исследованием, посвященным изучению влияния контроля СД, в том числе СКГ, на частоту и степень тяжести поздних осложнений, явилось многоцентровое исследование по контролю сахарного диабета и его осложнений DCCT [32], которое проводилось с 1982 по 1993 г. в 29 диабетологических центрах США и Канады. В исследовании участвовал 1441 больной СД 1 типа. Пациенты были разделены на две группы. Одним пациентам назначалась традиционная инсулинотерапия, а другим – интенсивная. Цель традиционной терапии – клиническая компенсация: отсутствие симптомов гипергликемии, кетонурии, частых и тяжелых гипогликемий. Достигалось это за счет одной или двух инъекций инсулина, не очень частого СКГ, обучения принципам диеты. Больные, как правило, не проводили ежедневной самостоятельной коррекции доз инсулина, обследование делали один раз в три месяца. При интенсивной терапии преследовались те же клинические цели, а также поддержание гликемии, максимально приближенной к норме. Интенсивная терапия предусматривала режим многократных инъекций инсулина (3 раза в день и более) или использование носимого дозатора инсулина (помпы), частый СКГ (4 раза в день и чаще) и обучение больных принципам самостоятельной коррекции доз инсулина. Пациенты посещали свой центр ежемесячно. Кроме того, осуществлялся регулярный контакт с врачом по телефону. На протяжении всего исследования показатель HbA1c в группе интенсивного лечения поддерживался на уровне, близком к 7%, тогда как в группе традиционной инсулинотерапии он был около 9% (то есть таким же, как исходный). Было показано, что развитие и прогрессирование диабетической ретинопатии в группе интенсивной терапии снизилось почти на 60%, тяжелой непролиферативной и пролиферативной ее форм, требующих лазеркоагуляции, – наполовину. В результате интенсивной терапии на 34–56% уменьшилась частота диабетической нефропатии, оцениваемой по экскреции белка с мочой, а также статистически достоверно частота клинической нейропатии (на 60%) и макрососудистых осложнений (на 41%).
В настоящее время большинство исследований доказали эффективность программ обучения больных и СКГ по ряду клинических, метаболических и медико-социальных параметров [2, 33, 34]. Проведены и отечественные исследования по длительному наблюдению больных после обучения, в которых оценивались динамика различных показателей, а также частота развития поздних осложнений СД 1 типа [35]. Так, с 1990 по 2005 г. в Эндокринологическом научном центре наблюдали группу больных СД 1 типа после программы лечения и обучения с целью поиска и оценки факторов, определяющих возможность поддержания компенсации углеводного обмена на долгосрочной основе. Наиболее интересной представляется оценка эффективности длительного наблюдения больных СД 1 типа по параметрам поведения, связанного с заболеванием. Она проводилась по следующим показателям: наличие дневника самоконтроля с записями, частота СКГ (число измерений за последние четыре недели, частота самостоятельного изменения дозы инсулина). До обучения ни один больной не вел дневник самоконтроля, а уже через год после обучения 68% пациентов имели такие дневники с записями результатов СКГ, количества хлебных единиц, дозы инсулина и других необходимых показателей (НbА1с, эпизоды гипогликемии и т.д.). Через 7 и 15 лет после программы обучения количество таких пациентов уменьшилось и составило 33 и 29% соответственно. У больных, ведущих дневник самоконтроля, HbA1с был достоверно ниже (8,3 ± 1,5%), чем у пациентов без дневника (9,4 ± 1,9%, p < 0,01). Следует отметить, что в группе интенсивного наблюдения количество больных, ведущих дневник, было достоверно больше (42 и 22% соответственно, p < 0,05). Если через год после обучения около 60% больных выполняли СКГ более 2 раз в сутки ежедневно, то через 15 лет их число составило 43%. У этих больных наблюдался значительно более низкий уровень НbА1с (8,4 ± 1,9%), чем у пациентов, проводивших измерения менее 2 раз в сутки (9,7 ± 1,8%, p < 0,01). Была установлена отрицательная корреляционная связь уровня НbА1с с частотой самостоятельных измерений гликемии (r = -0,489, p < 0,001).
Таким образом, проведение СКГ с достаточной частотой в сочетании с коррекцией доз инсулина соответственно этим показателям является важным аспектом для поддержания компенсации углеводного обмена. Были также установлены различия в частоте СКГ по группам. Данный показатель в группе больных с интенсивным длительным наблюдением был достоверно выше и составил в среднем 26,1 ± 17,7 раза в неделю по сравнению с группой традиционного наблюдения – 10,3 ± 9,5 раза в неделю (p < 0,001). Кроме того, выявлены статистически значимые различия между группами в отношении количества пациентов, проводивших регулярный (более 2 раз в день) СКГ: 79% – при интенсивном наблюдении, в то время как в группе традиционного наблюдения – 27% (p < 0,01). Следовательно, необходимым компонентом в организации интенсивного длительного наблюдения является оценка качества проведения СКГ, включающая достаточную частоту измерений, изменение доз инсулина в зависимости от данных показателей и заполнение дневника самоконтроля.
Новые методы самоконтроля гликемии
В некоторых случаях, когда требуется очень частое определение уровня глюкозы крови (например, подозрение на гипогликемию), может быть установлено устройство, которое будет измерять глюкозу постоянно. Непрерывное мониторирование гликемии – относительно новая технология наблюдения за больными СД [36]. Для этого в подкожный жир вводится сенсор, который измеряет уровень глюкозы и передает эти данные в устройство для хранения. Сенсор может работать в течение трех – пяти дней. Он определяет глюкозу в тканевой жидкости и переводит эти значения в значения глюкозы крови (для этого необходимо несколько раз в день вносить в данное устройство результаты измерений, сделанных на обычном глюкометре). К СКГ можно отнести только мониторирование в режиме реального времени, когда пациент видит на экране свой уровень глюкозы, что помогает предотвратить наступление гипо- или гипергликемии. Все используемые в настоящее время устройства показывают подробный график изменений гликемии во времени, подают сигналы тревоги о выходе гликемии за пределы индивидуальных целевых показателей, а также обладают другими функциями. Пока эти устройства достаточно дороги и имеют ряд технических недостатков, но со временем могут появиться и простые неинвазивные методы СКГ.
Некоторые аспекты качества медицинских изделий
С момента открытия инсулина в 1921 г. различные медицинские изделия стали широко использоваться в лечении диабета и выявлении его осложнений, например инсулиновые шприцы и шприц-ручки, офтальмоскопы, устройства для оценки периферической нервной системы. За последние 40 лет произошел переворот в области медицинских изделий, ознаменованный началом использования устройств для мониторинга глюкозы крови в домашних условиях [37] и постепенным внедрением инсулиновых помп [38]. Сегодня применение индивидуальных и профессиональных глюкометров стало обычной практикой. Использование инсулиновых помп растет во многих странах и является средством выбора лечения молодых пациентов с СД 1 типа. Одной из последних инновационных разработок в диабетологии являются системы непрерывного мониторинга глюкозы крови, которые, работая в режиме реального времени, помогают улучшать не только гликемический контроль, но и качество жизни пациентов.
На фоне масштабного применения медицинских изделий повышается вероятность ошибок их использования (человеческий фактор или недостатки изделия) [39]. Так, с 2004 по 2008 г. в США зарегистрировано 12 672 обращения в Управление по надзору за качеством пищевых продуктов и лекарственных средств (Food and Drug Administration – FDA) по поводу серьезных нежелательных явлений (гипогликемии, гипергликемии, госпитализации, неправильного медикаментозного лечения и др.), ассоциированных с функциональными ошибками глюкометров. В период 1997–2009 гг. зарегистрировано 100 летальных исходов, 13 из которых были связаны с использованием систем с PQQ-зависимой глюкозодегидрогеназой: измерение уровня глюкозы крови у пациентов, принимавших препараты с «неглюкозными» сахарами, давало ложно завышенные результаты и влекло неправильный расчет вводимой дозы инсулина, приводящий к тяжелой гипогликемии и коме [40]. Необходимо отметить, что в настоящее время данный фермент не используется в системах контроля уровня глюкозы крови. В нашей стране регистрация неблагоприятных последствий применения медицинских изделий не ведется, что сопряжено с угрозой для здоровья пациентов.
Европейская ассоциация по изучению сахарного диабета (European Association for the Study of Diabetes – EASD) (2013 г.) считает, что подобные проблемы могут быть связаны с недостатками действующей системы регистрации медицинских изделий, а именно отсутствием обязательного пострегистрационного надзора [41]. Пострегистрационный (или постмаркетинговый) надзор представляет собой непрерывный надзор за побочными реакциями после применения лекарственных средств/использования изделий медицинского назначения и другими неблагоприятными для здоровья явлениями с целью обнаружения потенциальных проблем безопасности выпускаемых лекарственных средств/медицинских изделий. Такой надзор, в частности, обеспечивается усилиями производителей и независимых институтов в результате проведения пострегистрационных клинических исследований безопасности продукта. В США и Европе пострегистрационный надзор является обязательным для лекарственных средств, в России нет. В то же время в отношении медицинских изделий и в Европе, и в России процедура пострегистрационного надзора отсутствует, в отличие от США. Не проводится сбор необходимых данных об инсулиновых помпах, инсулиновых шприцах и шприц-ручках, глюкометрах и т.д., поэтому редко удается выявить потенциальные неисправности или дефекты этих медицинских изделий. Данным вопросом серьезно озаботились в Европе представители медицинского сообщества и индустрии, общественные и профессиональные организации, и, очевидно, в скором времени соответствующие структуры Европейского союза ждет реформирование, результатом которого будет внедрение пострегистрационного надзора за рынком изделий медицинского назначения [41].
В связи с тем что в нашей стране подобных изменений не предвидится, клиницистам стоит действовать проактивно и обращать внимание на наличие пострегистрационных клинических исследований, проводимых независимыми институтами или производителями. Подобные исследования проводятся для глюкометров (OneTouch Select, OneTouch UltraEasy, Accu-Check Performa Nano, Accu-Chek Active и др.), инсулиновых помп (Minimed, OneTouch Ping и др.).
Заключение
Учитывая, что СД является хроническим заболеванием, которое требует длительного амбулаторного наблюдения за больными, его эффективная терапия на современном уровне предусматривает обязательное проведение СКГ. Оптимальный способ СКГ следует подбирать для каждого пациента в зависимости от получаемой сахароснижающей терапии и других факторов. Необходимо помнить, что сам по себе СКГ не улучшает компенсации, это происходит лишь в том случае, если обученный пациент использует его результаты как отправную точку для принятия правильных решений в отношении значимых для лечения СД событий (питание, физическая активность, доза сахароснижающих препаратов и др.). Именно в этом случае СКГ будет оказывать наиболее значимое влияние на результаты лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.