Симптомы диспепсии и их динамика после эрадикации H. pylori. Итоги образовательно-исследовательского проекта «Реальная клиническая практика лечения кислотозависимых заболеваний»
- Аннотация
- Статья
- Ссылки
- English






Helicobacter pylori (H. pylori) – одна из самых распространенных инфекций в мире, доминирующий этиологический фактор атрофического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, аденокарциномы и экстранодальной В-клеточной MALT-лимфомы желудка [1]. Несмотря на то что инфекция H. pylori у всех инфицированных индивидуумов вызывает воспалительные изменения в слизистой оболочке желудка [2], она часто не имеет клинических проявлений.
До недавнего времени полагали, что хронический гастрит, вызванный инфекцией H. pylori, не является причиной возникновения диспепсических симптомов, однако в последние годы эта точка зрения претерпела существенные изменения. Киотский консенсус выделил отдельную форму заболевания – «диспепсия, ассоциированная с инфекцией Н. pylori», что нашло свое отражение и в рекомендациях «Маастрихт V» [1, 2].
Известно, что инфекция H. pylori может замедлять эвакуаторную функцию желудка за счет инактивации фазы III мигрирующего моторного комплекса [3], а также изменять выработку желудочной кислоты, влияя на секрецию гастрина и соматостатина [4]. Кислотное воздействие на двенадцатиперстную кишку вызывает воспаление слизистой оболочки низкой степени активности, повышение ее проницаемости, нарушение антродуоденальной координации, следствием чего являются замедление опорожнения желудка и возникновение чувства переполнения в эпигастральной области, вздутие живота и боль в эпигастрии [5]. Помимо этого, инфекция изменяет продукцию грелина, который участвует в секреции кислоты, формировании пищевого поведения и регуляции перистальтики [6].
Основным доказательством роли H. pylori в формировании симптомов диспепсии являются данные клинических исследований, демонстрирующих купирование симптоматики после эрадикации микроорганизма. В Кокрановском метаанализе, включавшем 3566 человек, было показано исчезновение симптомов диспепсии после проведения антихеликобактерной терапии, при этом снижение относительного риска составило 10% (95% доверительный интервал (ДИ) 6–14), а число больных, которых необходимо пролечить, чтобы достичь благоприятного исхода (NNT) – 14 (95% ДИ 10–25). При этом нивелирование симптоматики в конечном счете происходит почти в 40% случаев успешно эрадицированных больных [7].
Тем не менее исследования по влиянию эрадикации на купирование диспепсии показывают противоречивые результаты и продолжаются до настоящего времени [8]. Одной из причин гетерогенности результатов являются различия в уровне инфицированности, обусловленные популяцией и региональными особенностями. Так, подгрупповая оценка работ из азиатского региона в метаанализе S.J. Kang и соавт. (2019), включающем 18 РКИ, не показала статистически значимого воздействия эрадикации на диспепсию у пациентов в восточных странах [9].
В рамках образовательно-исследовательского проекта «Реальная клиническая практика лечения кислотозависимых заболеваний» нами была проведена оценка характера и выраженности клинических проявлений H. pylori-ассоциированной патологии и влияния эрадикации на динамику симптомов у пациентов Европейской части России.
Материал и методы
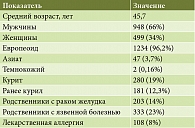
В анализ были включены 1474 пациента в возрасте от 18 до 87 лет (средний возраст – 45,7 года) с подтвержденной инфекцией H. pylori, наблюдавшиеся амбулаторно у 188 врачей Москвы, Московской области и Санкт-Петербурга.
Согласно дизайну исследования, пациенты трижды получали консультации гастроэнтеролога с интервалом в четыре недели. При включении в исследование оценивали жалобы пациентов, анамнез, демографические характеристики, статус курения, наследственность, предшествующую фармакотерапию, выполняли общеклиническое обследование.
Каждый визит предполагал балльную оценку пациентами тяжести своего состояния, а также наличие и выраженность симптомов и их динамики с помощью Опросника «7×7» (семь симптомов за семь дней). В зависимости от полученной суммы баллов тяжесть состояния пациента оценивали следующим образом [10]:
- 0–1 – здоров, нет расстройства;
- 2–6 – пограничное расстройство;
- 7–12 – легкое расстройство;
- 13–18 – умеренно выраженное расстройство;
- 19–24 – выраженное расстройство;
- 25 и более – тяжелое расстройство.
Анализировали данные о нежелательных реакциях. Приверженность лечению изучалась путем заполнения теста Мориски – Грина. Все полученные данные регистрировали в истории болезни в электронном виде.
Диагностику инфекции H. pylori и последующий контроль эрадикации осуществляли с помощью доступных в реальной клинической практике различных инвазивных и неинвазивных методик. До проведения оценки эффективности эрадикации выдерживали минимальный четырехнедельный интервал после окончания курса антибактериальной терапии.
Результаты
Общая клиническая характеристика пациентов (n = 1474) представлена в табл. 1. Исследуемая группа была представлена в основном мужчинами европеоидной расы среднего возраста. Преобладали больные с хроническим гастритом (48,6%), функциональной диспепсией (18,8%), язвенной болезнью (20,6%). В 16,2% случаев врачами не была указана нозологическая форма. В единичных случаях (0,5%) показанием к эрадикации были сочетанные формы заболеваний (функциональная диспепсия и гастрит).
Среди потенциальных факторов риска возникновения диспепсии и эффективности эрадикации было оценено курение: 19% пациентов были активными курильщиками, 12,3% курили ранее. Также была проанализирована отягощенная наследственность: в 14% случаев в анализируемой группе пациенты указали наличие родственников, больных раком желудка, в 23% – язвенной болезнью.
На первом визите, согласно Опроснику «7×7», большинство H. pylori-позитивных больных оценивали тяжесть своего состояния как легкое и умеренно выраженное расстройство (рис. 1). Средняя сумма баллов при включении в исследование составила 12,5 (минимум 0 баллов, максимум 35 баллов), жалобы не предъявляли 78 человек (5,4%).
Через две и шесть недель после завершения эрадикации количество больных без симптомов выросло соответственно до 29,2 и 65,6%, а доля пациентов с пограничным состоянием составила 48,7 и 28,4%, что свидетельствует о выраженном положительном эффекте проведенной эрадикации на самочувствие пациентов. Средняя сумма баллов по шкале диспепсии Опросника «7×7» для второго визита была 4,5 (минимум 0 баллов, максимум 23 балла), что соответствует понятию «пограничное расстройство». На третьем визите состояние большинства пациентов было оценено как «нет расстройства» (среднее значение 1,7 балла; с диапазоном от 0 до 17 баллов).
К третьему визиту ни один из пациентов не указывал на наличие выраженного и тяжелого расстройства. При сохранении симптомов ко второму визиту подавляющее большинство из них было расценено как легкое расстройство (18,2%), умеренно выраженные жалобы были зафиксированы у 42 пациентов (3,1%), выраженное расстройство – у трех человек.
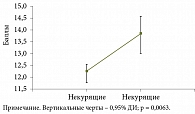
Не была выявлена корреляция жалоб с возрастом и расовой принадлежностью H. pylori-позитивных пациентов. В то же время дисперсионный анализ показал наличие достоверной связи курения и выраженности диспепсических проявлений у пациентов с инфекцией H. pylori (рис. 2).
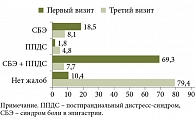
До лечения подавляющее большинство больных (69,3%) беспокоили симптомы, характерные для смешанной формы диспепсии (рис. 3). Боль и/или жжение в эпигастрии отмечали 18,5%, на чувство переполнения в области желудка и/или раннее насыщение указали только 1,8% опрошенных, жалобы отсутствовали у 10,4% H. pylori-положительных пациентов. В большинстве случаев больные указывали на минимальную или умеренную степень тяжести симптомов.
После проведения эрадикации характер жалоб изменился. У большей части пациентов (79,4%) симптомы диспепсии были полностью купированы, 7,7% больных одновременно беспокоили боли в эпигастрии и симптомы постпрандиального дистресс-синдрома, изолированный болевой синдром был зафиксирован в 8,1% наблюдений. По сравнению с первым визитом обращал на себя внимание более чем двукратный рост доли пациентов, испытывающих постпрандиальные жалобы (4,8% vs 1,8%).
В случае успешной эрадикации выраженность жалоб к третьему визиту была достоверно ниже (табл. 2).
Анализ используемых схем эрадикации показал, что чаще всего в качестве терапии первой линии в Москве и Санкт-Петербурге используются схемы, содержащие четыре компонента: классическая квадротерапия (40,1%) и тройная терапия, усиленная висмутом (31,6%). Классическую тройную терапию применяли только у одного из пяти пациентов (18,9%), у 7,4% использовали гибридную терапию без препаратов висмута, в 1% случаев врачи назначали последовательную терапию без препаратов висмута или монотерапию H. pylori пробиотиком с лизатами Lactobacillus reuteri.
В преобладающем большинстве случаев (84,3%) в качестве ингибитора протонной помпы (ИПП) в схемах эрадикации назначали рабепразол, при этом 96,3% врачей отдали предпочтение оригинальному препарату Париет®.
Выбор данного ИПП был обусловлен его приоритетным местом в национальных и международных клинических протоколах эрадикационной терапии [1, 11, 12]. Париет® (рабепразол) отличается от других ИПП минимальной зависимостью от фенотипически детерминированных вариантов печеночного метаболизма, давая более предсказуемый антисекреторный эффект, так как он, в отличие от других ИПП, метаболизируется преимущественно в результате неферментативного процесса [12]. На выбор препарата Париет® (рабепразола) влияли и его плейотропные эффекты: способность снижать двигательную активность H. pylori, переводить ее в вегетативную форму, увеличивая доступность и чувствительность бактерии к антибиотикам [13], а также способность препарата Париет® стимулировать секрецию муцинов, обладающих антихеликобактерной активностью [14, 15]. Стоить отметить, что данный эффект был отмечен только у рабепразола и отсутствовал или был существенно менее выражен у других ИПП [16].
Вне зависимости от назначенных схем антибактериальной терапии у пациентов было отмечено значительное уменьшение симптомов диспепсии (рис. 4).
Как минимум одно нежелательное явление (НЯ) было отмечено у 24,9% пациентов, участвующих в исследовании (табл. 3). Зафиксировано девять типов различных побочных реакций терапии, из которых наиболее частыми были диарея (7,6%), общее недомогание (5,5%), боль в животе (2,1%) и головная боль (1,9%); большинство из них (79,7%) были легкими. Средняя общая продолжительность НЯ составила 5,3 ± 3,1 дня, длительность – от одного до 20 дней.
Наибольшая частота НЯ наблюдалась при классической квадротерапии с висмутом, содержащей ИПП, соли висмута, метронидазол и тетрациклин (54,4%), а также при классической тройной терапии, усиленной висмутом (28%). Классическая тройная терапия способствовала возникновению НЯ в 13,8% случаев, гибридная и последовательная терапия – в 2,1 и 1,7% соответственно. При монотерапии пробиотиком с лизатами бактерии Lactobacillus reuteri у пациентов не были отмечены побочные эффекты (табл. 4).
Вне зависимости от назначенной схемы самым частым НЯ была диарея. Амоксициллин в двойных схемах или при применении в составе комбинированных схем был самой частой причиной антибиотик-ассоциированной диареи (94,9% от всех пациентов с диареей). Наиболее частая комбинация, приводящая к послаблению стула, – совместное применение амоксициллина и кларитромицина (81,8%). Реже всего диарея возникала на фоне приема левофлоксацина (5,1%) и тетрациклина (2,0%). Частота возникновения антибиотик-ассоциированной диареи в зависимости от вида антибиотика и его комбинаций с другими антибактериальными средствами представлена в табл. 5.
Серьезные НЯ (аллергия, крапивница, токсико-аллергический дерматит, артралгия и диарея) возникли у девяти пациентов. Досрочно прекратили лечение из-за побочных реакций 15 человек.
Приверженность лечению оценивали с помощью теста Мориски – Грина на втором визите. Из 1347 пациентов, прошедших тест, приверженными оказались 71,6%, недостаточно приверженными – 17,7%, отсутствие комплаенса отмечено у 10,7%.
Обсуждение
С момента открытия H. pylori Уорреном и Маршаллом в 1983 г. знания о распространенности и клиническом значении данной инфекции значительно расширились. Инфекция H. pylori поражает миллионы людей во всем мире и рассматривается как один из причинных факторов диспепсии [17].
Одним из подтверждений причинно-следственной связи является тот факт, что острая ятрогенная инфекция или самозаражение приводит к возникновению острых симптомов диспепсии [18, 19], хотя эти симптомы являются транзиторными у большинства пациентов [19, 20].
Несмотря на то что ожидаемая продолжительность жизни больных с диспепсией не сокращается [21], данное состояние оказывает существенное влияние на качество жизни пациентов, увеличивает прямые медицинские расходы и косвенные затраты из-за отсутствия на рабочем месте или более низкой производительности труда, а также оказывает влияние на семейные отношения [22], что обусловливает постоянный поиск наиболее эффективных подходов к терапии.
Эрадикация H. pylori служит терапией первого выбора у H. pylori-позитивных больных с синдромом диспепсии [1, 2, 5, 23].
Ряд исследований говорит об отсроченной перспективе контроля симптомов диспепсии после эрадикации, когда клиническое улучшение наблюдается только через 6–12 месяцев после успешно проведенной терапии [2, 9]. В то же время облегчение симптомов диспепсии через три месяца после успешной эрадикации H. pylori рассматривается как положительный прогностический фактор стойкого купирования симптомов диспепсии через один год [24]. В последнее время публикуются работы, свидетельствующие о возможности гораздо более ранней оценки эффекта эрадикации на течение диспепсии. Так, в работе M. Tsuda и соавт. (2020) с помощью специального опросника определили примерно у 60% больных с диспепсией, инфицированных H. pylori, в течение одного месяца после эрадикации, были ли симптомы диспепсии связаны с этой инфекцией (чувствительность – 64,3%, специфичность – 56,3%) [25].
В нашем исследовании пациенты находились под наблюдением врача в течение двух месяцев. Через две недели после завершения эрадикации у большей части больных наблюдалось облегчение симптоматики с полным разрешением симптомов у 65,6% пациентов к восьмой неделе исследования, что говорит о высокой способности эрадикационной терапии купировать диспепсические симптомы.
Точные механизмы, приводящие к разрешению симптомов диспепсии у части пациентов после эрадикации, до конца не известны. Но необходимо принимать во внимание, что симптоматическое улучшение после антибиотикотерапии может быть связано в том числе и с воздействием антибактериальных препаратов на микробиоту, отличную от инфекции H. pylori, поскольку эрадикационная терапия никогда не применялась в группе пациентов с негативным хеликобактерным статусом [26].
Хотя большинство H. pylori-позитивных больных, включенных в наше исследование, оценивали свое состояние как легкое и умеренно выраженное расстройство, в дисперсионном анализе была показана достоверная связь курения и выраженности диспепсических проявлений. С учетом данных о двукратном повышении риска диспепсии у курильщиков [27] и нормализации двигательной функции желудка при прекращении курения [28], у всех H. pylori-позитивных пациентов с симптомами диспепсии отказ от курения должен рассматриваться как обязательная рекомендация при лечении.
Нами не была выявлена корреляция жалоб с возрастом и расовой принадлежностью H. pylori-позитивных пациентов, что связано с небольшой долей азиатов (3,7%). При этом опубликованные исследования свидетельствуют об отличиях в клиническом ответе на эрадикацию в азиатской и европейской популяциях [9, 29]. Мы не проводили оценку влияния пола и массы тела на эффективность эрадикации в купировании симптомов диспепсии, но в литературе есть данные о том, что мужской пол и избыточная масса тела – факторы, связанные с лучшим клиническим ответом [30].
В нашем исследовании у подавляющего большинства больных (69,3%) были выявлены жалобы, характерные для смешанной формы диспепсии. Изолированный вариант синдрома боли в эпигастрии (СБЭ) и постпрандиального дистресс-синдрома (ППДС) был отмечен у 18,5 и 1,8% опрошенных соответственно. После лечения у большей части пациентов диспепсические жалобы были полностью купированы (79,4%), но обращал на себя внимание более чем двукратный рост относительного числа пациентов, испытывающих постпрандиальные жалобы (4,8% vs 1,8%). Возможно, это связано с возникновением у части пациентов жалоб de novo, не как отражение отсутствия эффекта от проводимой терапии или ухудшения течения заболевания, а как НЯ эрадикационной терапии.
Сложно оценить совпадение наших результатов с имеющимися литературными данными, так как эпидемиологические исследования, оценивающие распространенность отдельных субтипов диспепсии и ее сочетанных форм, продемонстрировали конфликтные результаты с превалированием в популяции или СБЭ, или ППДС, в зависимости от региона, выбора субъектов исследования (амбулаторные пациенты или население в целом) и дизайна работы [31].
Некоторые исследования, оценивавшие эффект эрадикационной терапии на отдельные симптомы диспепсии, показали значительное ее влияние на боль и жжение в эпигастрии, но не на ощущение раннего насыщения или постпрандиальную тяжесть в желудке. Был сделан вывод, что пациенты с СБЭ могут получить больше пользы от эрадикационной терапии [32]. Напротив, Y.J. Fang и соавт. (2015) обнаружили, что H. pylori ассоциирован с изолированным вариантом ППДС (отношение шансов (ОШ) 1,86; 99,5% ДИ 1,01–3,45), но не с «чистым» СБЭ (ОШ 1,43; 99,5% ДИ 0,72–2,84) или сочетанной формой расстройства (ОШ 1,12; 99,5% ДИ 0,55–2,28). Авторы предположили, что это может быть связано с более высокой распространенностью положительных штаммов CagA при ППДС и опосредовано выраженностью воспаления в антральном отделе желудка [33].
Вопрос о более эффективной схеме для купирования симптомов диспепсии при эрадикации до настоящего времени не решен. Имеющиеся работы свидетельствуют о том, что последовательная терапия не имеет преимуществ по сравнению со стандартной тройной терапией как в отношении облегчения симптомов, так и в отношении показателей эффективности эрадикации [34]. Также неизвестно, полезно ли добавление субсалицилата висмута для ослабления симптомов диспепсии.
В нашей работе вне зависимости от назначенных схем антибактериальной терапии у пациентов отмечалось значительное уменьшение симптомов диспепсии. Две схемы (гибридная и последовательная) характеризовались наименьшим процентом больных с сохраняющимися проявлениями диспепсии после эрадикации. Однако мы не склонны делать вывод о преимуществе данных схем, так как в нашей предыдущей работе было показано, что наблюдается крайне широкая вариабельность понимания врачами Санкт-Петербурга и Москвы понятия «гибридная схема» и других, не так часто используемых в клинической практике схем. Так, было выявлено, что любая схема терапии, подразумевающая изменение в режиме приема антибиотиков или их неклассическом сочетании, являлась основанием для указания термина «гибридная» в заполняемых электронных историях болезни [35].
В ряде работ отмечено, что наиболее эффективный режим эрадикации H. pylori при диспепсии для облегчения симптомов – это режим лечения на основе метронидазола. Применение метронидазола имеет преимущества также при overlap-синдроме H. pylori-ассоциированной диспепсии с синдромом избыточного бактериального роста или дисбактериозом [36].
Современные схемы эрадикационной терапии хорошо переносятся и, как правило, вызывают побочные эффекты минимальной степени выраженности и чаще всего только во время лечения. В проведенной нами работе о НЯ сообщили 24,9% пациентов, большинство побочных реакций (79,7%) были минимальной степени выраженности со средней продолжительностью 5,3 ± 3,1 дня. Наиболее часто пациенты жаловались на диарею (7,6%), общее недомогание (5,5%) и боль в животе (2,1%), что соответствует характеру жалоб у пациентов, оцененных в рамках Европейского регистра ведения инфекции H. pylori (Hp-EuReg) и описанных в Кокрановском обзоре [37, 38].
Наличие побочных эффектов привело к отмене терапии у 1% пациентов, что говорит о хорошей переносимости схем и отсутствии значимого влияния побочных эффектов на соблюдение режима лечения.
Экономический анализ показывает, что эрадикация H. pylori может быть наиболее экономически эффективным подходом у пациентов с диспепсией, если распространенность инфекции H. pylori в популяции составляет > 5% [39]. Стратегия «test and treat» и эрадикация у пациентов с диспепсией оказалась более рентабельной, чем экстренная эндоскопия [40], а эрадикация H. pylori оказалась более рентабельным подходом для инфицированных пациентов с диспепсией по сравнению с альтернативными подходами, подразумевающими длительное лечение [41].
В странах, где эндоскопия технически и материально доступна, ее проведение считается более эффективной мерой, чем эмпирическое лечение диспепсии, поскольку исключение органических заболеваний с помощью эндоскопии успокаивает и, следовательно, приводит к большей удовлетворенности пациентов [22]. В нашем исследовании эндоскопическая оценка была проведена у подавляющего большинства пациентов до терапии и в 36,9% случаев после эрадикации. Такой подход характерен для Российской Федерации [42, 43] и позволяет исключить онкологическую патологию, что, по всей видимости, способствует снижению уровня тревожности и стресса и является одним из факторов, настраивающих пациента на более эффективное лечение. Кроме того, P. Moayyedi и соавт. [7] предположили определенную роль плацебо-эффекта при лечении пациентов с симптомами диспепсии.
Заключение
Наша работа показала, что частота встречаемости H. pylori-ассоциированной диспепсии значительно выше, чем считалось ранее. У 79,4% пациентов с инфекцией H. pylori произошло полное купирование жалоб через шесть недель после проведения эрадикационной терапии. Современные схемы эрадикации хорошо переносятся и не приводят к отмене терапии даже при наличии жалоб у пациентов. Таким образом, эрадикационная терапия по своим клиническим и потенциальным экономическим эффектам превосходит любые другие консервативные подходы в ведении пациентов с синдромом диспепсии.
D.S. Bordin, PhD, Prof., I.G. Bakulin, PhD, Prof., N.V. Bakulina, PhD, Prof., T.A. Ilchishina, PhD, T.E. Skvortsova, PhD, M.Yu. Serkova, PhD, E.Yu. Pavlova, PhD, I.A. Oganezova, PhD, Prof., E.V. Manilo, M.M. Makarova, R.N. Bogdanov, Yu.G. Vlasenko, M.Yu. Gvozdeva, O.I. Dorofeeva, E.M. Dulepova, T.Yu. Pokhodun, I.A. Semenchenko, R.G. Plavnik, PhD, M.I. Shengelia, V.A. Ivanova, Yu.G. Topalova, I.V. Mayev, PhD, Prof., Academician of RAS
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Mechnikov Northwestern State Medical University, St. Petersburg
Multidisciplinary medical holding "CM-Clinic", St. Petersburg
Treatment and Rehabilitation Clinical Center of the Ministry of Defense of the Russian Federation, Moscow
Alexander Hospital, St. Petersburg
City Consultative and Diagnostic Center No. 1, St. Petersburg
Consultative and Diagnostic Center No. 85, St. Petersburg
Consultative and Diagnostic Polyclinic No. 121 of the Moscow Department of Health
LLC "Scandinavian Health Center", Moscow
Dobromed Medical Center, Moscow
52 the Advisory and Diagnostic Center, Moscow
LLC "IZOCARB", Moscow, Russia
Contact person: Tatiana A. Ilchishina, ita17@mail.ru
Within the framework of the educational and research project "Real Clinical Practice of Treatment of Acid-Dependent Diseases", H. pylori-associated pathology and their dynamics after the eradication the nature and severity of clinical manifestations were evaluated. In the analysis 1,474 patients were included aged 18 to 87 years old (average age 45.7 years) with confirmed H. pylori infection, who were observed on an outpatient basis in 188 doctors in Moscow, the Moscow Region and St. Petersburg. Diagnosis of H. pylori and subsequent eradication control were carried out with the use of methods available in real clinical practice. The severity of symptoms was assessed using “7×7” Questionnaire (seven symptoms for seven days). On the first visit, the average score was 12.5, on the second 4.5, and on the third 1.7 points. The significant relationship between smoking and the severity of dyspeptic manifestations was revealed. Rabeprazole was the most commonly prescribed proton pump inhibitor (84.3%) in the eradication regimens.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.