Снижение веса: профилактика сахарного диабета, артериальной гипертензии, дислипидемии, сердечно-сосудистой патологии и продление жизни
- Аннотация
- Статья
- Ссылки


Рост распространенности ожирения отмечается во всех половозрастных группах, а среди детей и подростков распространенность данного заболевания удвоилась по сравнению с 1976 годом (15). В России избыточную массу тела имеет около 40% населения. Согласно эпидемиологическим прогнозам, к 2025 году ожирением будет страдать около 40% мужчин и 50% женщин (5). Экономические затраты в связи с лечением ожирения и его осложнений очень велики: в развитых странах мира расходы на лечение ожирения и сопутствующих ему заболеваний составляют 8-10% от всех затрат на здравоохранение (12, 21). Последние 2 десятилетия клиницисты проявляют особый интерес к так называемому «метаболическому синдрому» (МС), именуемому в разных источниках «синдромом Х», «синдромом изобилия», «смертельным квартетом» и т.п. И хотя в МКБ-10 подобная нозология не предусмотрена, однако есть определенная логика в акцентировании данной проблемы. Ожирение в этом синдроме выступает в роли маркера, а связующим, ключевым звеном между всеми составляющими является инсулинорезистентность. С каждым годом выявляются все новые аспекты сложной проблемы метаболического синдрома, дополняя объем понятия новыми составляющими. В настоящее время кластер МС включает: абдоминальное ожирение, инсулинорезистентность (ИР) и гиперинсулинемию (ГИ), дислипидемию, артериальную гипертонию (АГ), нарушение толерантности к глюкозе (НТГ), микроальбуминурию, нарушение гемостаза, ранний атеросклероз (5, 21, 24). Кроме того, МС часто сопутствуют нарушения пуринового обмена, синдром ночного апноэ и поликистозных яичников, андрогенодефицит у мужчин, гепатостеатоз. Наличие ожирения является фактором развития не только сахарного диабета, артериальной гипертензии, ИБС, инфаркта миокарда, мужского и женского бесплодия, но и рака толстой и прямой кишки, рака шейки матки, яичников, грудных желез, патологии опорно-двигательного аппарата. Развитие ожирения обусловлено взаимодействием предрасполагающих генов и внешних факторов. Изучая вес усыновленных детей и сопоставляя его с наличием ожирения у биологических и приемных родителей, в Датском исследовании прослежена четкая связь между ожирением у биологических родителей и избыточным весом усыновленных в раннем детстве детей (рисунок 1). До настоящего времени не выделен ген ожирения. Многочисленными исследованиями доказана роль мутации генов сахарного диабета 2 типа в развитии ожирения, связь между которыми более 1500 лет тому назад была отмечена индийскими врачами. В этиологии ожирения рассматривается даже роль некоторых вирусов, однако убедительных данных в этой области нет. На генетический дефект на данном этапе влиять практически невозможно, потому что это относится к немодифицируемым факторам. А вот повлиять на модифицируемые факторы вполне возможно, и основное внимание клиницисты уделяют составу диеты, потреблению пищи, уровню физической активности, вредным привычкам.
Расход энергии в организме слагается из уровня обмена веществ, теплообразования и физической нагрузки. Причем на основной обмен расходуется 60-65%, на термогенез – 10%, а на физическую активность всего 25-30% энергии. Ожирение является результатом нарушения энергетического баланса. Уравнение энергетического баланса возможно в том случае, если количество потребляемой пищи полностью покрывает потребность организма в расходе энергии. Ожирение развивается при увеличении потребления пищи и снижении расхода энергии. Именно повышенное накопление висцерального жира является основным фактором риска сопряженных с ожирением заболеваний и состояний. Указанные нарушения вносят существенный вклад в развитие и прогрессирование атеросклеротического процесса у больных ожирением (5). Средняя продолжительность жизни больных ожирением на 8-10 лет короче, чем у людей с нормальной массой тела. Увеличение массы тела всего лишь на 0,4 кг повышает риск смерти на 2% у человека в возрасте 50-62 года. Только в США от последствий ожирения умирают более 400000 человек в год, что и побудило американских властей разработать программу борьбы с избыточным весом. Диагностика метаболических проявлений при висцеральном ожирении чаще всего происходит случайно, потому как начальные проявления МС длительное время протекают бессимптомно и нередко начинают формироваться задолго до клинической манифестации сахарного диабета 2 типа, ИБС и артериальной гипертензии.
Терапия ожирения включает комплексный подход с использованием нефармакологических методов лечения и фармакотерапии. Рекомендации по модификации образа жизни должны включать индивидуальный расчет диеты, изменение стереотипа питания, отказ от вредных привычек, повышенную физическую активность, уклонение от хронического стресса.
Питание должно быть низкокалорийным, содержащим не более 25-35% жира от суточной калорийности рациона, в том числе насыщенных жиров менее 7%, полиненасыщенных – до 10% и мононенасыщенных – менее 20%, холестерина менее 300-200 мг. Важно, чтобы содержание клетчатки составляло не менее 20-25 г/сут. Успешным считается, если снижение веса составляет не менее 10% от исходной массы (3). Со снижением веса улучшается чувствительность к эндогенному инсулину, в связи с чем, нормализуется углеводный обмен, снижается артериальное давление и улучшается липидный спектр крови. Доказано, что снижение веса более эффективно снижает артериальное давление, чем Пропранолол. Кроме того, снижение массы тела на 5,6 кг уменьшает на 58% риск дальнейшего прогрессирования нарушений углеводного обмена – развития сахарного диабета 2 типа у больных с НТГ.
Одним из составляющих образа жизни является регулярная физическая активность (дозированная ходьба, плавание, велотренажер) умеренной интенсивности (4-5 занятий в неделю по 30-45 мин).
К сожалению, более чем 90% людей, снизивших массу тела, в течение 1 года вновь набирают вес (14) и лишь 4-5% больных ожирением могут достичь положительных результатов без дополнительной фармакотерапии (3, 17).
Фармакотерапия ожирения используется в комплексе с немедикаментозным лечением. Обычно медикаментозную терапию необходимо проводить пациентам с ИМТ ≥ 30 кг/м2, однако при наличии факторов риска, часто сопутствующих ожирению (артериальная гипертония, дислипидемия, нарушение углеводного, пуринового обменов и др.), можно прибегать к лекарственному лечению и при ИМТ ≥ 27кг/м2 (8, 9). Фармакотерапия позволяет не только повысить приверженность пациента к не медикаментозному лечению, но и достигнуть более эффективного снижения массы тела и его поддержания в течение длительного периода. Необходимо отметить, что при морбидном ожирении (ИМТ ≥ 40 кг/м2) целесообразно прибегать к хирургическому лечению по витальным показаниям.
Терапия ожирения включает комплексный подход с использованием нефармакологических методов лечения и фармакотерапии. Рекомендации по модификации образа жизни должны включать индивидуальный расчет диеты, изменение стереотипа питания и отказ от вредных привычек.
Фармакотерапия ожирения позволяет не только повысить приверженность пациента к немедикаментозному лечению, но и достигнуть более эффективного снижения массы тела и ее поддержания в течение длительного периода (19). Одним их эффективных средств фармакотерапии ожирения является сибутрамин, селективный ингибитор обратного захвата серотонина и норадреналина в синапсах центральной нервной системы (10, 14). Результатом накопления серотонина в межнейрональной щели является усиление и пролонгирование чувства насыщения и, как следствие, уменьшение объема потребляемой пищи (14, 16, 19). Это один из механизмов действия препарата, способствующего снижению количества поглощаемой пищи и формированию правильного пищевого поведения пациента. Впоследствии 87% пациентов придерживаются сформированного пищевого поведения, выработанного в процессе терапии сибутрамином (9, 22). Наряду с этим, активируя β-3- и β-2-адренорецепторы жировой ткани, сибутрамин стимулирует процессы термогенеза, увеличивает расход энергии и тем самым инициирует липолиз (22).
В Московском государственном медико-стоматологическом университете (МГМСУ) было проведено изучение терапевтической эффективности сибутрамина (Редуксин®) и его влияния на сердечно-сосудистые факторы риска, цитокиновый статус и эндотелиальную функцию у больных висцеральным ожирением.
В открытое не сравнительное не рандомизированное исследование были включены 35 пациентов с висцеральным ожирением (25 женщин и 10 мужчин) в возрасте от 19 до 47 лет (34 года) (28, 37). Индекс массы тела (ИМТ) пациентов был более 27 кг/м². Критериями исключения из исследования являлись: сахарный диабет, синдром тиреотоксикоза, острые инфекции, тяжелая неконтролируемая артериальная гипертензия, острое нарушение мозгового кровообращения, инфаркт миокарда, перенесенные в течение последних 6 месяцев, прием глюкокортикоидов, булимия, злоупотребление алкоголем, беременность, лактация, наличие тяжелых соматических и психических заболеваний.
Исследование продолжалось в течение 13 недель (1 неделя – вводный период, 12 недель – период лечения). График исследования состоял из скринингового периода (1-2 недели до начала исследования) и 4 визитов: 1-й – стартовый (день 0), 2-й – через 4 недели, 3-й – через 8 и 4-й – через 12 недель от начала исследования.
При каждом визите проводился физикальный осмотр, оценивались антропометрические показатели (ИМТ), окружность талии (ОТ), окружность бедер (ОБ), соотношение ОТ/ОБ, измерялось артериальное давление (АД), ЧСС. Лабораторные методы исследования, проводившиеся на первом и заключительном визитах, включали определение концентрации общего ХС, триглицеридов (ТГ), ХС ЛПВП, ХС ЛПНП, ФНО-α, метаболитов оксида азота и эндотелиина-1 (ЭТ-1); проводился пероральный глюкозотолерантный тест с 75 г глюкозы (ОГТТ), до и через 2 часа после нагрузки глюкозой определяли уровни гликемии, иммунореактивного инсулина (ИРИ). Инсулинорезистентность (ИР) оценивалась с помощью гомеостатической модели критерия HOMA-IR. Анализировалась сопутствующая терапия. Редуксин® назначался в начальной дозе 10 мг в сутки, однократно утром (день 0) на фоне гипокалорийного питания с дефицитом калорий 500-600 ккал. Если за первые 4 недели лечения Редуксином масса тела пациентов снижалась менее чем на 2 кг, доза препарата увеличивалась до 15 мг в сутки.
Как показали данные опроса больных, большинство включенных в исследование в прошлом имели неоднократные безуспешные попытки снижения массы тела (2-3 попытки – 30%, 3 и более – 70% больных). Среди пациентов более чем у половины отмечена контролированная артериальная гипертензия (АГ), у 4 человек – НТГ.
Согласно данным антропометрического исследования на фоне терапии Редуксином, у всех больных отмечалась положительная динамика со стороны антропометрических показателей (таблица). Через 12 недель лечения у всех больных наблюдалось снижение массы тела, индивидуальные показатели которого колебались от 2,6 до 16 кг. Кроме того, за период наблюдения окружность талии уменьшилась не менее чем на 5 см у 80% больных, у 20% – на 10 см и более по сравнению с исходным показателем (медиана – 8 см).
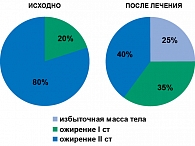
У большинства больных к концу исследования снижение массы тела достигло клинически значимых величин: 50% достигли снижения массы тела более чем на 5%, 40% – более чем на 10% от исходной величины. Снижение массы тела сопровождалось закономерным уменьшением степени выраженности ожирения (рисунок 2). Если в начале исследования ожирение I степени было отмечено у 20% больных, а II степени у 80%, то в конце исследования частота избыточной массы тела у больных МС составила – 25%, ожирения I степени – 35%, а II степени – уже 40%.
Учитывая норадренергический механизм действия Редуксина, было изучено влияние препарата на АД (9, 8). В течение всего периода лечения у обследуемых не отмечалось резких колебаний артериального давления. До лечения показатели САД и ДАД составили соответственно 146 мм рт. ст. (132; 150) и 86 мм рт. ст. (82; 90). Через 12 недель терапии показатели САД и ДАД достоверно снизились, составив соответственно 134 мм рт. ст. (124; 134) (р = 0,02) и 84 мм рт. ст (80; 86) (р = 0,01). Не было отмечено достоверных изменений частоты сердечных сокращений (до сибутрамина 80 уд./мин. (78; 82), после – также 80 уд./мин. (74; 82), (р = 0,08). Снижение массы тела и висцеральной жировой ткани сопровождалось положительной динамикой со стороны ряда других сердечно-сосудистых факторов риска. Показатели углеводного обмена улучшились, о чем свидетельствовало снижение гликемии натощак (до лечения – 5,6 ммоль/л (5,3; 6,1), после – 5,2 ммоль/л (5,1; 5,6), (р = 0,015293). Положительные изменения касались и показателей постпрандиальной гликемии: до лечения – 6,5 ммоль/л (5,5; 7,2), после – 4,9 ммоль/л (3,9; 5,6) (р = 0,028884). Через 12 недель терапии Редуксином у 3 пациентов, имевших НТГ до лечения, отмечалась нормализация толерантности к глюкозе по результатам ОГТТ.
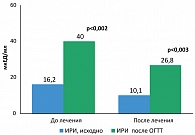
В процессе наблюдения нами отмечено существенное снижение как базальной, так и стимулированной концентрации ИРИ. Так, медиана, интерквартильный размах базального ИРИ до лечения Редуксином составили 16,2 мкЕД/мл (8,1; 24,8), после лечения – 10 мкЕД/мл (6,8; 14,1), (р = 0,004); стимулированного ИРИ соответственно 40 мкЕД/мл (20,6; 48) и 26,8 мкЕД/мл (10,2; 38) (р = 0,003) (рисунок 3). Одновременно с этим отмечалось значимое улучшение чувствительности тканей к инсулину. Повышение индекса HOMA IR исходно зарегистрировано у 92% больных. Медиана, интерквартильный размах HOMA IR до лечения Редуксином составили 4,2 (2,21; 5,28), после лечения – 2,5 (1,6; 3,3), (р = 0,002). В результате этого чувствительность к инсулину нормализовалась у 88% больных.
Кроме того, наблюдались антиатерогенные изменения липидного профиля крови. Отмечено достоверное снижение содержания общего ХС (медиана, интерквартильный размах до лечения 5,9 ммоль/л (4,8; 6,9), через 12 недель 5,2 (4,1; 6,1) ммоль/л, p = 0,003609), ТГ (медиана, интерквартильный размах до лечения 1,83 ммоль/л (1,76; 2,64) и 1,53 ммоль/л (1,12; 2,13) через 12 недель, p = 0,0153). Превышение верхней границы нормального уровня общего ХС и ТГ было зарегистрировано соответственно у 35 и 60% пациентов. До терапии концентрация ХС ЛПВП ниже минимальной нормы была выявлена у 30% больных. Через 12 недель терапии обнаружилось повышение содержания ХС ЛПВП (до лечения 1,1 ммоль/л (0,9; 1,2), через 12 недель 1,2 ммоль/л (1; 1,4), p = 0,0433). В результате среднее значение атерогенного показателя ТГ/ХС ЛПВП улучшилось на 35,7%. Полученные нами данные свидетельствуют, что максимальное снижение сердечно-сосудистого риска наблюдается у пациентов, снизивших массу тела более чем на 10% по сравнению с исходной.
Практически все компоненты метаболического синдрома являются независимыми факторами риска развития ССЗ. Связующим звеном между ИР и кардиоваскулярными заболеваниями является эндотелиальная дисфункция, изучению которой при различных метаболических заболеваниях уделяется большое внимание. Одним из главных маркеров эндотелиальной дисфункции является концентрация в сыворотке крови мощного вазоконстриктора эндотелина-1 (ЭТ-1). В физиологических условиях концентрация ЭТ-1 в плазме очень мала, что связано прежде всего с ингибированием его синтеза оксидом азота (NO) и простациклином РGI2 (7, 9). Редуксин® значимо уменьшил содержание ЭТ-1 (р = 0,003). Медиана, интерквартильный размах концентрации ЭТ-1 до лечения составили 0,562 фмоль/мл (0,502; 0,589), после лечения – 0,470 фмоль/мл (0,408; 0,494) (рисунок 3). Анализируя изменения базального содержания метаболитов NO в крови на фоне терапии Редуксином, было установлено, что при высоком исходном уровне на фоне лечения наблюдается уменьшение продукции NO. Медиана, интерквартильный размах метаболитов NO в крови до лечения составили 58,4 мкмоль/л (48,9; 74,10), после лечения – 35,6 мкмоль/л (20,8; 46,1), р = 0,0006. Исходя из динамики ЭТ-1 и метаболитов NO в ходе лечения, наблюдаемые изменения параметров эндотелиальной функции дают возможность предположить адаптационное значение повышенной продукции NO у больных МС. Снижение базальной эндогенной продукции NO до нормальных показателей после лечения Редуксином, очевидно, обусловлено уменьшением метаболических расстройств, а главное – ИР.
Согласно современной концепции, ожирение рассматривается как провоспалительное состояние. Жировая ткань, особенно висцеральной локализации, секретирует в кровь большое количество провоспалительных адипоцитокинов (20). Можно полагать, что эндогенная продукция NO у больных МС увеличивается под действием ряда провоспалительных цитокинов и белков острой фазы, прежде всего ФНО-α, интерлейкина 6, С-реактивного протеина. Это носит, по-видимому, компенсаторный характер и направлено на подавление активности цитокинов с целью ограничения воспаления и повреждения сосудистого эндотелия.
С учетом вышесказанного избыточная продукция NO в базальных условиях у больных висцеральным ожирением может рассматриваться как защитный механизм, однако последствием могут быть и различные нарушения при высоких концентрациях. Известно, что биологический эффект NO зависит от его концентрации. Как избыток, так и дефицит NO для организма крайне неблагоприятны. В сравнительно небольшой концентрации, активируя растворимую гуанилатциклазу, вызывая тем самым повышение уровня цГМФ в клетках-мишенях, NO выполняет важнейшие регуляторные функции 6. Однако высокие концентрации NO, обычно индуцируемые индуцибельной синтазой NO и в некоторых ситуациях другими изоформами, токсичны для различных клеток, ферментов, ионных каналов и генетического аппарата клетки. Главный патофизиологический механизм токсического действия избытка NO – это образование при взаимодействии NO с супероксид анион-радикалом высокотоксичного и стабильного пероксинитрита (ONOO). Пероксинитрит способен интенсивно окислять NH- и SH-группы белков, ДНК, индуцировать процессы перекисного окисления липидов в мембранах клеток. Кроме того, избыток NO нитрозилирует и тем самым ингибирует белки-ферменты дыхательной цепи митохондрий и цикла Кребса, в результате снижается синтез АТФ в клетках (18, 20).
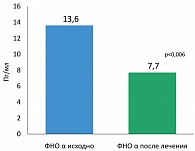
В последние годы большое внимание привлекает изучение цитокинового статуса при различных воспалительных состояниях, в том числе синдроме ИР. Провоспалительные цитокины являются маркерами атеросклеротического риска и эндотелиальной дисфункции (10, 13, 23). Результаты исследования (МГМСУ) показали, что лечение Редуксином привело к достоверному снижению концентрации ФНО-α (до и после лечения соответственно 13,6 пг/мл (10,2; 17,8) и 9,1 пг/мл (7,7; 11,3) (р = 0,006) (рисунок 4). Эффект Редуксина на ФНО-α в определенном смысле реализуется через влияние препарата на жировой обмен. ФНО-α экспрессируется в различных клетках, включая макрофаги, эндотелиоциты, фибробласты и адипоциты (23). Следовательно, секреция ФНО-α чувствительна к изменению массы тела, и, вызывая похудение, Редуксин® оказывает влияние на адипоцитокин, снижая его концентрацию.
При суммарной оценке клинической эффективности сибутрамина после проведенного лечения нами отмечено исчезновение отдельных компонентов МС у 79% пациентов, а у 52% больных мы не выявили признаков МС (по критериям NCEP ATP III). В исследованиях V. Hainer и соавт. (2006 г.) также продемонстрировано исчезновение отдельных признаков МС у 58% пациентов, принимавших сибутрамин, а в группе контроля лишь у 40% пациентов (16).
Анализ данных индивидуального пищевого дневника и мнения пациентов свидетельствует, что регулярный прием Редуксина в дозе 15 мг/сут. позволяет легко и эффективно соблюдать рекомендации врача по низкокалорийному питанию. По мнению исследователей, еще одним важным практическим аспектом эффективности сибутрамина является то, что в процессе лечения на фоне снижения объема съеденной пищи большинство пациентов сумели критически переоценить свои пищевые привычки до лечения. В этот период, характеризуя свое пищевое поведение, большинство больных МС отмечали, что потребляют небольшое количество пищи и аппетит у них не повышен. В процессе лечения на фоне снижения объема съеденной пищи большинство пациентов переоценили свои пищевые привычки и отметили, что все-таки до терапии, имея повышенный аппетит, они потребляли большое количество пищи. Переносимость препарата была хорошей: лишь у 2 больных отмечалась сухость во рту, беспокоящая в течение первых 2-3 недель лечения.
Следует подчеркнуть необходимость длительного поддержания достигнутых результатов после окончания фармакотерапии ожирения. Важным механизмом действия Редуксина является активация скорости метаболических процессов, которая замедляется в процессе снижения массы тела. Снижение скорости метаболизма затрудняет дальнейшую эффективную потерю массы тела у пациентов. Это способствует удержанию достигнутой массы тела в процессе терапии. В этой связи повторно (через 8 месяцев после окончания лечения Редуксином) были осмотрены больные, принявшие участие в исследовании. Спустя 32 недели после отмены препарата 79% больных сохранили достигнутые результаты. В ряде плацебо-контролируемых исследований также продемонстрировано, что сибутрамин при длительном применении, по сравнению с плацебо, помогает большей доле пациентов с ожирением сохранить достигнутые результаты (9, 8).
Таким образом, лечение ожирения – широко распространенного состояния высокого риска кардиоваскулярных заболеваний и сахарного диабета 2 типа – требует наряду с изменением образа жизни назначения фармакотерапии. Результаты исследования показали, что применение Редуксина в комбинации с немедикаментозными методами приводит к значительному снижению массы тела, благоприятно влияет на сопутствующие сердечно-сосудистые и метаболические факторы риска. Удобство в использовании (1 р./сут.), хорошая переносимость и высокая эффективность позволяют рекомендовать Редуксин® в комплексной терапии ожирения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.