Тиазолидиндионы: действительно ли много шума из ничего?
- Аннотация
- Статья
- Ссылки
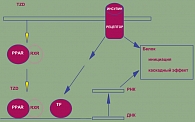
Наличие СД типа 2 увеличивает в 2-5 раз риск развития ишемической болезни сердца и в 3 раза риск сердечно-сосудистой смертности относительно общей популяции (5, 8, 9). В ряде исследований было продемонстрировано, что у больных СД типа 2 риск возникновения инсульта повышен в 2-3 раза, хронической почечной недостаточности – в 15-20 раз, а слепоты – в 10-20 раз (2, 3, 4). Кроме того, риск развития хронической сердечной недостаточности у больных СД типа 2 в 2,5 раза выше, чем у лиц без СД (6). Сахарный диабет типа 2 характеризуется прогрессирующим нарушением функции β – клеток поджелудочной железы на фоне развития инсулинорезистентности (2, 3). При манифестации СД-2 секреция инсулина снижается на 50%, чувствительность к инсулину – на 70% (5). В настоящее время известно более 40 различных состояний, при которых формируется инсулинорезистентность той или иной степени. Инсулинорезистентность сопутствует стрессам, инфекциям, уменьшению физической активности, пожилому возрасту, приему алкоголя, ожирению и многим другим состояниям (5). Тиазолидиндионы (ТЗД), пиоглитазон и росиглитазон являются агонистами рецептора, активируемого пролифератором пероксисом (PPAR-gamma). Активация PPAR-гамма повышает чувствительность к инсулину через увеличение экспрессии многочисленных генов, кодирующих протеины или белки, которые модулируют метаболизм глюкозы и жиров (рисунок 1). В результате улучшается чувствительность к инсулину в печени, мышечной и жировой тканях. Активация PPAR-альфа изменяет продукцию и метаболизм липидов в печени и в других тканях.
Тиазолидиндионы пересекают плазменную мембрану и проходят через цитоплазму к ядру, где они соединяются с комплексами PPAR/RxR. Этот активированный комплекс соединяется с рибосомными структурами. Как только инсулин соединяется с рецептором, наступает пострецепторный эффект, но, что важно, инсулин так же посылает трансядерный сигнал в ядра для активации факторов транскрипции в рибосомном матриксе транспорта глюкозы в клетку.
Активный тиазолидиндион – PPAR/RxR комплекс – повышает функцию и эффективность процессов фактора траскрипции, который инициировал инсулин. Это повышение увеличивает эффекты инсулина на ядро. В результате включается сигнал для формирования белков, участвующих в энзиматических процессах, росте клеток, регуляции активности инсулиновых рецепторов. Благодаря уникальному механизму действия, глитазоны снижают резистентность к инсулину преимущественно в мышечной и жировой ткани, превосходя в этом метформин. Являясь классическим сенситайзером (повышающим чувствительность), глитазоны эффективно влияют на постпрандиальную и натощаковую гликемию при наличии собственной достаточной секреции инсулина. Неудивительно, что ТЗД (росиглитазон, пиоглитазон) нашли широкое применение в терапии СД 2 в качестве препаратов второй линии, которое подтверждено совместным консенсусом ADA/EASD (Американская диабетическая ассоциация/Европейская ассоциация по изучению диабета) в конце 2006 года (11). Будучи на рынке около 10 лет, ТЗД продемонстрировали высокую эффективность у тучных диабетиков. При этом изначально были известны некоторые не желательные явления, связанные с использованием ТЗД, и грамотное назначение этих препаратов позволяет избежать вероятности их развития.
Однако за последний год резко актуализировалась тема нежелательных явлений со стороны сердечно-сосудистой системы на фоне приема ТЗД, причиной для чего послужила публикация Nissen и соавт. (2007) в «New England Journal of Medicine» (12), которая вызвала широчайший резонанс среди медицинской общественности во всем мире и неоднократно обсуждалась как в международной, так и российской медицинской печати. В статье под названием «Влияние росиглитазона на риск развития инфаркта миокарда и смерти от сердечно-сосудистых причин» Nissen и Wolski представили мета-анализ данных 42 рандомизированных клинических исследований, в результате которого был сделан вывод, что применение росиглитазона (Авандиа) достоверно связано с повышенным риском инфаркта миокарда и смерти вследствие сердечной недостаточности по сравнению с плацебо или активной контрольной группой, получавшей другие сахароснижающие препараты. Такие известные исследования, как ADOPT и DREAM, также вошли в мета-анализ. Анализируя, как было сказано выше, данные 42 рандомизированных клинических исследований, исследователи обнаружили повышенные риски развития инфаркта миокарда (коэффициент вероятности – 1,43; 95%, доверительный интервал – 1,03-1,98; Р=0,03) и смерти от кардиоваскулярных событий (коэффициент вероятности 1,64; 95%, доверительный интервал – 0,98-2,74) среди больных СД типа 2, получавших росиглитазон. Для объективности следует указать, что осуществить добросовестный мета-анализ столь большого числа исследований разной продолжительности в неоднородных популяциях больных, притом с оценкой различных конечных точек в каждом из исследований, практически сложно, а может быть и невозможно. Немаловажен и тот факт, что только 2 исследования, ADOPT и DREAM, – долгосрочные. Необходимо отметить, что многоцентровое исследование ADOPT в основном было посвящено влиянию ТЗД на минеральную плотность костной ткани и риску развития переломов. В отношении влияния на сердечно-сосудистый риск результаты этих долгосрочных исследований не выявили статистически значимой разницы по частоте инфаркта миокарда, инсульта, сердечной недостаточности, впервые возникшей стенокардии и смерти между группами росиглитазона и другими сахароснижающими препаратами.
Мета-аналитические исследования оказывают неоценимую помощь в охвате и анализе большого количества разноплановых данных, однако следует всегда учитывать, что результаты любого мета-анализа имеют лишь относительную достоверность и не могут сравниться с результатами проспективных крупномасштабных исследований. Основная роль мета-анализа – «поймать» проблему и обосновать актуальность дальнейших проспективных исследований.
Недавно были опубликованы результаты промежуточного анализа исследования RECORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycaemia in Diabetes) (13), медиана периода наблюдения которого должна составить 6 лет. Опубликованные данные основываются на длительности наблюдения, медиана которого составила 3,75 лет. Промежуточные результаты подтверждают, что росиглитазон действительно повышает риск развития сердечной недостаточности, однако, риск смерти в связи с сердечно-сосудистой патологией не нарастает. Причиной развития сердечной недостаточности исследователи склонны считать задержку жидкости в организме, повышающую нагрузку на левое предсердие и увеличение легочного венозного давления.
Публикация Nissen и соавт. (2007) вызвала широкий резонанс и побудила многих исследователей обратиться ко второму препарату из группы тиазолидиндионов – пиоглитазону – и провести сравнение с росиглитазоном относительно сердечно-сосудистого риска. Charles M.Gerrits et al. (14) проведено ретроспективное когортное исследование пациентов, которым инициирующая терапия сахарного диабета проводилась пиоглитазоном или росиглитазоном. Относительный риск госпитализации по поводу ОИМ после инициации лечения этими препаратами был оценен с помощью мультивариантного анализа методом Кокса, в котором учитывались конечные точки: госпитализация или коронарная реваскуляризация. В общей сложности 29911 пациентов удовлетворили критериям включения для этой ретроспективной когорты, из которых 14807 получали пиоглитазон, 15104 – росиглитазон. В среднем пациенты обеих групп принимали препараты11 месяцев. Двое из трех пациентов в обеих группах были мужчины, а средний возраст больных составил 56 лет. Демографические данные, анамнез, фармакотерапия в обеих группах были сопоставимы, с небольшими исключениями: статины и фибраты чаще получали пациенты в группе пиоглитазона, более высокая распространенность гиперлипидемии и более частое применение метформина наблюдалась в группе росиглитазона. Коэффициент вероятности госпитализации по поводу ОИМ был 0,78; 95%, доверительный интервал – 0,63-0,96. Относительный риск по ОИМ или коронарной реваскуляризации был 0,85; ДИ 95% (0,75-0,98). Среди пациентов, принимавших пиоглитазон за исследуемый период по поводу ОИМ, были госпитализированы 161 пациент (1,1%), в то время как среди принимавших росиглитазон – 214 пациентов (1,4%). Это ретроспективное когортное исследование (14) показало, что применение пиоглитазона привело к относительному снижению риска госпитализации больных СД типа 2 по поводу ОИМ на 22% по сравнению с росиглитазоном.
Несмотря на то что пиоглитазон и росиглитазон имеют сходное влияние на углеводный обмен, отчетливо проявляются различия в метаболизме липидов. Анализ в данном исследовании показал, что пиоглитазон способствовал снижению уровня триглицеридов, в то время как в группе росиглитазона наблюдался рост этого показателя. Кроме того, пиоглитазон способствовал повышению холестерина липопротеинов высокой плотности в большей степени, чем росиглитазон. Кроме всего, исследователи обнаружили благоприятные изменения в концентрации и размерах атерогенных частиц холестерина липопротеинов низкой плотности при применении пиоглитазона. Положительное влияние пиоглитазона на липидный обмен был выявлен в ходе исследования PROactive (PROspective pioglitAzone Clinical Trial In macroVascular Events), в котором участвовало 5238 больных сахарным диабетом типа 2 с макрососудистыми осложнениями в анамнезе. Подключение к терапии диетой, ПССП или комбинацией сахароснижающих препаратов 45 мг пиоглитазона в течение 3 лет повысило уровень ЛПВП на 9%, снизило уровень триглицеридов на 13%. Что особенно интересно, частота смертельных исходов или развитие новых макрососудистых осложнений снизилась на 10% при небольшом повышении частоты развития сердечной недостаточности по сравнению с плацебо (10,8% и 7,5% соответственно).
Вместе с тем необходимо учесть, что подобные исследования имеют потенциальные ограничения, которые должны быть приняты во внимание при интерпретации результатов. В ряде ретроспективных исследований обработка данных осуществлена без рандомизации, и в таком случае сохранялась возможность игнорирования ряда таких факторов риска, как, например, ИМТ, курение, физическая активность и диета.
Обобщая обзор данных наиболее известных публикаций, необходимо еще раз отметить, что небывалый резонанс, вызванный сообщениями о нежелательных явлениях со стороны тиазолидиндионов, касались росиглитазона. О каких-либо новых нежелательных явлениях в отношении пиоглитазона не сообщается. При назначении глитазонов следует тщательно обследовать больного и исключить в первую очередь наличие хронической сердечной недостаточности, а у женщин в менопаузе – остеопороз. Учитывая при назначении глитазонов все противопоказания можно успешно предотвратить развитие серьезных осложнений.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.