Тиоктацид БВ в терапии диффузной автономной нейропатии
- Аннотация
- Статья
- Ссылки


Характер глобальной эпидемии заболеванию придает СД типа 2 (СД2). Уже в конце второго тысячелетия СД был назван неинфекционной эпидемией. Статистика распространенности СД имеет постоянную тенденцию к росту. Так, СД2 страдает 3-5% взрослого населения, и наблюдается явная тенденция к омоложению контингента больных. Кроме того, манифестация СД2 значительно более скрытая по клинической картине в сравнении с СД типа 1 (СД1). Именно этим можно объяснить факт поздней постановки диагноза СД2. По данным III исследования состояния здоровья и питания (NHANES III), проведенного в США, распространенность не диагностированного СД2 составляет 2,7%. Основными задачами в лечении данного заболевания являются поддержание нормального уровня гликемии и предотвращение возникновения и развития поздних осложнений, а также предупреждение гипогликемий.
Социальная значимость СД определяется его поздними осложнениями. Для любого государства – это значительное экономическое бремя. Во всем мире СД2 сопровождается увеличением преждевременной инвалидизации лиц трудоспособного возраста, является причиной преждевременной смерти, что, прежде всего, связано с осложнениями этого заболевания, которые рано развиваются и быстро прогрессируют. Принято выделять три основных осложнения при диабете: микроангиопатия, макроангиопатия, полинейропатия. Каждое из этих осложнений развивается на фоне гипергликемии. Следует учитывать, что большинство больных находятся в состоянии неудовлетворительного контроля СД, т.е. в состоянии постоянной гипергликемии, что соответствует высокому риску развития его осложнений.
Диабетическая нейропатия (ДН) является одним из наиболее частых и трудно поддающихся лечению поздних осложнений СД. По современным оценкам, клинические проявления ДН наблюдаются примерно у 30-50% больных СД (1). В среднем периферической ДН страдают около 25% больных СД (5, 6). Некоторые авторы отмечают, что субклиническая (ЭМГ-верифицированная) патология эфферентной иннервации обнаруживается почти у всех больных СД (4, 5), другие – в 70-90% случаев (7, 19). Вероятно, различие в данных связано с отсутствием единых диагностических подходов и критериев.
По заключению Конференции по проблемам диабетической нейропатии (Сан-Антонио, 1988) ДН – это описательный термин, который означает доказуемую патологию нервной системы, очевидную клинически или субклинически наблюдаемую при СД, при отсутствии других причин ее развития. Несмотря на четкую известность возможности возникновения ДН, диагностика данного состояния проводится недостаточно. По данным А.С. Аметова, только 35,6% эндокринологов и 30,7% врачей других специальностей устанавливают мягкие и средние формы тяжести ДПН правильно. Д. Циглер (2005) показал, что распространенность диабетической нейропатии у больных СД, у лиц с нарушенной толерантностью к глюкозе и лиц без диабета составила соответственно 27, 13 и 8%. Данное исследование показало, что дистальная симметричная нейропатия развивается очень рано. При СД1 нарушения функции периферической нервной системы могут быть выявлены в течение первых 2-8 лет после манифестации заболевания. Выраженность данного осложнения при СД1 коррелирует с длительностью и тяжестью основного заболевания (18). ДН может быть выявлена в момент постановки диагноза, особенно у пациентов с СД2, у которых на формирование данного осложнения также влияют артериальная гипертензия и нарушения липидного обмена (2, 7, 13).
Патогенез ДН до конца не изучен. Первым объединил сосудистую и метаболическую теории формирования ДН В.С. Прихожан (8). В 2001 г. американский ученый М. Браунли обобщил экспериментальные и клинические данные о молекулярных и биохимических основах патогенеза ДН, указал механизмы нарушения метаболизма, которые приводят к поражению сосудов микроциркуляторной системы и нервных волокон (10). В настоящее время существуют основные пять теорий формирования и развития данного осложнения: теория полиол-сорбитолового шунта, теория недостаточности миоинозитола, теория эндоневральной микроангиопатии, теория прямого глюкозотоксического действия и теория оксидативного стресса.
Метаболические нарушения на фоне хронической гипергликемии и дефицита инсулина приводят к активации полиолового пути обмена глюкозы с накоплением сорбитола и снижением содержания миоинозитола. Как следствие, возникает гиперосмолярность, отек и демиелинизация нервных волокон. Недостаток миоинозитола, являющегося основным источником энергии, вызывает замедление скорости проведения нервного импульса.
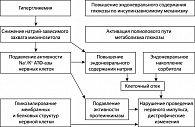
Патогенез ДН сложен (рисунок 1). Блокада гексозоаминового пути утилизации глюкозы приводит к накоплению глюкозо-6-фосфата, что в свою очередь активирует протеинкиназы-С и образование большого числа конечных продуктов избыточного гликирования белков (AGEs). Все это приводит к нарушению эндотелий-зависимых реакций и нарушению функции структур нервных клеток, например аксоплазматического тока. Супероксид приводит к разрушению митохондриальной ДНК, в результате чего происходит активация специальных полимераз (PARP), которые блокируют обмен глюкозы. Найдена ассоциация сроков развития ДН с полиморфизмом генов митохондриальной и эндотелиальной супероксиддисмутазы и гена PARP, что хорошо согласуется с представлением о ведущей роли митохондриального супероксида в формировании поздних осложнений СД (17).
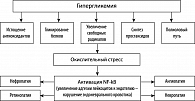
При СД на фоне оксидативного стресса происходит образование большого числа свободных радикалов из-за слабости собственной антиоксидантной системы (антиоксидантных ферментов), что приводит к усилению нарушений обмена глюкозы (рисунок 2).
Классификация ДН в настоящее время основана на клинической картине данной патологии, которая в свою очередь крайне разнообразна и определяется поражением того или иного отдела нервной системы, а также имеющихся нарушений.
Схема классификации ДН
Cубклиническая стадия нейропатии
А) Патологические результаты электродиагностических тестов (замедление проведения нервного импульса по чувствительным и двигательным волокнам, уменьшение амплитуды индуцированных нервно-мышечных потенциалов).
В) Патологические результаты инструментального исследования различных видов чувствительности (вибрационной, температурной, тактильной).
С) Патологические результаты функциональных тестов на состояние автономной иннервации.
Клинически выраженная стадия нейропатии
А) Центральная (энцефалопатия, миелопатия).
В) Периферическая диффузная нейропатия.
- Дистальная симметричная сенсомоторная нейропатия:
1.1) с преимущественным поражением мелких нервных волокон;
1.2) с преимущественным поражением крупных нервных волокон;
1.3) смешанная;
1.4) проксимальная амиотрофия.
С) Диффузная автономная нейропатия.
-
Кардиоваскулярная форма.
-
Гастроинтерстициальная форма.
-
Урогенитальная форма.
-
С нарушением функции потовых желез.
-
С нарушением способности распознавать гипогликемию.
-
С нарушением функции зрачка.
Д) Очаговая нейропатия.
-
Мононейропатия.
-
Множественная мононейропатия.
-
Плексопатия.
-
Радикулопатия.
-
Нейропатия черепно-мозговых нервов:
-
обонятельного (I пара);
-
зрительного (II пара); глазодвигательных (III, IV, VI пары);
-
тройничного (V пара);
-
лицевого (VII пара);
-
вестибулокохлеарного (VIII пара);
-
языкоглоточного (IX пара);
-
блуждающего (X пара).
Лечение любой патологии должно быть патогномоничным, с учетом, прежде всего, механизмов возникновения и развития данных изменений. Когда речь идет о СД, важным является достижение «целевых» показателей гликемии, т.е. нормализация углеводного обмена при использовании интенсивной терапии СД с ведением больных в состоянии, близком к нормогликемии. К сожалению, в исследовании UKPDS (больные 1 типом (DCCT) и 2 типом CД на интенсивной терапии с достижением нормогликемии) не показали возможность предотвращать развитие, а тем более приводить к обратному регрессу ДН. Это можно объяснить феноменом «гипергликемической памяти». Несмотря на то, что нормализации углеводного обмена явно недостаточно для лечения и предотвращения формирования и развития ДН, достижение так называемых целевых цифр тощаковой и постпрандиальной гликемии приоритетно.
В настоящее время основным патогенетическим методом терапии ДН считается назначение препаратов из группы антиоксидантов. a-липоевая (тиоктовая) кислота является мощным естественным жирорастворимым антиоксидантом, в чистом виде была получена в 1951 г. Ее способность действовать в качестве ловушки свободных радикалов многократно подтверждена в экспериментальных и клинических исследованиях (14). Сейчас известно, что она представлена в качестве кофактора во многих полиферментных комплексах, катализирующих окислительное декарбоксилирование ряда a-кетокислот (Пируват, a-кетоглутарат и др.) как в клеточной мембране, так и в цитоплазме (15), оказывает протективное воздействие на эндотелий. Доказана активация эндогенных протекторных систем NO и HSP (система стресс-белков) при лечении a-липоевой кислотой (9). Липоевая кислота способствует регенерации и восстановлению других антиоксидантов (цикл витаминов Е и С). Уникальная химическая структура липоевой кислоты позволяет происходить ее регенерации самостоятельно – без участия других соединений (3).
Введение a-липоевой кислоты приводит к улучшению эндоневрального кровотока, снижению содержания фактора агрегации тромбоцитов, увеличению содержания оксида азота и активации синтеза белков теплового шока, повышению синтеза фактора роста нервов. Кроме того, отмечено улучшение как сосудистого обеспечения нервных волокон, так и их метаболизма. Тиоктацид (оригинальный препарат a-липоевой кислоты) оказывает выраженное нейропротекторное, эндопротекторное и гепатопротекторное действие, способствуя уменьшению выраженности жирового гепатоза, обладает липотропным действием (11). Для оценки клинически значимого эффекта действия препарата были разработаны комбинированные шкалы оценки невропатических симптомов и дефицитов.
Общая шкала неврологических симптомов TSS (Total Symptom Score) – симптомы подсчитываются по баллам, суммирующим интенсивность и частоту основных невропатических симптомов, таких, как боль, парестезии, жжения и онемения.
Шкала неврологических симптомов NSS (Neurological Symptom Score) – более детальное обследование, включающее в себя электромиографические показатели, порог вибрационной и температурной чувствительности, вариабельности сердечного ритма при глубоком дыхании.
Шкала нейропатического дисфункционального счета NDS (Neuropathy Disability Score) – количественная оценка диабетических нейропатий: состояние сухожильных рефлексов и нарушение различных видов чувствительности.
Гамбургский опросник по болевому синдрому HPAL (Hamburg Pain Adjective List).
Многие из вышеперечисленных опросников использовались в клинических исследованиях, доказавших эффективность Тиоктацида как на невропатические симптомы, так и на невропатический дефицит. В исследовании ALADIN впервые был показан дозозависимый эффект тиоктовой кислоты при ДН. При этом доказано, что небольшие дозы липоевой кислоты (от 50 до 300 мг) неспособны привести к уменьшению симптомов ДН, а дозы 600 мг и 1200 мг препарата при внутривенном введении оказывают аналогичный эффект. Исходя из этого сделан вывод, что не следует увеличивать дозу внутривенного введения Тиоктацида сверх 600 мг (21).
Результаты исследования SYDNEY I показали достоверное улучшение самочувствия больных ДН (по шкале TSS) и уменьшение симптомов нейропатии на фоне инфузионной терапии препарата липоевой кислоты. Исследование SYDNEY 2 оценивало эффективность при ДПН приема в таблетках препарата липоевой кислоты в разных дозах: 600, 1200 и 1800 мг. Показано, что оптимальной является доза в 600 мг, что противоречит данным исследования ORPIL, в котором оценивали эффективность приема таблеток липоевой кислоты в дозе 600, 1200 и 1800 мг по сравнению с плацебо. В результате было определено, что прием препарата в дозе 1800 мг в достоверно большей степени улучшали состояние пациентов (уменьшались баллы по шкале TSS (p < 0,05)). Данные противоречия результатов требуют дальнейших исследований.
Длительное применение таблетированной формы a-липоевой кислоты (в течение 4 лет) в дозе 600 мг в исследовании NATHAN I для замедления прогрессирования ДН успехом не увенчалось.
В исследовании DECAN лечение в течение 4 месяцев Тиоктацидом (табл. 800 мг в день) пациентов с СД, страдающих автономной кардиальной нейропатией, привело к значительному улучшению функции малых нервных волокон вегетативной нервной системы, что проявилось увеличением вариабельности сердечного ритма в низкочастотном диапазоне, а в высокочастотном отмечалась тенденция к нормализации ритма сердца, вариабельности сердечного ритма по сравнению с плацебо (p < 0,05) (20). Данное исследование является одним из немногих, посвященных проблеме терапии автономной полинейропатии, хотя ее распространенность, вероятно, превышает распространенность периферической диффузной нейропатии. Отсутствие четких критериев для постановки диагноза не позволяет вовремя начинать соответствующую терапию.
Возможность применения препарата в виде таблеток появилась сравнительно недавно. Новая форма препарата – это a-липоевая кислота второго поколения, которую отличает более высокая биодоступность и более быстрое достижение максимальной концентрации в крови. Время достижения максимальной концентрации в плазме крови (Сmax) составляет 25-30 мин. Сmax после приема одной таблетки Тиоктацида БВ достигает 4 мкг/мл. Тиоктацид БВ полностью всасывается из желудочно-кишечного тракта. Относительная биодоступность Тиоктацида БВ более 60%, период полувыведения из плазмы составляет 25 мин, препарат способен накапливаться в нервных волокнах (16). Данные свойства препарат приобрел благодаря замене вспомогательных компонентов ядра таблетки (вместо оксипропилцеллюлозы – гидроксипропилцеллюлоза) и пленочного покрытия (метилоксипропилцеллюлоза заменена гипромеллозой, добавлен макрогол, удален полиэтиленгликоль). Таким образом таблетированная форма приобрела характеристики инъекционно вводимого препарата.
В своей работе мы оценивали влияние терапии препарата Тиоктацид Т и Тиоктацид БВ на гастроинтестинальную и урогенитальную формы диффузной автономной нейропатии. Нами наблюдались пациенты: с СД1 – 18 человек в возрасте от 19 до 27 лет со стажем диабета от 3 до 5 лет (группа 1), и пациенты с СД2 – 20 человек в возрасте от 43 до 52 лет со стажем диабета (с момента постановки диагноза) от 1 до 5 лет (группа 2).
Урогенитальная форма проявлялась недержанием мочи (4 пациента), нарушением распознавания наполненности мочевого пузыря (2 пациента), ложными позывами к мочеиспусканию (2 пациента), эректильной дисфункцией (11 пациентов) и ретроградной эякуляцией (1 пациент). Всем пациентам были проведены необходимые обследования для исключения сопутствующей патологии, приводящей к данным нарушениям. После чего вышеперечисленные нарушения были диагностированы как проявления урогенитальной формы диффузной автономной нейропатии.
Пациенты с гастроинтестинальной формой имели следующие проявления: ощущение тяжести в животе (8 человек), запоры (отсутствие дефекации 3-5 дней) (8 человек), склонность к диарее (2 человека). У всех пациентов при проведении дополнительных методов обследования исключена патология желудочно-кишечного тракта. Каждая группа пациентов была разбита на четыре подгруппы с учетом жалоб, длительности заболевания. Между собой подгруппы сравнивались по эффективности терапии Тиоктацид Т (600) в/в и Тиоктацид БВ 1 табл. утром за 30 мин до еды. Все пациенты на момент начала терапии препаратом липоевой кислоты находились в компенсации по углеводному обмену.
Распределение больных СД различного типа, страдающих урогенитальной и гастроинтестинальной формами диффузной автономной нейропатии, получавших различные формы терапии Тиоктацидом, приведено в таблице 1.
На фоне проведенного лечения наблюдалась положительная динамика клинической симптоматики у пациентов, страдающих как урогенитальной, так и гастроинтестинальной формами диффузной автономной нейропатии (таблица 2).
У пациентов с урогенитальной формой наблюдалось улучшение клинической симптоматики, проявившееся в сохранении симптоматики лишь у 4 из 20 человек. Так, недержание мочи сохранилось у 1 из 4 пациентов (25%), эректильная дисфункция – у 3 из 11 человек (27,3%). Однако степень тяжести данных нарушений по окончанию курса лечения существенно снизилась.
У пациентов с гастроинтестинальной формой улучшение наступило у большинства пациентов – 16 из 18 человек (88,9%). По окончании курса терапии сохранилось ощущение тяжести в животе у 1 из 8 человек (12,5%). У 1 из 8 человек (12,5%) сохранились запоры.
При сравнении между собой эффективности лечения у пациентов, получавших различные формы Тиоктацида, было выяснено следующее. При урогенитальной форме ДН у больных СД1 таблетированный прием оказался менее эффективным, чем внутривенное назначение препарата. У больных ДН с СД2 наблюдалась более высокая эффективность именно пероральной формы Тиоктацида.
При гастроинтестинальной форме ДН у больных СД1 таблетированный прием также оказался менее эффективным, чем внутривенное назначение препарата. У больных ДН с СД2 аналогичным образом наблюдалась более высокая эффективность именно пероральной формы Тиоктацида.
Следует учитывать, что размер выборок больных ДН с СД1 и СД2 был относительно небольшим, в связи с чем для получения более достоверных результатов требуется продолжение исследования в больших группах.
При сопоставлении побочных эффектов от проводимого лечения существенных побочных эффектов, потребовавших прекращения лечения, ни в одной из групп зарегистрировано не было.
Выводы
Применение препаратов липоевой кислоты показано для лечения проявлений диффузной автономной нейропатии, отсутствие 100% эффекта может быть обусловлено разной степенью выраженности осложнений у пациентов и разной длительностью предшествующей декомпенсации углеводного обмена. Безусловно, наличие возможности избегать инвазивной терапии для лечения крайне оправданно. Нами отмечено, что менее выражена позитивная реакция на таблетированную форму препарата у пациентов, которые ранее получали терапию Тиоктацида внутривенно. Как нам кажется, это объясняется субъективным настроем пациентов, что «капельница всегда лучше». У пациентов с недостаточно выраженным эффектом на проводимую терапию возможно применение Тиоктацида БВ в дозировке до 1800 мг/сут.
В настоящее время изучаются новые возможные виды терапевтического лечения, основанные на результатах современных исследований, касающихся патогенетических механизмов развития ДПН.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


