Рамуцирумаб в комбинации с паклитакселом во второй линии терапии метастатического рака желудка: окончательные результаты исследования
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Пациенты получали рамуцирумаб 8 мг/кг внутривенно один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1-й, 8-й и 15-й дни 28-дневного цикла. Терапия в данном режиме продолжалась до прогрессирования заболевания или развития неприемлемой токсичности.
Результаты. Согласно окончательным результатам исследования, объективный ответ на терапию в виде частичной регрессии достигнут у семи пациентов, еще у 12 отмечалась стабилизация. Медиана выживаемости без прогрессирования составила 9,5 месяца. В настоящее время у четырех пациентов сохраняется контроль над заболеванием, они продолжают получать терапию. Медиана общей выживаемости достигла 12,5 месяца. Восемь пациентов живы, они перешагнули 24-месячный рубеж. Спектр нежелательных явлений незначительный. В большинстве случаев имела место гематологическая и негематологическая токсичность 1–2-й степени, серьезных нежелательных явлений не зафиксировано.
Заключение. Комбинация рамуцирумаба и паклитаксела характеризуется высокой эффективностью, приемлемым профилем токсичности и потенциально ассоциируется с высокой общей выживаемостью у пациентов с метастатическим раком желудка, прогрессирующим на фоне первой линии терапии.
Материал и методы. Пациенты получали рамуцирумаб 8 мг/кг внутривенно один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1-й, 8-й и 15-й дни 28-дневного цикла. Терапия в данном режиме продолжалась до прогрессирования заболевания или развития неприемлемой токсичности.
Результаты. Согласно окончательным результатам исследования, объективный ответ на терапию в виде частичной регрессии достигнут у семи пациентов, еще у 12 отмечалась стабилизация. Медиана выживаемости без прогрессирования составила 9,5 месяца. В настоящее время у четырех пациентов сохраняется контроль над заболеванием, они продолжают получать терапию. Медиана общей выживаемости достигла 12,5 месяца. Восемь пациентов живы, они перешагнули 24-месячный рубеж. Спектр нежелательных явлений незначительный. В большинстве случаев имела место гематологическая и негематологическая токсичность 1–2-й степени, серьезных нежелательных явлений не зафиксировано.
Заключение. Комбинация рамуцирумаба и паклитаксела характеризуется высокой эффективностью, приемлемым профилем токсичности и потенциально ассоциируется с высокой общей выживаемостью у пациентов с метастатическим раком желудка, прогрессирующим на фоне первой линии терапии.


Введение
Рак желудка занимает четвертое место в структуре заболеваемости среди злокачественных новообразований у мужчин (7,8%) и шестое – у женщин (4,8%), но в структуре смертности прочно удерживает вторую позицию (10,3%). У большинства пациентов (69,6%) на момент постановки диагноза обнаруживается поздняя стадия заболевания (III или IV), когда возможности лечения существенно ограничены. У 45% больных с локальной формой рака желудка, выявленной при первичной диагностике, в течение пяти лет диагностируются метастазы. У 85% пациентов регионарная форма прогрессирует и переходит в метастатическую [1, 2].
В отсутствие противоопухолевого лечения продолжительность жизни больных диссеминированным раком желудка колеблется от трех до пяти месяцев.
Целесообразность и эффективность лекарственной терапии при диссеминированном раке желудка, подтвержденные в рандомизированных исследованиях II–III фаз, сегодня не вызывают сомнения. По сравнению с оптимальным симптоматическим лечением химиотерапия достоверно увеличивает продолжительность жизни больных.
Перечень противоопухолевых препаратов, эффективных при раке желудка, включает фторпиримидины для перорального и парентерального использования, производные платины, таксаны, антрациклины, ингибиторы топоизомеразы I, а также препараты таргетной терапии. Эффективность каждого препарата в монорежиме не превышает 30%. Увеличение эффективности лекарственной терапии связано с использованием комбинированных, достаточно токсичных режимов (DCXF, TOFL, FOLFORINOX и др.). Химиотерапия первой линии диссеминированного рака желудка носит паллиативный характер. Эффект отмечается у 35–40% больных с медианой общей выживаемости от восьми до десяти месяцев [3].
К настоящему моменту накоплены данные о молекулярно-генетических изменениях при раке желудка (экспрессия PDGF-альфа, HER2, TGF-бета, EGFR, c-met и др.), что позволяет рассчитывать на эффективность таргетной терапии.
HER2 – рецептор EGF гиперэкспрессирован у 13–22% больных раком желудка, чаще при кишечном типе рака. При НER2-позитивном раке желудка общая эффективность химиотерапии увеличивается на 12% при добавлении трастузумаба, а медиана выживаемости – до 13,8 месяца (в контрольной группе – 11,3 месяца). Иная ситуация при раке желудка с HER2-негативным статусом (78–87%). Например, в исследовании AVAGAST добавление бевацизумаба к химиотерапии способствовало увеличению частоты объективного ответа и медианы выживаемости без прогрессирования (ВБП), но не влияло на медиану общей выживаемости.
Сегодня не существует зарегистрированных режимов второй линии. Актуальной остается проблема разработки новых таргетных системных препаратов для повышения эффективности лечения на поздних стадиях заболевания [4].
Пациентам со статусом 0–2 по шкале ECOG (Eastern Cooperative Oncology Group – Восточная объединенная группа онкологов), не отягощенным тяжелыми сопутствующими заболеваниями, рекомендована химиотерапия второй линии. Сравнение таксанов и иринотекана во второй линии химиотерапии показало их сопоставимую эффективность.
Рамуцирумаб – первый биологический препарат, который применяли в режиме монотерапии. В исследовании REGARD на фоне использования рамуцирумаба увеличивалась медиана выживаемости у пациентов с поздними стадиями аденокарциномы желудка и прогрессированием заболевания после первой линии химиотерапии [5]. Комбинация рамуцирумаба с паклитакселом, статистически значимо увеличивающая общую выживаемость по сравнению с режимом плацебо в комбинации с паклитакселом (исследование RAINBOW), может быть использована в качестве нового стандартного режима второй линии лечения при раке желудка поздних стадий [6].
Материал и методы
Набор пациентов в исследование, проведенное на базе Областного онкологического диспансера г. Иркутска, осуществлялся с 1 июня 2016 г. до 31 октября 2017 г. в рамках Всероссийской программы безвозмездной передачи препарата рамуцирумаб для оказания помощи больным раком желудка поздних стадий с прогрессированием заболевания на фоне или после предшествующей химиотерапии на основе производных платины и/или фторпиримидинов по жизненным показаниям.
Главными критериями включения в исследование стали возраст старше 18 лет, гистологически подтвержденный метастатический рак желудка, прогрессирование заболевания после первой линии химиотерапии, состояние на момент исследования по ECOG 0–1, лабораторные показатели без клинически значимых отклонений от нормы. В исследование не включались пациенты с плоскоклеточным раком желудка, циррозом печени, желудочно-кишечной перфорацией, свищами, артериальной тромбоэмболией в течение последних шести месяцев, любым значительным желудочно-кишечным кровотечением, значительной венозной тромбоэмболией на протяжении последних трех месяцев перед рандомизацией, плохо контролируемой артериальной гипертензией, метастатическим поражением центральной нервной системы.
Все участники исследования подписали информированное согласие. Индивидуальные планы лечения были подготовлены на общем мультидисциплинарном консилиуме диспансера и одобрены Министерством здравоохранения Российской Федерации.
Больные получали лечение по следующей схеме: рамуцирумаб 8 мг/кг в виде внутривенной инфузии в течение 60 минут один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1-й, 8-й и 15-й дни 28-дневного цикла. Лечение проводилось на фоне профилактической противорвотной и десенсибилизирующей терапии, инфузионной поддержки. Каждые две недели исследователи оценивали эффективность по результатам компьютерной томографии грудной клетки, брюшной полости и малого таза, эзофагогастродуоденоскопии с биопсией, а также по определению лечебного патоморфоза. Лечение продолжалось до прогрессирования заболевания или развития неприемлемой токсичности.
Объективный ответ оценивали на основании данных мультиспиральной компьютерной томографии с внутривенным контрастированием по критериям RECIST v.1.1 и данных эзофагогастроскопии с биопсией (фото в формате DICOM, определение лечебного патоморфоза в биопсийном материале). При анализе токсичности использовали критерии СТС AE v. 4. Определялись ВБП (время от регистрации до документального подтверждения прогрессирования) и общая выживаемость (время от регистрации до даты смерти от любой причины). Функцию выживаемости описывали методом Каплана – Майера.
Результаты
В исследование с 1 июня 2016 г. по 31 октября 2017 г. было включено 23 пациента в возрасте от 21 до 69 лет (средний возраст – 45 лет), из них 11 (48%) женщин и 12 (52%) мужчин. Проспективный анализ промежуточных результатов применения рамуцирумаба и паклитаксела у больных неоперабельным распространенным раком желудка во второй линии терапии подтвердил эффективность и безопасность данной лечебной опции в наблюдаемой популяции. Четыре пациента прекратили лечение из-за ухудшения общего состояния. На первом контрольном обследовании по критериям RECIST констатировано прогрессирование заболевания. Пациенты умерли спустя 1–3 недели после обследования. У 19 больных на контрольном обследовании после двух месяцев терапии зафиксирована стабилизация заболевания. Они продолжили лечение.
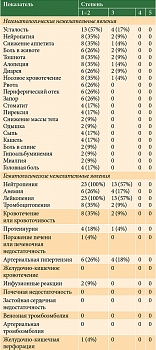
У всех пациентов при гистологическом исследовании выявлена аденокарцинома (G1 – 9%, G2 – 39%, G3 – 52%). Измеряемые очаги по критериям RECIST v.1.1 зарегистрированы у 12 (52%) больных. У 11 (48%) пациентов выявлены только неизмеряемые очаги. Время до прогрессирования заболевания на фоне первой линии терапии у 17 (74%) пациентов составило менее шести месяцев, у шести (26%) – более полугода. Наличие мутации HER2/neu имело место у одного пациента. Общее состояние всех больных (100%) расценивалось как удовлетворительное – ECOG 0–1. У 20 (87%) пациентов число органов метастазирования не превышало двух. У большинства пациентов (74%) диагностированы перитонеальные метастазы. Асцит выявлен в десяти (43%) случаях. В анамнезе гастрэктомию перенесли десять (43%) больных, 13 (57%) пациентов не были оперированы (табл. 1).
Пациенты получили от трех до 54 введений рамуцирумаба и от пяти до 81 введения паклитаксела (6–108 недель лечения, в среднем 57 недель). Пять введений рамуцирумаба с последующим контрольным обследованием получили все участники исследования. Четыре (17%) пациента продолжают получать терапию в прежнем объеме без коррекции доз препаратов с соблюдением режима введения. Результаты компьютерной томографии и эзофагогастродуоденоскопии показали в четырех случаях прогрессирование опухоли после 3–5 введений рамуцирумаба (6–10 недель терапии). 19 пациентов продолжили терапию рамуцирумабом 8 мг/кг в виде внутривенной инфузии в течение 60 минут один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1-й, 8-й и 15-й дни 28-дневного цикла.
По данным мультиспиральной компьютерной томографии в соответствии с критериями RECIST v.1.1 и эзофагогастродуоденоскопии, объективный ответ на терапию получен у 19 пациентов. Частичная регрессия достигнута у семи (30%) больных, еще у 12 (52%) – стабилизация. У четырех (18%) пациентов при первом контрольном обследовании после 6–10 недель терапии зарегистрировано прогрессирование заболевания. ВБП у четырех (18%) больных составила 24 месяца. Случаев полной регрессии опухоли не зафиксировано. Частичная регрессия опухоли заключалась в выраженном улучшении эндоскопической картины первичной опухоли по результатам эзофагогастродуоденоскопии и определению патоморфоза опухоли 4-й степени в биопсийном материале (рис. 1). Динамика в отношении перитонеальных метастазов отсутствовала.
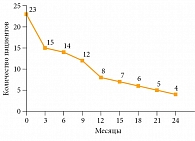
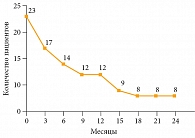
Медиана ВБП составила 9,5 месяца. Шестимесячная ВБП зарегистрирована у 14 (61%) пациентов, 12-месячная – у восьми (35%) (рис. 2). Медиана общей выживаемости составила 12,5 месяца. Общая выживаемость у 14 (61%) пациентов достигла шести месяцев, у 12 (52%) – 12 месяцев (рис. 3). На данный момент четыре (18%) пациента продолжают получать терапию, сохраняя контроль над опухолью. Продолжительность терапии превысила 24 месяца.
Четыре пациента умерли в течение 12 недель от начала терапии вследствие прогрессирования основного заболевания. Случаев гематологической и негематологической токсичности, приведших к отмене терапии, не отмечалось. Чаще имела место гематологическая токсичность. Нейтропения 1–2-й степени, обусловленная применением паклитаксела, зафиксирована у 23 (100%) пациентов. У шести (26%) больных наблюдалось развитие артериальной гипертензии, у восьми (35%) возникли носовые кровотечения, у четырех (18%) – протеинурия. Полный спектр токсичности представлен в табл. 2.
Обсуждение
Показатели ВБП и общей выживаемости значительно превысили показатели, которые обычно имеют место при проведении второй линии стандартной терапии метастатического рака желудка. Несмотря на использование разных комбинаций, объективные ответы не превысили 20–25%, а медиана продолжительности жизни – пяти-шести месяцев (от начала второй линии химиотерапии) [7]. Аналогичные результаты получены при использовании паклитаксела в монорежиме или в комбинациях с другими препаратами [8–13]. Еженедельное применение паклитаксела (60–80 мг/м2) характеризовалось меньшей токсичностью (нейтропения 3–4-й степени в 16–32% случаев) при одинаковом количестве объективных ответов (8–27%) по сравнению со стандартным трехнедельным режимом в серии японских исследований [9, 10]. На фоне применения паклитаксела в комбинациях с цисплатином отмечалась высокая частота нейтропении 3–4-й степени (до 34%) и периферической нейропатии 2–3-й степени (до 38%) [12, 13]. По сравнению с терапией других нозологий терапия рака желудка несколько отставала в плане внедрения в клиническую практику таргетных препаратов. Тем не менее сегодня рак желудка является одним из «полигонов», на которых испытывают новые варианты персонализированного лечения. В последнее время появляется все больше обнадеживающих результатов лечения этой агрессивной и рефрактерной к стандартной химиотерапии опухоли [14]. Отрицательные результаты исследования с использованием бевацизумаба не перечеркнули дальнейший интерес к изучению антиангиогенной терапии при раке желудка. Следующим препаратом этой серии стал рамуцирумаб – антагонист фактора роста эндотелия сосудов, связывающий рецептор VEGFR-2 и блокирующий лиганды рецептора VEGF-A, VEGF-C и VEGF-D. По сравнению с плацебо на фоне монотерапии рамуцирумабом статистически значимо улучшались показатели общей выживаемости (исследование REGARD). Рамуцирумаб статистически значимо увеличивал общую выживаемость у пациентов с аденокарциномой желудка или желудочно-пищеводного соединения поздних стадий и прогрессированием заболевания после первой линии химиотерапии. При использовании препарата в два раза снижался риск прогрессирования заболевания, а также риск смерти от любой причины. Преимущество рамуцирумаба по показателю выживаемости сохранялось практически во всех подгруппах пациентов. Влияние на показатели общей выживаемости было несколько ниже у женщин, однако расчетные значения ВБП у них были в пользу рамуцирумаба. После анализа влияния потенциальных расхождений в исходных характеристиках между лечебными группами преимущество рамуцирумаба в отношении общей выживаемости и ВБП после корректировки по другим прогностическим факторам оставалось без изменения. В данной популяции пациентов переносимость рамуцирумаба была хорошей. При этом частота большинства нежелательных явлений была одинаковой в группах рамуцирумаба и плацебо. Гипертензия – нежелательное явление, ассоциируемое с большинством антиангиогенных препаратов, чаще отмечалось в группе рамуцирумаба. Гипертензия 3-й степени наблюдалась у единичных пациентов, получавших рамуцирумаб. Данные о качестве жизни, согласно оценке пациентов, были скудными. Тем не менее эффект рамуцирумаба не уступал таковому плацебо. Более того, время до ухудшения оценки общего состояния было статистически значимо более продолжительным у пациентов, получавших рамуцирумаб [5]. Впоследствии положительными оказались результаты исследования фазы III по добавлению рамуцирумаба к паклитакселу во второй линии терапии рака желудка. Все это послужило основанием для регистрации в 2014 г. препарата для лечения больных метастатическим раком желудка [4, 15].
Рамуцирумаб в комбинации с еженедельным паклитакселом в отличие от других таргетных препаратов с антиангиогенным действием достоверно увеличивал частоту объективных ответов. В клиническом исследовании RAINBOW III фазы эффективность и безопасность рамуцирумаба и паклитаксела сравнивали с таковыми паклитаксела и плацебо. Добавление к терапии паклитакселом рамуцирумаба позволило добиться увеличения показателя средней выживаемости до 9,6 месяца. У пациентов, принимавших паклитаксел и плацебо, средняя выживаемость составила 7,4 месяца. Кроме того, на фоне терапии рамуцирумабом и паклитакселом снизился риск прогрессирования заболевания или смерти на 37% по сравнению с использованием паклитаксела и плацебо, ВБП увеличилась на 52% [6]. В настоящее время планируется исследование фазы III RAINFALL по применению рамуцирумаба в первой линии терапии рака желудка.
При выборе и проведении второй линии терапии метастатического рака желудка следует учитывать, что заболевание на этой стадии неизлечимо. Именно поэтому основными задачами лечения являются увеличение продолжительности и улучшение качества жизни больных (облегчение симптомов заболевания, профилактика и лечение осложнений терапии), сбалансированность терапевтического эффекта (в том числе выживаемости) и качества жизни.
Полученные нами данные о переносимости комбинированной терапии рамуцирумабом и паклитакселом демонстрируют хороший профиль безопасности и согласуются с данными исследования RAINBOW [6]. Данное исследование планируется продолжить. Это позволит получить более полные и подробные результаты применения рамуцирумаба и паклитаксела у больных неоперабельным распространенным раком желудка во второй линии терапии.
Заключение
Полученные данные позволяют предположить, что рамуцирумаб может стать важной составляющей лечения при аденокарциноме желудка или желудочно-пищеводного соединения поздних стадий у пациентов с прогрессированием заболевания после химиотерапии первой линии. По механизму действия и профилю токсичности рамуцирумаб существенно отличается от стандартных режимов химиотерапии при аденокарциноме пищевода и желудка. Полученные результаты подтверждают роль сигнальной активности VEGFR-2 как важной терапевтической мишени при аденокарциноме желудка или желудочно-пищеводного соединения поздних стадий [16].
D.Yu. Yukalchuk, D.M. Ponomarenko, T.N. Yukalchuk, Ye.A. Rybkina, S.S. Sidorova, Ye.V. Seredkin, G.N. Tepikina
District Oncologic Dispensary, Irkutsk
Contact person: Denis Yuryevich Yukalchuk, dyuyu558@mail.ru
Study objective – to examine efficacy and safety of ramucirumab and paclitaxel in patients with unresectable advanced gastric cancer in the second line therapy.
Material and methods. Patients were administered with 8 mg/kg ramucirumab via intravenous route, once a week, in combination with 80 mg/m2 paclitaxel via intravenous route on day 1, 8 and 15 of the 28-day protocol. Such therapy was continued until disease progression or drug intolerance.
Results. According to the final results of the research, the objective response to therapy in the form of partial regression was achieved in seven patients, for another 12 patients the stabilization was observed. The median progression-free survival was 9.5 months. Currently, four patients remain in control of the tumor process, they continue to receive therapy. The median overall survival reached 12.5 months. Eight patients are alive, they've overstepped the 24-month mark. The spectrum of adverse events is insignificant. In most cases, hematological and non-hematological toxicity of the 1st-2nd degree was observed; serious adverse events were not recorded.
Conclusions. A combination of ramucirumab and paclitaxel is characterized with high efficacy, acceptable toxicity profile and potentially associated with high total survival of patients with metastatic gastric cancer exhibiting progression during the first line therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.