Влияние техники введения препарата, качества иглы и частоты ее смены на компенсацию сахарного диабета
- Аннотация
- Статья
- Ссылки

В последние годы все больше внимания уделяется феномену глюкозотоксичности, который развивается как при СД 1 типа, так и при СД 2 типа. Очень часто СД называют пандемией ХХ-ХХI веков или «неинфекционной эпидемией». Прежде всего, это обусловлено тем, что несмотря на все новые знания, получаемые при изучении механизмов возникновения, развития и прогрессирования данного заболевания, распространенность его только увеличивается, и по прогнозам экспертов ВОЗ, например, количество больных с СД 2 типа должно удвоиться за период с 1997 по 2025 год с 143 до 300 млн человек (1). При этом сам факт установления диагноза СД 2 в среднем возрасте (40-49 лет) снижает ожидаемую продолжительность жизни не менее чем на 10 лет (2). В Российской Федерации на 1 января 2008 г. по данным Государственного Регистра зарегистрировано 2834000 больных СД. Однако истинная численность больных диабетом в 3-4 раза превышает официально зарегистрированную и составляет около 9,6 млн человек, а ежегодная заболеваемость СД составляет около 300000 человек. Не только распространенность СД, но и многочисленные его осложнения вызывают столь пристальное внимание врачей разных специальностей. Формирование микроангиопатий, макроангиопатий и полинейропатий происходят практически с момента дебюта данного заболевания. Развитию СД 2 типа предшествуют следующие состояния: нарушенная толерантность к глюкозе (НТГ) и нарушенная гликемия натощак (НГН). В настоящее время в мире не менее 300 млн человек имеют НТГ, а к 2025 году прогнозируется увеличение их числа по меньшей мере до 500 млн человек (3). При отсутствии профилактических мер как минимум у каждого третьего из них разовьется СД 2 типа. При выявлении данного заболевания уже у 50% пациентов имеются признаки сосудистых осложнений, таких как: ишемическая болезнь сердца (30%), поражение сосудов нижних конечностей (30%); ретинопатия (15%). Вместе с тем нарушения углеводного обмена влекут за собой и развитие гиперлипидемии, приводящей к прогрессированию атеросклероза и повышению АД. Необходимо учитывать, что заболевания сердечно-сосудистой системы в настоящее время являются главной причиной смертности населения, ведущее место среди которых принадлежит атеросклеротическому поражению коронарных, церебральных и периферических сосудов (4). Нельзя не сказать о частоте формирования нефропатии у данных пациентов. На момент постановки диагноза СД 2 типа микроальбуминурия выявляется у 30%; протеинурия – у 5-10%; терминальная стадия хронической почечной недостаточности составляет до 1%. В свою очередь, диабетическая нефропатия сопровождается 20-40 кратным повышением риска сердечно-сосудистой летальности (50). В последние годы отмечено нарастание случаев ХПН среди пациентов СД 2 типа. Это связано как с большим распространением данного типа диабета, так и более интенсивным и эффективным лечением АГ и ишемической болезни сердца (ИБС), на фоне чего увеличивается продолжительность жизни данных пациентов и они «доживают» до развития ДН и ХПН (6).
Более 10 лет назад завершилось исследование UKPDS (7), при анализе результатов которого Европейская группа по определению политики в лечении СД (European Diabetes Policy Group) ввела новые критерии компенсации СД, где идеальным критерием адекватного контроля с минимальным риском сосудистых осложнений был декларирован уровень HbA1c < 6,5%, при уровне глюкозы плазмы крови натощак (FPG) < 6 ммоль/л (8). Использование данных критериев позволяет не только своевременно выявлять СД, но и предотвращать развитие осложнений СД путем достижения идеальной и продолжительной компенсации углеводного обмена. С учетом этого крайне важным является адекватное ведение пациентов на всем протяжении заболевания, назначение терапии сразу с момента установления диагноза, и особое внимание необходимо уделять пациентам групп риска.
Всем пациентам с СД необходимо соблюдать рациональное питание с учетом потребности в углеводах, белках, жирах и индивидуальным учетом энергозатрат, контролем веса. Медикаментозная терапия прежде всего должна быть патогномонична.
Ведущим механизмом развития СД 1 типа является аутоиммунное поражение β-клеток с последующей их деструкцией и развитием абсолютного дефицита инсулина. Единственным препаратом лечения для данной категории больных является постоянная заместительная инсулинотерапия. На данный момент времени разработано несколько способов введения инсулина: с использованием одноразовых шприцов, шприц-ручек и инсулиновых дозаторов (помпы).
Патогенез развития СД 2 типа обусловлен двумя основными дефектами: снижением чувствительности периферических инсулинзависимых тканей к действию инсулина (инсулинорезистентность, ИР) и недостаточной (неадекватной) секрецией инсулина. ИР является генетически детерминированным процессом, который усугубляется по мере прогрессирования ожирения. В ответ на это проявляется неспособность инсулярного аппарата поджелудочной железы к адекватной продукции инсулина для преодоления ИР. У пациентов формируется сначала недостаточность, а позже отсутствие первой фазы секреции инсулина, физиологическая роль которой состоит в регуляции посталиментарной гипергликемии. Эти 2 процесса являются «звеньями одной цепи», так снижение чувствительности периферических тканей к инсулину, с одной стороны, стимулирует его секрецию, а с другой стороны за счет нарастания гипергликемии после еды приводит к феномену «глюкозотоксичности», снижающему секреторные возможности β-клеток. Гиперинсулинизм, направленный на преодоление гипергликемии, приводит к повышению аппетита, следовательно, к нарастанию массы тела, что усугубляет ИР и повышает потребность в секреции инсулина. С учетом достаточно сложного механизма развития СД 2 типа в 2008 году ведущими экспертами ADA (Американской диабетологической ассоциации) и EASD (Европейской ассоциации по изучению диабета) на основании данных рандомизированных исследований и на опыте ведущих диабетологов мира предложен новый алгоритм лечения данного заболевания (9), в который включены как пероральные, так и парентеральные сахароснижающие и антигипергликемические препараты. Большое внимание в настоящее время уделяется применению агониста ГПП-1(эксенатид) в комбинации с метформином. Данное сочетание препаратов позволяет воздействовать на основные патологические звенья СД 2 типа. Длительное применение самых изученных и известных препаратов из группы сульфонилмочевины (ПСМ) может приводить к истощению β-клеток и вызывать необходимость применения инсулинотерапии. Короткие курсы инсулинотерапии показаны пациентам с СД 2 типа, имеющим нормальный вес, с учетом положительного влияния данной терапии на функциональное состояние островкового аппарата. Инсулинотерапия при СД 2 типа набирает все большие обороты и в США, составляя приблизительно 40%, в России 5 лет назад – 10%, в настоящее время уже более 20% пациентов в нашей стране с СД 2 типа находятся на инсулинотерапии.
Использование парентерального пути введения препаратов предполагает выполнение четких и последовательных действий, направленных на соблюдение правил выполнения инъекций. От этого зависит как фармакодинамика, так и фармакокинетика препаратов, что очень важно для пациентов с СД. К сожалению, в настоящее время у большинства врачей нет достаточного понимания необходимости обучения пациентов тактике проведения парентеральной терапии. Часто приходится сталкиваться с тем, что обучение проводит средний медицинский персонал, не всегда дифференцирующий внутримышечный, подкожный и внутрикожный методы введения. Следствием этого являются, частые состояния гипогликемий и/или изменение времени начала и окончания действия препаратов, что недопустимо при коррекции углеводного обмена. Правильная методика выполнения инъекции является обязательным условием эффективного лечения сахарного диабета.
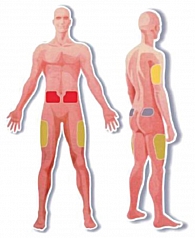
Прежде всего необходимо вспомнить оптимальные места введения парентеральных препаратов, корректирующих уровень гликемии (рисунок 1).
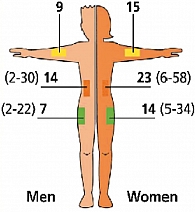
Одно из основных мест инъекций: бедра (верхняя наружная треть бедра). Необходимо отметить, что скорость всасывания инсулина из области бедра низкая. Область бедра – оптимальное место для введения средней пролонгации и продленных инсулинов. Ягодицы (внешний верхний квадрант ягодиц), где скорость всасывания инсулина низкая, поэтому оптимально для инъекций пролонгированного инсулина на ночь. Живот (передняя брюшная стенка), где самая высокая скорость всасывания инсулина из подкожно-жировой клетчатки, поэтому оптимально подходит для введения инсулинов короткого действия. Плечо (верхняя наружная треть), данная зона не рекомендуется для самостоятельных инъекций, так как подкожно-жировая клетчатка плеча тонкая и очень высок риск внутримышечного введения инсулина. Данные участи выбраны не случайно. Толщина подкожных тканей варьирует в зависимости от пола, участка тела и ИМТ пациента, в то время как толщина кожи отличается минимально (рисунок 2).
В часто используемых для инъекций участках подкожная жировая клетчатка может иметь небольшую толщину. Жирным шрифтом выделены средние значения, а в скобках указаны диапазоны (14, 15, 16, 17, 18, 19). Обследовав группу пациентов, включавшую 91 больного диабетом с нормальной массой тела, которым была выполнена компьютерная томография, Frid и Linde (20) установили, что среднее расстояние между кожей и мышечной фасцией в верхнем латеральном квадранте бедра (ключевое место для инъекций инсулина) составляет 7 мм у мужчин и 14 мм у женщин. У 91% мужчин и у 48% женщин 12,7 мм игла в данной области проникает в мышцу, если инъекция выполняется перпендикулярно коже без формирования приподнятой кожной складки. У 25% женщин и 44% мужчин толщина подкожного жира сбоку от пупка (область максимальной толщины жира на животе) составляет менее 12,7 мм. Более того, жировая прослойка быстро сужается в латеральном направлении даже у пациентов с ожирением, что делает боковые поверхности живота областями с наибольшей вероятностью введения инсулина в мышцу при инъекции из-за тонкого подкожного слоя. Данные особенности необходимо учитывать при выборе иглы для введения препарата.
Перед инъекцией необходимо осмотреть выбранный участок тела (21, 22). Прежде всего, кожные покровы должны быть чистыми. Протирать кожу спиртом необходимо, если участок кожи загрязнен или если пациент находится в условиях, благоприятствующих заносу инфекции с рук выполняющего укол (например, в больнице). При этом проводить инъекцию следует только после полного высыхания спирта на коже (23). Для многих пациентов важно иметь возможность проводить инъекцию через одежду. Принципиально это возможно, такие инъекции не сопровождаются неблагоприятным исходом, но тот факт, что при выполнении инъекции нельзя собрать кожную складку или рассмотреть участок введения, делает такую методику далекой от оптимальной (24).
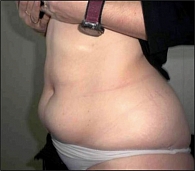
Осмотр участка, планируемого для проведения инъекции, позволяет выявить липогипертрофии. Данные изменения представляют собой утолщенное «каучукообразное» поражение подкожных тканей, которое возникает практически у половины пациентов, применяющих инсулин. У некоторых пациентов поражение может быть плотным или шрамообразным (25, 26). Факторами риска развития липогипертрофий являются: применение инсулина (p = 0,001), игнорирование чередования областей инъекций (p = 0,004) и многократное использование одноразовых игл для инъекций (p = 0,004), приводящее к формированию хронической травмы «тупой» иглой подкожной клетчатки и к развитию хронического воспаления с формированием очагов (рисунок 3) (27).
Характерной чертой измененной кожи при данном состоянии является то, что нормальную кожу можно плотно ущипнуть, а при липогипертрофическом поражении это сделать невозможно (28). Пациентам не следует выполнять инъекции в области липогипертрофии, так как всасывание инсулина может быть замедленным или неравномерным, что потенциально может усугубить течение диабета и явиться причиной неудовлетворительного контроля уровня глюкозы в крови (29, 30, 31, 32). Были проведены исследования, в которых показано, что максимальная концентрация aspart (Novolog®, NovoRapid®) на 25% ниже при введении в область липогипертрофии (33). Кроме того, инъекции в область липогипертрофии могут усилить ее выраженность. Массирование участка инъекции перед процедурой и после выполнения процедуры может ускорить всасывание и в целом не рекомендуется (21, 22, 34).
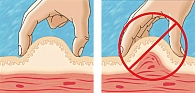
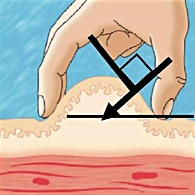
Правильное формирование кожной складки позволяет избежать попадания препарата в мышечную ткань и является эффективным средством правильного выполнения подкожной инъекции. На рисунке 4 представлены правильный (слева) и неправильный (справа) способы формирования кожной складки (15).
Правильную кожную складку собирают при помощи большого и указательного пальцев (с возможным добавлением среднего пальца). Собирание кожной складки при помощи всей руки сопровождается риском захвата мышцы вместе с подкожными тканями и может привести к внутримышечной инъекции. Не следует сжимать кожу слишком сильно, то есть до ее побледнения или появления боли. Избегайте сдавливания или смещения кожи во время инъекции, так как игла может проникнуть глубже, чем надо, и проткнуть мышцу. Собрать кожную складку на ногах или животе сравнительно легко (за исключением очень толстых тугих животов), но гораздо сложнее это сделать в области ягодиц (здесь редко возникает в этом необходимость) и практически невозможно (для пациентов, выполняющих инъекции самостоятельно) правильно проделать эту манипуляцию на руках. Верхние конечности для инъекций следует использовать только при условии формирования кожной складки. Верхние конечности не рекомендуется использовать в качестве области инъекции при самостоятельном выполнении манипуляции, так как одновременное собирание кожной складки и введение иглы в данном случае невозможно.
При собранной и приподнятой кожной складке иглу можно вводить под углом 90 градусов к плоскости поверхности кожи, но с сохранением угла в 45 градусов по отношению к плоскости конечности или живота, как показано на рисунке 5. Оптимальная последовательность введения препарата (инсулин, Баета):
- соберите кожную складку;
- медленно введите препарат;
- задержите иглу в коже на 10 секунд (при использовании шприц-ручки);
- извлеките иглу из кожи;
- расправьте кожную складку;
- безопасно отсоедините использованную иглу.
Всех пациентов необходимо обучать правильной технике формирования кожной складки с самого начала лечения парентеральными корректирующими гликемию препаратами.
Качество и длина иглы играют немаловажную роль в надежной доставке действующего вещества в подкожное пространство без обратного его вытекания. Иглы фирмы BD Микро-Файн Плюс®, прежде всего, имеют универсальную резьбу, что обеспечивает совместимость игл со всеми шприц-ручками. Кроме того, увеличенный внутренний просвет иглы позволяет уменьшить силу давления на поршень шприц-ручки, увеличивая скорость введения инсулина. Тройная заточка острия иглы и уникальная геометрия делают инъекцию менее травматичной. Лазерная обработка хирургической стали обеспечивает гладкую и ровную поверхность иглы. Финальное электрополирование в гальванических ваннах удаляет все мелкие фрагменты с поверхности иглы. Патентованное «Бектон Дикинсон» силиконовое покрытие наружной и внутренней поверхности иглы делает инъекцию менее болезненной.
Но как бы ни была высокотехнологична игла, при повторном использовании на ней происходят значимые изменения, что продемонстрировано на рисунке 6. При повторном использовании прежде всего происходит кристаллизация вводимого препарата, что может привести к закупорке просвета иглы и/или поломке механизма шприц-ручки, таким образом изменив количество вводимого препарата, и вызвать «ложную» необходимость проведения коррекции проводимой терапии. За счет деформации острия иглы и стирания силиконового покрытия возникает боль во время инъекции, происходит откалывание кончиков игл и травмирование тканей деформированным кончиком иглы, приводящее к развитию липодистрофий.
Через оставленную накрученную на картридж иглу может происходить дополнительное выделение препарата, попадание воздуха и других элементов внутрь шприц-ручки, что увеличивает риск развития инфекции в местах проведения инъекции. Основная цель инъекционного введения инсулина/аналогов GLP-1/агонистов амилина заключается в надежной доставке действующего вещества в подкожное пространство без обратного его вытекания, а также с минимальными болевыми ощущениями и дискомфортом. Основным условием достижения данной цели является выбор иглы подходящей длины. Ряд проведенных исследований подтвердили эквивалентную эффективность и безопасность/переносимость игл с наиболее короткой длиной (5 и 6 мм) и игл с длиной 8 мм и 12,7 мм. Выбор длины иглы является индивидуализированным совместным решением пациента и его/ее врача, принимаемым с учетом множества факторов, включая физические, фармакологические и психологические (35, 36).
Начиная с 2004 года проведен ряд исследований с целью оценить фармакодинамику, фармакокинетику и удобство применения различных игл.
Schwartz (37) опубликовал данные двойной слепой оценки боли и выраженности обратного истечения препарата, а также простоты применения, свидетельствующие о том, что при применении 31 G x 6 мм и 29 G x 12,7 мм игл были получены сопоставимые показатели уровней HbA1c. Тем не менее пациенты отдали предпочтение 6 мм иглам. В 2006 г. Frid (38) опубликовал результаты десятилетнего исследования по клиническому применению коротких игл. Он пришел к выводу, что 5 и 6 мм иглы очень хорошо подходят на роль стандартных игл для инъекций, особенно благодаря тому, что нет как таковой проблемы с обратным истечением инсулина. Кроме того, в работе указывается на то, что правило выполнения инъекции в приподнятую кожную складку также распространяется и на эти иглы. Нельзя не отметить две работы 2007 года. В своей работе Kreugel (39) сравнивал применение игл 8 или 12 мм при применении игл длиной 5 мм. Отмечено, что уровень HbA1с не меняется, частота развития гипогликемических состояний не меняется и, что очень важно, пациенты отметили уменьшение дискомфорта при использовании более коротких игл. Hofman и соавт. продемонстрировали, что применение 8 мм и 12,7 мм игл у детей сопровождается более частым попаданием инсулина в мышцу, что приводит к развитию гипогликемических состояний. А проведение инъекций наклоненной 6 мм иглой позволяет добиться достаточного накопления препарата в подкожном жире. В 2008 году Birkebaek (40) показал, что у худых пациентов применение 4 мм игл при введении доз инсулина < 40 МЕ снижается риск внутримышечного введения препарата, не увеличивается количество инсулина, вытекающего обратно на поверхность кожи. Он пришел к выводу, что большинство пациентов могут выполнять инъекции 4 мм иглами в области бедра под углом 90 градусов, не собирая при этом кожную складку. При применении этими пациентами 6 мм игл авторы предлагают выполнять инъекции в кожную складку под углом 45 градусов. В последнем завершившемся исследовании In’Obese – двухфазное перекрестное клиническое сравнительное испытание игл длинною 5 мм и 8 мм, в котором участвовали 126 пациентов (из 130 включенных в исследование), находящихся на инсулинотерапии и имеющих ожирение (ИМТ ≥ 30 кг/м²). Отмечено, что уровни HbA1c в обоих периодах не различались, а разница в количестве пациентов, отмечавших кровотечение, образование синяков, обратное истечение препарата и боль, была небольшой, если вообще была. Немногим большее количество пациентов отдали предпочтение более коротким 5 мм иглам.
Какие же общие правила можно рекомендовать пациентам, использующим парентеральные препараты для достижения нормогликемии? Во-первых, необходимо учитывать толщину кожи и подкожно-жировой клетчатки. Как было отмечено ранее, она разная и в разных возрастных группах, имеет половые различия и зависит от ИМТ. Во-вторых, желательно ориентировать пациентов на введение препарата с соблюдением правил, т.е. формирование кожной складки и соблюдение угла наклона при проведении инъекции в зависимости от зоны введения. При этом формирование приподнятой кожной складки должно стать привычкой для большинства, если не всех пациентов. Это является рентабельной (бесплатной) гарантией против случайных внутримышечных инъекций. И последнее, оптимальным является применение игл ≤ 8 мм у взрослых и менее 8 мм у детей. В настоящее время убедительно доказано, что эти более короткие иглы обладают доказанной безопасностью и эффективностью, обуславливают большое количество благоприятных клинических исходов и пользуются большей популярностью среди пациентов. Чрезвычайно важно менять иглу перед каждой инъекцией не только с целью исключения травмы, боли, формирования липодистрофии, но и с целью хорошего гликемического контроля.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.