Внежелудочные проявления инфекции Helicobacter pylori. 93-я Международная весенняя сессия Национальной школы гастроэнтерологов, гепатологов РГА. «Большая академическая гастроэнтерология – 3»
- Аннотация
- Статья
- Ссылки
Инфекция Helicobacter pylori и патология крови
Самое распространенное последствие инфицирования H. pylori – дефицит железа. Он возникает прежде всего из-за хронической кровопотери при эрозивном гастрите, язвенных дефектах, раке, дефектах слизистой оболочки желудка при MALT-лимфоме. Другой механизм развития дефицита железа схож с механизмом развития анемии при хроническом заболевании. Повышается синтез гепсидина (пептида, регулирующего всасывание железа), в результате чего на уровне энтероцитов блокируются всасывание железа и его повышенное депонирование в макрофагах. Причиной развития дефицита железа может быть снижение всасывания негемового железа (железа из растительных продуктов) на уровне энтероцитов – ахлоргидрия.
Железо – жизненно необходимый микроэлемент для организма человека. Железо является основным компонентом гемоглобина и миоглобина – белка миоцитов (клеток мышечной ткани). Железосодержащие белки участвуют в процессе метаболизма коллагена, тирозина и катехоламинов. Железо как компонент некоторых ферментов (в митохондриальной дыхательной цепи, цитратном цикле, синтезе ДНК) способствует реализации основных метаболических процессов.
Метаболизм железа в организме представляет один из самых высокоорганизованных процессов. Сбалансированная ежедневная диета взрослого человека содержит около 20 мг железа, но всасывается лишь 1–2 мг в сутки. Основное место всасывания – верхние отделы тонкого кишечника. Обмен железа в организме состоит из нескольких этапов: всасывание в желудочно-кишечном тракте (ЖКТ), транспорт, внутриклеточный метаболизм, утилизация и реутилизация, экскреция из организма.
Железо входит в состав многих ферментов (цитохромы, пероксидазы, сукцинатдегидрогеназа и др.). Дефицит указанных ферментов при недостатке железа у больных, инфицированных H. pylori, способствует развитию не только анемии, но и тканевой сидеропении (дефициту железа в тканях).
Органами-мишенями при сидеропеническом синдроме являются кожа, ЖКТ, нервная система, сердечно-сосудистая система, мышечная ткань. Пациенты с сидеропеническим синдромом жалуются на расстройство глотания, чувство жжения в языке, спазм пищевода, что является следствием атрофии слизистой оболочки рта, глотки, пищевода с дисфагией. Симптомами сидеропенического синдрома также являются извращение вкуса, выражающееся в непреодолимом желании употребить в пищу что-либо необычное и малосъедобное (мел, зубной порошок, глину, сырое тесто, мясной фарш), пристрастие к острой, соленой, кислой, пряной пище, извращение обоняния (пристрастие к острым, неприятным запахам, например, бензина, ацетона, лака, нафталина).
При проведении лабораторных исследований крови пациентов с сидеропеническим синдромом выявляются изменения, характерные для гипохромной микроцитарной анемии.
Лицам с железодефицитной анемией показана терапия препаратами железа. Оценивая эффективность терапии железодефицитной анемии препаратами железа, следует помнить, что это длительный процесс. На 7–10-й день терапии увеличивается количество ретикулоцитов в крови. На 3–4-й неделе наблюдается прирост гемоглобина и числа эритроцитов. На 4–8-й неделе терапии у больных исчезают гипохромия и микроцитоз, показатели красной крови приходят в норму. Только после 4–6 месяцев лечения железодефицитной анемии у пациентов нормализуются показатели качества жизни.
Еще одной интересной темой для рассмотрения является развитие В12-дефицитной анемии. Это заболевание обусловлено нарушением кроветворения (образования клеток крови) вследствие дефицита в организме витамина В12. При В12-дефицитной анемии характерно поражение кроветворной и нервной систем, ЖКТ.
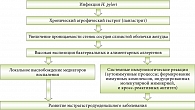
Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический. По данным исследований, антисекреторные препараты могут ускорять прогрессирование гастрита, ассоциированного с H. pylori. Эрадикация H. pylori у пациентов, длительно получающих ингибиторы протонной помпы (ИПП), способствует устранению воспаления и предотвращает прогрессирование гастрита до атрофической формы1.
Атрофический гастрит, связанный с инфекцией H. pylori, – первая причина B12-дефицитной анемии (пернициозная анемия). Для пернициозной анемии характерно появление антител к париетальным клеткам желудка и антител к внутреннему фактору. При В12-дефицитной анемии поражается система кроветворения, развиваются анемический синдром, связанный с основным заболеванием, а также компонентом гемолиза, тромбоцитопения, лейкопения, гиперсегментация ядер нейтрофилов, ретикулоцитопения.
При прогрессирующей В12-дефицитной анемии возможно поражение нервной системы. Развивается фуникулярный миелоз, который сначала проявляется демиелинизацией, а затем дегенерацией нервных волокон в спинном мозге и спинномозговых нервах. Клиническими симптомами поражения нервной системы при пернициозной анемии могут быть слабость в ногах, ощущение мурашек, снижение сухожильных рефлексов, парапарезы, нарушения функций тазовых органов. Для лечения В12-дефицитной анемии больным назначают препараты витамина В12 (цианокобаламин). Непременным условием лечения В12-дефицитной анемии при обнаружении инфекции H. pylori является эрадикация возбудителя.
В последние годы исследователи доказали, что H. pylori играет роль в развитии идиопатической тромбоцитопенической пурпуры (первичная иммунная тромбоцитопения) – аутоиммунном заболевании, характеризующемся низким количеством тромбоцитов в периферической крови (менее 100 × 109/л). Заболевание клинически проявляется петехиально-пятнистым (синячковым) типом, может быть острым и хроническим, первичным и вторичным. Иммунная тромбоцитопения чревата грозными геморрагическими осложнениями, которые проявляются кровоточивостью, кожными изменениями, кровоизлияниями во внутренние органы с серьезными кровотечениями2.
Как правило, диагноз идиопатической тромбоцитопенической пурпуры ставится методом исключения. При этом заболевании все показатели клинического анализа крови, кроме уровня тромбоцитов, остаются в пределах нормы. Для диагностики необходимо исключить заболевания, сопровождающиеся вторичной иммунной тромбоцитопенией (системные заболевания соединительной ткани, дебют хронического лимфопролиферативного заболевания, антифосфолипидный синдром, вирусные инфекции и инфицирование H. pylori).
Результаты исследований показали, что аминокислоты вирулентных факторов VacA, CagA и уреаза B, содержащиеся на поверхностной мембране H. pylori, схожи по антигенному составу с гликопротеином IIIA и другими антигенами, представленными на поверхности тромбоцитов. Бактерии рода Helicobacter воздействуют на Fc-рецепторы моноцитов/макрофагов, что приводит к их активации и срыву иммунологической толерантности в отношении антигенов тромбоцитов3.
Таким образом, в скрининг на наличие первичной иммунной тромбоцитопении обязательно входит тест на определение H. pylori.
Еще одно заболевание, связанное с контаминацией H. pylori, – MALT-лимфома – опухоль, развивающаяся из лимфоидной ткани, ассоциированной со слизистыми оболочками. Чаще при MALT-лимфоме поражается желудок, реже – кишечник, легкие, кожа и орбита глаз. Сегодня известно, что Н. pylori играет особую роль в развитии подгруппы лимфом желудка MALT-типа. Использование эрадикационной антихеликобактерной антибиотикотерапии на ранних стадиях MALT-лимфом желудка приводит к регрессии лимфомы и длительной ремиссии болезни у большинства пациентов.
Для предотвращения развития тяжелых осложнений, в том числе гематологических, при заболеваниях, ассоциированных с H. pylori, надо своевременно начать лечение одной из принятых схем эрадикации. При хроническом атрофическом гастрите после курса эрадикационной терапии целесообразно продолжить терапию препаратами висмута трикалия дицитрата (Де-Нол®) в течение 4–8 недель для обеспечения защиты слизистой оболочки желудка. Следует отметить, что висмута трикалия дицитрат обладает выраженными антибактериальными свойствами в отношении инфекции H. pylori, блокирует синтез аденозинтрифосфата в бактериальной клетке4, 5.
В заключение Е.А. Стадник отметила, что правильно подобранные антибиотики – залог успеха эрадикационной терапии. Препарат Флемоксин Солютаб® содержит амоксициллин в форме, обеспечивающей практически полное его всасывание при минимальном неблагоприятном воздействии на кишечник.
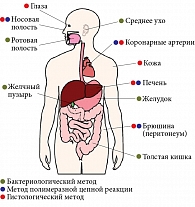
Наиболее частые внежелудочные патологии, ассоциированные с инфекцией Helicobacter pylori
В настоящее время активно исследуется патогенетическая роль инфекции H. pylori в развитии экстрагастродуоденальных заболеваний и состояний (рис. 1 и 2). В ряде исследований показано, что бактерии H. pylori могут колонизировать не только желудок. С использованием различных методов диагностики микроорганизм был обнаружен в тканях печени, желчном пузыре, толстой кишке, коже, артериях, носовой, ротовой полостях и даже в глазах. Однако исследования в этой области продолжаются. Окончательные выводы пока делать рано6. Вопрос об истинной роли H. pylori в развитии патологических изменений в организме человека остается открытым.
Последнее время проведено большое количество исследований связи инфекции Н. pylori с различными экстрагастродуоденальными заболеваниями. В ряде исследований оценивали роль H. рylori в патогенезе сердечно-сосудистых заболеваний. Метаанализ данных 26 исследований, посвященных роли H. pylori в развитии острого коронарного синдрома и нарушении ритма сердца, продемонстрировал, что у H. рylori-инфицированных лиц статистически достоверно выше риск развития инфаркта миокарда, особенно в молодой популяции7.
Изучены механизмы развития аденомы толстой кишки и колоректального рака при сочетании с H. pylori. Результаты метаанализа 27 исследований показали, что инфекция H. pylori ассоциирована с повышенным риском развития этих заболеваний8.
В другом метаанализе выявлен риск развития колоректального рака при инфицировании высокопатогенными штаммами H. pylori9.
В ряде исследований установлена взаимосвязь между детекцией H. pylori и повышенным риском развития гепатоцеллюлярной карциномы и рака поджелудочной железы.
В настоящее время изучается взаимосвязь аутоиммунных и инфекционных факторов при развитии аутоиммунного панкреатита. По данным исследований, у 95% пациентов с аутоиммунным панкреатитом обнаружены антитела к белкам H. pylori.
В экспериментальных исследованиях подтверждена гомология между бактериальным белком альфа-карбоангидразой и человеческой карбоангидразой II типа эпителия протоков поджелудочной железы. Это позволяет предположить потенциальное участие возбудителя инфекции H. pylori в патогенезе аутоиммунного панкреатита10.
Доказана роль бактерий H. pylori в качестве фактора развития дерматологических заболеваний. В литературе описаны хронические формы спонтанной крапивницы, обусловленной инфекцией H. pylori.
Результаты исследования с участием 300 пациентов с псориазом продемонстрировали, что 100% пациентов с умеренной и тяжелой степенью псориаза были инфицированы H. pylori, тогда как в группе больных с легкой степенью псориаза этот показатель составил 37%. Эрадикация возбудителя приводила к более быстрому регрессу симптоматики псориаза, хотя и не у всех пациентов11.
Существует еще ряд заболеваний и состояний, которые, по мнению некоторых авторов, связаны с H. pylori. В их числе сахарный диабет, инсулинорезистентность и метаболический синдром.
Систематический обзор, опубликованный в 2011 г., показал наличие корреляционной взаимосвязи между инфекцией H. pylori и инсулинорезистентностью. Оказалось, что распространенность инфекции у пациентов с сахарным диабетом на 15% выше, чем в контрольных группах. Связь между инфицированием H. pylori и развитием метаболического синдрома подтверждается в ряде работ. Отмечается высокая частота выявления инфекции H. pylori у пациентов с метаболическим синдромом12.
Инфекция H. pylori способна повышать риск развития патологии беременности. Так, в исследовании, проведенном с участием 62 беременных, установлена корреляция между серопозитивностью к H. pylori и развитием преэклампсии. Наличие инфекции H. pylori может служить независимым фактором риска ограничений внутриматочного развития, а также стать причиной замедленного развития плода. При этом наиболее высокий риск развития осложнений имели лица, инфицированные CagA+ штаммами H. pylori13.
На сегодняшний день антибактериальные препараты признаны основными компонентами схем эрадикационной терапии инфекции H. pylori. Как известно, основная причина низкой эффективности эрадикационных схем связана с ростом антибиотикорезистентных штаммов H. pylori, обусловленным применением нерациональных методов терапии, в том числе некачественных препаратов.
Амоксициллин (Флемоксин Солютаб®) – один из наиболее эффективных антибактериальных препаратов, применяемых при Н. pylori-ассоциированных заболеваниях. Благодаря особой технологии Флемоксин Солютаб® быстро всасывается и создает в крови концентрацию амоксициллина, сопоставимую с концентрацией при парентеральном введении препарата14. Механизм воздействия амоксициллина на Н. pylori заключается в ингибировании процессов синтеза в мембране бактериальной клетки пенициллин-связывающих белков.
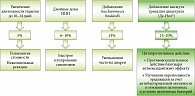
Еще одним эффективным методом терапии пациентов, инфицированных Н. pylori, является применение висмута трикалия дицитрата. Согласно рекомендациям РГА, в целях оптимизации эффективности эрадикационного протокола показано добавление висмута трикалия дицитрата к стандартной тройной терапии первой линии. Эффективность добавления висмута трикалия дицитрата (Де-Нол®) в разные схемы терапии больных с Н. pylori-инфекцией показана в многочисленных исследованиях (рис. 3)15–18.
Таким образом, в настоящее время имеются доказательства потенциальной ассоциации инфекции Н. pylori с развитием ряда экстрагастродуоденальных заболеваний. Результаты исследований, посвященных внежелудочным проявлениям инфекции H. pylori, подтвердили предположение о ее патогенетической роли при многих распространенных заболеваниях. Изучение возможной связи инфекции Н. pylori с генезом различных экстрагастродуоденальных заболеваний продолжается.
Клинические разборы пациентов с Helicobacter pylori-ассоциированными внежелудочными заболеваниями
Клинический случай 1. Пациентка 58 лет. С 13 лет страдает носовыми кровотечениями. Были жалобы на петехиальные кровоизлияния на коже и носовые кровотечения. Отмечался пониженный уровень тромбоцитов. В Центре гематологии ей был установлен диагноз «болезнь Верльгофа», проведено лечение преднизолоном. В возрасте 16 лет после очередного сильного носового кровотечения пациентку госпитализировали в стационар, где провели спленэктомию. После операции отмечалось резкое повышение уровня тромбоцитов с его дальнейшей нормализацией. На протяжении 15 лет пациентка чувствовала себя удовлетворительно. В 1977 г. ее экстренно госпитализировали в одну из центральных районных больниц Подмосковья в связи с желудочно-кишечным кровотечением. Рентгенологическое контрастное исследование желудка не выявило источник кровотечения. С 1980 г. периодически, около одного раза в год-два, у пациентки возникают серьезные носовые кровотечения, требующие тампонады с андроксоном. Больной был назначен курс преднизолона 180 м/сут струйно с постепенным снижением дозы в течение 18 дней. С 1990 по 1993 г. у нее ежегодно возникали желудочно-кишечные кровотечения. В 1990 г. больной впервые провели эзофагогастродуоденоскопию (ЭГДС) желудка и диагностировали язву луковицы двенадцатиперстной кишки как причину кровотечения. Впоследствии кровотечения возникали с интервалом в пять лет.
В 2005 г. пациентка поступила в Клинику пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко. Клинический диагноз: язвенная болезнь двенадцатиперстной кишки вне обострения, рецидивирующие желудочно-кишечные кровотечения, идиопатическая тромбоцитопеническая пурпура, состояние после спленэктомии в 1963 г. Больной проведен тест на инфекцию H. pylori с биоптатом антрального отдела желудка. Результат положительный.
Пациентке назначили стандартную десятидневную эрадикационную терапию: омепразол 40 мг/сут, кларитромицин 1 г/сут, амоксициллин (Флемоксин Солютаб®) 2 г/сут. Терапию пациентка перенесла удовлетворительно, без субъективных неприятных ощущений, но при лабораторных исследованиях отмечалось снижение уровня тромбоцитов в крови. Через шесть недель после проведения эрадикационной терапии H. pylori у пациентки с осложненным течением язвенной болезни и идиопатической тромбоцитопенической пурпурой нормализовался уровень тромбоцитов, наблюдались ремиссия язвенной болезни и отсутствие желудочно-кишечных кровотечений.
Состояние больной в течение пяти лет после эрадикационной терапии стабильное.
Клинический случай 2. Пациент 65 лет. Предъявлял жалобы на боли в эпигастрии без четкой связи с приемом пищи, боли тупого характера в правом подреберье, отрыжку воздухом, вздутие живота. В январе 2010 г. ему проведена ЭГДС, по результатам которой сделано заключение о гастродуодените. В ноябре 2010 г. при проведении повторной ЭГДС выявлен гастрит с лимфоидной гиперплазией, ассоциированный с H. pylori. В Клинике пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко пациенту проведена десятидневная стандартная тройная эрадикационная терапия (рабепразол, амоксициллин (Флемоксин Солютаб®), кларитромицин), усиленная препаратом висмута трикалия дицитрата (Де-Нол®). По окончании терапии больному провели контрольный дыхательный тест на определение эффективности эрадикационной терапии. Результат теста в январе 2011 г. отрицательный. В связи с отягощенным семейным анамнезом (отец умер от рака желудка) и наличием атрофического гастрита пациент остался под наблюдением врача и приглашался на контрольные госпитализации. В 2013 г. при клиническом исследовании крови пациента при нормальном уровне эритроцитов и гемоглобина наблюдались повышенный цветовой показатель (1,03) и достаточно большой средний объем эритроцитов. После изучения анамнеза больного было установлено, что цветовой показатель, средний объем эритроцитов повышены на протяжении трехлетнего наблюдения за пациентом. Как правило, в такой ситуации подозревают в первую очередь аутоиммунный гастрит как причину В12-дефицита. Уровень фолиевой кислоты у пациента в норме, сывороточного витамина В12 снижен до 128 пмоль/л. Антитела к париетальным клеткам желудка в норме, антитела к внутреннему фактору отсутствуют. Короткий курс инъекций витамина В12 позволил нормализовать показатели красной крови и уровень витамина В12.
Пациенту проведена ЭГДС без особых эндоскопических находок. При ультразвуковом исследовании органов брюшной полости обнаружен билиарный сладж. При колоноскопическом исследовании у пациента выявлены единичные дивертикулы сигмовидной кишки без признаков дивертикулита. Проведен водородный дыхательный тест – синдром избыточного бактериального роста исключен. Результаты эндоскопических и морфологических исследований на протяжении четырех лет продемонстрировали, что у пациента выраженная атрофия и кишечная метаплазия антрального отдела желудка.
В последние годы для стратификации риска развития рака желудка применяют систему прогноза атрофического гастрита OLGA (Operative Link for Gastritis Assessment). Согласно оценке гистологических признаков выраженности воспаления и атрофии в антральном отделе и теле желудка у пациента степень и стадия хронического гастрита соответствуют 3-й стадии атрофии. Пациенты с 3–4-й стадией атрофии относятся к группе высокого риска развития рака желудка. Таким образом, пациента необходимо наблюдать после успешной эрадикационной терапии, а дефицит витамина В12 трактовать как проявление хронического атрофического гастрита, индуцированного инфекцией H. pylori.
Заключение
В эрадикационные терапевтические схемы для лечения заболеваний, ассоциированных с H. pylori, входят различные лекарственные средства. Основными из них являются антибактериальные препараты и гастропротекторы (висмута трикалия дицитрат).
Препарат Де-Нол® (компания-производитель «Астеллас») содержит висмута трикалия дицитрат. Он оказывает защитное действие на слизистую оболочку желудка и двенадцатиперстной кишки.
Де-Нол® обладает бактерицидной активностью в отношении H. pylori, противовоспалительным и гастропротективным действием. Даже при длительном применении препарата Де-Нол® H. pylori не вырабатывает устойчивость к нему. Именно на оригинальном препарате Де-Нол® были проведены исследования, результаты которых подтвердили эффективность и безопасность лечения различных заболеваний ЖКТ.
Флемоксин Солютаб® (амоксициллин) (компания-производитель «Астеллас») является антибактериальным средством с широким спектром действия. Это один из наиболее эффективных антибиотиков, применяемых при Н. pylori-ассоциированных заболеваниях. Флемоксин Солютаб® относится к группе бета-лактамных антибиотиков, подгруппе аминопенициллинов. При низких значениях рН амоксициллин сохраняет высокую активность. Таблетка препарата состоит из отдельных микрогранул, заключенных в наполнитель. Под воздействием жидкости действующее вещество высвобождается в зоне максимального всасывания в кишечнике, что обеспечивает более равномерное и максимально полное всасывание активных компонентов препаратов при меньшем количестве побочных эффектов со стороны ЖКТ.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.