Возможности медикаментозной коррекции диабетической полинейропатии
- Аннотация
- Статья
- Ссылки
- English
В настоящее время распространенность сахарного диабета типа 2 приобрела характер неинфекционной эпидемии. Так, по данным Международой диабетической федерации (International Diabetes Federation – IDF), количество больных сахарным диабетом в 2015 г. составило 415 млн, к 2040 г. оно может увеличиться до 642 млн [1].
В 2015 г. умерло более 5 млн человек, страдающих сахарным диабетом. Необходимо отметить, что смертность от сердечно-сосудистых заболеваний среди пациентов с сахарным диабетом типа 2 в три раза выше, чем в целом в популяции. При этом в 80% случаев ее причиной становится атеросклеротическое поражение коронарных, церебральных и периферических сосудов.
Кроме того, пациенты с сахарным диабетом занимают первое место по числу нетравматических ампутаций нижних конечностей по поводу гангрены. Последняя – результат хронических язв стопы на фоне прогрессирования полинейропатии и атеросклероза периферических артерий.
Диабетическая полинейропатия (ДПН) относится к наиболее частым осложнениям сахарного диабета. Ее распространенность прямо коррелирует с длительностью заболевания. Выявляемость ДПН зависит от диагностических тестов. Так, у пациентов с длительностью сахарного диабета более 20 лет она варьирует от 50 (при клиническом обследовании) до 90–100% (при проведении электромиографического исследования).
ДПН резко снижает качество жизни больных, приводит к ранней инвалидизации и становится причиной внезапной смерти.
Пусковым механизмом поражения сосудистого русла и периферической нервной системы на сегодняшний день считается гипергликемия.
Нарушение чувствительности периферических нервов – наиболее частая форма ДПН. При этом отмечается болевой синдром, возникающий в симметричных участках конечностей. У лиц, страдающих дистальной ДПН, нарушаются все виды чувствительности: болевая, температурная, вибрационная.
Прогрессирование ДПН приводит к развитию синдрома диабетической стопы с формированием остеоартропатии (сустава Шарко) и образованием язвенных дефектов в местах максимального давления.
Патогенез диабетической полинейропатии
Патогенез ДПН гетерогенный. Однако ключевую роль в нем играет гипергликемия, что доказано в исследованиях DCCT и UKPDS [2, 3].
Гипергликемия вызывает оксидативный стресс – метаболическое нарушение, лежащее в основе диабетических осложнений [4]. Механизм – нарушение баланса выработки кислородных радикалов и их ингибирования антиоксидантами.
Свободные радикалы – молекулы или структурные компоненты молекул, имеющие на внешней орбитали неспаренный электрон. Для устойчивого состояния молекула должна содержать на внешней орбитали два электрона, поэтому свободные радикалы активно стремятся захватить недостающий электрон у других молекул. Это придает им повышенную реакционную способность.
К активным формам кислорода (АФК) относятся кислородсодержащие радикалы: супероксидный анион-радикал (О2•), гидропероксидный радикал (НО2•) и гидроксильный радикал (НО•), а также пероксид водорода (Н2О2) и гипохлорная кислота (НОСI). Наиболее вероятная мишень для кислородных радикалов – липиды биомембран.
В процессе митохондриального дыхания молекулярный кислород необходим для полного окисления глюкозы и других субстратов при синтезе аденозинтрифосфата (АТФ). В норме при окислительном фосфорилировании от 0,4 до 4% потребляемого кислорода конвертируется в супероксидный радикал. Впоследствии он может конвертироваться в другие АФК и азотсодержащие радикалы. Супероксидный радикал в норме устраняется антиоксидантной системой. При хронической гипергликемии компенсаторный ответ последней может оказаться неадекватным. Как следствие, избыточное образование АФК и повреждение белков, липидов и ДНК.
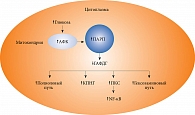
Повышение продукции АФК в митохондриях приводит к разрушению цепей ДНК и активации поли(аденозиндифосфат-рибоза)-полимеразы (ПАРП) (рис. 1).
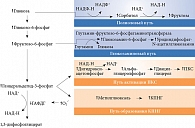
Активация ПАРП в свою очередь инактивирует один из основных ферментов гликолиза – глицеральдегидфосфат-дегидрогеназу (ГАФДГ). В результате гликолиз блокируется на уровне триозфосфатов, глюкоза направляется на окисление по полиоловому пути, стимулируется образование диацилглицерола и, как следствие, активируется протеинкиназа С (ПКС), повышается аккумуляция конечных продуктов неферментативного гликирования (КПНГ) и образование глюкозаминов (рис. 2).
Нервная ткань является независимым от инсулина потребителем глюкозы, что в условиях гипергликемии приводит к чрезмерной активации полиолового пути посредством альдозоредуктазы. Альдозоредуктаза – первый фермент полиолового пути. Он катализирует НАДФ-Н-зависимое снижение уровня многих углеводов, включая глюкозу (НАДФ-Н – восстановленная форма никотинамидадениндинуклеотидфосфата). Аффинность альдозоредуктазы с глюкозой низкая, поэтому в условиях нормогликемии происходит незначительное окисление глюкозы по полиоловому пути. Однако в условиях гипергликемии активность фермента возрастает, что обеспечивает конверсию глюкозы в многоатомный спирт сорбитол и снижение НАДФ-Н.
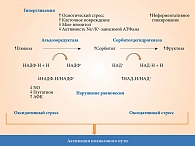
Активация полиолового пути при гипергликемии может повысить соотношение окисленной формы никотинамидадениндинуклеотидфосфата (НАДФ+) и восстановленной, что снижает активность глютатионредуктазы и, следовательно, восстановление окисленного глютатиона. Это усиливает окислительный стресс. Поток глюкозы по полиоловому пути в различных тканях увеличивается на 11–33% (рис. 3).
Избыток сорбитола накапливается в нервной ткани, что вызывает осмотическое напряжение. В результате снижается содержание осмолитиков, таких как мио-инозитол, таурин и аденозин, и повреждается ткань. Уменьшение концентрации мио-инозитола приводит к снижению активности Na+/K+-АТФазы – фермента, необходимого для генерации нервной деполяризации и проводимости импульсов [5].
Накопление сорбитола и его последующее окисление сорбитолдегидрогеназой до фруктозы повышает соотношение восстановленной формы никотинамидадениндинуклеотида (НАД-H) и окисленной (НАД+), в результате гликолиз блокируется на стадии триозофосфатов и повышается образование альфа-глицеролфосфата – предшественника образования диацилглицерола, повышающего активность ПКС.
Кроме того, при гипергликемии в спинном мозге активируются не-нейрональные клетки (микроглии, астроциты, иммунные клетки), играющие важную роль в развитии нейропатической боли. Глиальные клетки, влияющие на синаптическую связь между нейронами, в условиях гипергликемии также активируются, способствуя высвобождению провоспалительных цитокинов, являющихся общими медиаторами аллодинии и гипералгезии. Речь, в частности, идет об интерлейкинах 1-бета и 16 и факторе некроза опухоли альфа. Экспрессия генов указанных провоспалительных цитокинов регулируется специфическим ядерным фактором каппа В (NF-κB). Согласно последним данным активация NF-κB происходит при оксидативном стрессе под влиянием ПКС. Активация циклооксигеназы 2, вызванная NF-κB, способствует выработке простагландина Е2 и последующей генерации АФК. Оксидативный стресс выводится на новый уровень. NF-κB регулирует также активность индуцибельной синтазы оксида азота (NO), являющейся дополнительным воспалительным ферментом. Цитокины, индуцированные активацией NF-κB в шванновских клетках, эндоневрии и эпиневрии, обусловливают инфильтрацию нерва моноцитами с последующей их дифференцировкой в макрофаги, что способствует усугублению провоспалительных процессов. В результате повреждаются клетки и разрушается миелин. Повреждение шванновских клеток и разрушение нейронов сопровождаются снижением способности нервной ткани к регенерации вследствие уменьшения выработки факторов роста нерва.
Таким образом, основная роль в развитии любой формы ДПН принадлежит гипергликемии и вызываемому ею окислительному стрессу, в результате которого активизируются альтернативные пути самоокисления глюкозы: полиоловый путь, что приводит к снижению содержания мио-инозитола в нервном волокне и, как следствие, скорости проведения импульса, образованию КПНГ, и гексозаминовый путь, что способствует утолщению сосудистой стенки и развитию микроангиопатий, в том числе vasa-nervorum, что нарушает трофику нервного волокна, и, наконец, активации ПКС, влияющей как на прогрессирование ангиопатии, так и на многочисленные метаболические процессы, приводя к активации NF-κB и повышению продукции факторов роста и цитокинов (в первую очередь провоспалительных цитокинов, ответственных за развитие гипералгезии и аллодинии у больных ДПН).
Профилактика и лечение
Для профилактики ДПН необходимо поддерживать целевой уровень гликемии, что позволит уменьшить оксидативный стресс, являющийся основной причиной развития диабетических осложнений. Однако ДПН, при которой нарушается проведение импульса в нейромышечных синапсах, снижает чувствительность к гипогликемии. Поэтому согласно Российскому консенсусу по лечению сахарного диабета у пациентов с высоким риском развития гипогликемии целевой уровень гликированного гемоглобина повышается даже для лиц молодого возраста без наличия признаков тяжелых ангиопатий [6], что усугубляет риск развития осложнений, в том числе ДПН.
Учитывая вышесказанное, а также результаты исследования UKPDS, свидетельствующие о том, что риск развития диабетических ангиопатий снижается на 34% при снижении уровня гликированного гемоглобина на 1%, пациентам рекомендуется поддерживать уровень указанного показателя максимально близко к целевому.
Лечение ДПН в соответствии с консенсусом по нейропатической боли должно отвечать следующим требованиям:
- иметь патогенетическую направленность;
- улучшать неврологическую симптоматику;
- улучшать функцию нерва.
Лечение ДПН, так же как и нейропатии любого генеза, является чрезвычайно сложной задачей, поскольку эффективные препараты на сегодняшний день отсутствуют.
Симптоматическая терапия считается первой линией терапии ДПН.
Она признается эффективной, если назначенный препарат снижает боль хотя бы на 50%. Однако для достижения такого результата необходим длительный временной интервал. Кроме того, симптоматическая терапия сопровождается рядом побочных реакций. Как следствие, частый отказ от ее проведения.
На данный момент проведено большое количество клинических исследований эффективности симптоматической терапии болевого синдрома при ДПН, синтезировано много новых субстанций, однако практически не проводилось сравнительного анализа эффективности той или иной группы препаратов.
Симптоматическое лечение предполагает использование препаратов группы трициклических антидепрессантов, ингибиторов обратного захвата серотонина/норадреналина, антиконвульсантов.
Эффективность простых анальгетиков и нестероидных противовоспалительных препаратов при ДПН ограничена, а риск серьезных побочных эффектов очень высок.
Применение опиоидных анальгетиков при нейропатических болях остается предметом дискуссии, поэтому опиаты назначаются только при отсутствии эффекта от других препаратов – 7% случаев.
В качестве патогенетической терапии рассматривается возможность использования препаратов, воздействующих на основные метаболические изменения, возникающие при нарушении углеводного обмена в результате оксидативного стресса, и, как следствие, способных положительно влиять на течение, прогрессирование ДПН первой и второй стадии и предупреждать развитие дегенеративных изменений в нерве. К таковым относятся препараты, действие которых направлено на активацию полиолового пути за счет блокады альдозоредуктазы (Эпалрестат), блокаду ПКС (Рубоксистаурин) в целях снижения провоспалительного каскада изменений, связанных с активацией NF-κB, факторы роста нерва (нейротрофин 3), антиоксиданты (витамины Е и С, альфа-липоевая кислота) [7].
С одной стороны, достаточной доказательной базы в отношении эффективности и безопасности применения и преимуществ того или иного препарата не существует.
С другой – метаболическая терапия, включающая витамины (бенфотиамины, цианокобаламин), а также кофакторы ферментов, участвующих в энергетических обменных процессах (кокарбоксилаза, карнитин, гамма-линоленовая кислота), давно и хорошо зарекомендовала себя и является обоснованной.
Кокарнит
Недавно в России появился новый комбинированный метаболический препарат Кокарнит (компания World Medicine). Он содержит 20 мг никотинамида, 50 мг кокарбоксилазы, 0,5 мг цианокобаламина, 10 мг аденозина трифосфата динатрия тригидрата.
Никотинамид (витамин В3) – водорастворимый витамин, обладающий антиоксидантным действием [8, 9]. Никотинамид является мягким ингибитором ПАРП и предшественником НАД+. Таким образом, вещество активизирует окисление глюкозы по гликолитическому и пентозофосфатному путям, препятствуя прогрессированию дислипидемии и глюконеогенезу [10]. Положительный эффект никотинамида в отношении восстановления чувствительности и нервной проводимости, а также эндотелиальной функции согласуется с ключевой ролью активации ПАРП и оксидативного стресса в развитии ДПН и подтвержден результатами многочисленных исследований. Установлено, что никотинамид улучшал нервную проводимость и кровоток в нервах крыс со стрептозотоциновым сахарным диабетом, снижал перекисное окисление липидов и образование свободных радикалов и вторичных продуктов перекисного окисления липидов в культуре шванновских клеток человека, инкубированных в среде с высоким содержанием глюкозы [10]. Множественные эффекты и низкая токсичность даже при высоких дозах [11] позволяют рассматривать никотинамид для лечения ДПН.
Кокарбоксилаза (тиаминдифосфат) является готовой формой кофермента, образующегося из тиамина (витамина В1) в процессе его превращения в организме. Тиамин широко используется многие десятилетия для лечения различных неврологических заболеваний периферической нервной системы [12]. При сахарном диабете оказывает влияние на оксидативный стресс через повышение активности транскетолазы – фермента, регулирующего углеводный обмен. Это способствует нормализации содержания промежуточных продуктов обмена глюкозы за счет активации пентозофосфатного пути. При этом снижаются активность ПКС, транскрипция NF-kB, продукция эндотелиальной синтазы оксида азота и эндотелина 1, содержание метилглиоксаля в цитоплазме клеток. Тиамин также уменьшает изменения, связанные с активацией полиолового пути утилизации глюкозы, обусловленные в первую очередь истощением содержания антиоксидантного фермента восстановленного глутатиона и накоплением сорбитола. Доказано, что тиамин, локализующийся в мембранах нервных клеток, существенно влияет на регенерацию поврежденных нервных окончаний, а также участвует в обеспечении энергетических процессов в нервных клетках, в том числе аксоплазматического тока.
Дефицит кобаламина (витамина В12) связывают с развитием анемии, нарушением когнитивных функций и прогрессированием нейропатии. В ряде клинических исследований показан положительный эффект препаратов кобаламина на указанные патологические изменения при сахарном диабете [13].
Снижение уровня витамина В12 у таких больных обусловлено оксидантным стрессом.
Антиоксидантные свойства витамина В12 были продемонстрированы в условиях in vitro [14]. Показано, что его производные ингибируют продукцию внутриклеточного пероксида, поддерживают внутриклеточный уровень глутатиона и предотвращают апоптоз и некроз.
В двойном слепом сравнительном исследовании трициклического антидепрессанта нортриптилина и витамина В12 была отмечена большая эффективность последнего в лечении болевой формы ДПН [15].
АТФ – нуклеозидтрифосфат, играющий важную роль в обмене энергии и веществ. АТФ относится к макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, при гидролизе которых происходит высвобождение значительного количества энергии. АТФ служит источником энергии для множества энергозатратных биохимических и физиологических процессов.
Кроме того, АТФ является исходным продуктом для синтеза нуклеиновых кислот, аллостерическим эффектором ряда ферментов (усиливает или подавляет их активность), непосредственным предшественником синтеза циклического аденозинмонофосфата – вторичного посредника передачи гормонального сигнала в клетку.
АТФ используется в качестве медиатора в синапсах и сигнального вещества в других межклеточных взаимодействиях. Впервые способность АТФ к переносу информации посредством семейства пуриновых рецепторов на клеточной поверхности была продемонстрирована в отношении нервных клеток и мышц. На сегодняшний день установлено, что АТФ играет аналогичную роль в разных тканях.
АТФ, которую ранее рассматривали в основном как необходимый компонент внутриклеточных биохимических реакций, в последние годы завоевывает новые сферы. Она участвует в таких процессах, как восприятие болевых раздражителей, межклеточная передача возбуждения в центральной и периферической нервной системе, нейропротекторное действие эндогенных веществ, регуляция кровообращения [16].
Эффективность Кокарнита изучалась в нескольких клинических исследованиях. Их результаты показали положительное влияние препарата на течение дистальной ДПН и кардиальной автономной нейропатии. В исследованиях белорусских и молдавских ученых отмечено, что применение Кокарнита сопровождалось уменьшением интенсивности специфических клинических симптомов и боли [17, 18]. По данным украинских авторов, на фоне применения Кокарнита улучшалась диастолическая функция и снижалась вариабельность сердечного ритма у больных с кардиальной автономной нейропатией [19].
Таким образом, учитывая данные клинических исследований, а также возможности воздействия каждого из составляющих препарата Кокарнит на механизмы развития оксидативного стресса, указанное лекарственное средство можно рекомендовать для комплексного лечения ДПН.
L.V. Nedosugova
First Moscow State Medical University named after I.M. Sechenov
Contact person: Lyudmila Viktorovna Nedosugova, profmila@mail.ru
The study was aimed at examining opportunities of using a new drug Cocarnit during diabetic polyneuropathy (DPN). A pathogenesis of DPN is discussed in light of oxidative stress upon diabetes mellitus as well as influence of active ingredients contained in Cocarnit on its manifestations. The results of clinical studies examining efficacy of Cocarnit during DPN are analyzed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.