Заместительная терапия левотироксином при сахарном диабете и гипотиреозе
- Аннотация
- Статья
- Ссылки
- English


Сахарный диабет
Распространенность, механизмы развития и осложнения
Сахарный диабет (СД) – одна из важных проблем современности по причине высокой распространенности, неуклонного роста заболеваемости и частоты микро- и макрососудистых осложнений, определяющих течение и прогноз болезни. Согласно данным Международной диабетической федерации (International Diabetes Federation), в мире зарегистрировано 371 млн больных СД, а к 2025 г. их количество может увеличиться до 552 млн. По данным государственного регистра, СД в Российской Федерации отмечен более чем у 3,7 млн человек, причем 85–90% этого количества приходится на СД 2 типа. Однако фактически больных СД в три-четыре раза больше [1].
Сахарный диабет 2 типа является гетерогенным заболеванием, в развитии которого участвуют как модифицируемые факторы – ожирение, гиподинамия, избыточное питание, так и немодифицируемые – пожилой возраст, наследственная предрасположенность (о чем свидетельствует высокая степень конкордантности у однояйцовых близнецов – 90–100%) [2].
Патофизиологической основой СД 2 типа является инсулинорезистентность и дисфункция бета-клеток. В свою очередь повышенная продукция глюкозы печенью, глюкозотоксичность, липотоксичность участвуют в поддержании и усилении инсулинорезистентности и секреторной недостаточности бета-клеток [3].
Инициирующим фактором развития микро- и макрососудистых осложнений СД является гипергликемия, которая приводит к метаболическим и структурным изменениям в органах и тканях: активации полиолового пути обмена глюкозы в нервных волокнах, сосудах сетчатки, почках, повышению активности протеинкиназы С, утолщению базальной мембраны и повышению проницаемости сосудистой стенки, неферментативному гликозилированию белков. Это ведет к гемодинамическим нарушениям: усилению кровотока и повышению давления в сосудах микроциркуляторного русла, повышению агрегации тромбоцитов и риска тромбообразования в просвете сосудов. Гипергликемия способствует активации процессов перекисного окисления липидов. Взаимодействие супероксидного радикала с оксидом азота приводит к образованию пероксинитрита, который оказывает токсическое действие на эндотелий сосудов, а снижение уровня оксида азота – к вазоконстрикции и эндотелиальной дисфункции [4]. Именно поэтому у 60–80% больных СД 2 типа развивается артериальная гипертензия (АГ), частота которой в два раза выше общепопуляционных значений. Однако АГ при СД 2 типа лишь одно из проявлений заболевания, в основе которого лежит инсулинорезистентность и гиперинсулинемия [5].
При СД 2 типа изменяется липидный обмен. При исследовании липидного спектра можно отметить повышение уровня атерогенных фракций: липопротеинов низкой плотности (ЛПНП), триглицеридов (ТГ) – одновременно со снижением содержания липопротеинов высокой плотности (ЛПВП). Эта липидная триада обусловливает ускоренное развитие атеросклероза, ишемической болезни сердца и является прогностическим маркером высокого сердечно-сосудистого риска у больных СД 2 типа.
Проведенные проспективные исследования доказали ведущую роль гипергликемии (особенно постпрандиальной) в развитии ишемической болезни сердца и, следовательно, в повышении смертности от сердечно-сосудистых заболеваний [3].
Основные направления лечения СД
Главная цель лечения СД – достижение оптимального метаболического контроля для снижения риска развития микро- и макрососудистых осложнений. При этом лекарственная терапия направлена на достижение индивидуального целевого уровня гликированного гемоглобина (HbA₁c) (в зависимости от возраста пациента, ожидаемой продолжительности жизни, наличия тяжелых сердечно-сосудистых осложнений и риска развития гипогликемических состояний), а также на достижение целевого уровня липидного обмена и артериального давления (АД).
На основании обобщенных данных доказательной медицины советом экспертов Российской ассоциации эндокринологов был разработан Консенсус по инициации и интенсификации сахароснижающей терапии сахарного диабета 2 типа. Приоритетными принципами являются безопасность и эффективность [6].
Гипотиреоз
Причины развития, влияние на разные системы организма и диагностика
Гипотиреоз – клинический синдром, обусловленный продолжительным и стойким дефицитом тиреоидных гормонов. Распространенность клинически выраженного первичного гипотиреоза в популяции составляет 0,2–2,0%, субклинического 7–10% среди женщин и 2–3% среди мужчин [7].
Основными причинами первичного гипотиреоза являются аутоиммунный тиреоидит, тиреоидэктомия, лечение радиоактивным йодом, дефекты развития щитовидной железы.
Клиническая картина гипотиреоза зависит от возраста пациента, скорости развития тиреоидной недостаточности, наличия сопутствующих заболеваний.
Для синдрома гипотиреоза характерно нарушение многих систем организма. Так, со стороны сердечно-сосудистой системы наблюдается брадикардия, диастолическая артериальная гипертензия, рефрактерная к гипотензивной терапии, но поддающаяся коррекции при заместительной терапии левотироксином. В случае недостаточности кровообращения, анемии у пожилых пациентов гипотиреоз может протекать с тахикардией. Существует риск изолированного накопления жидкости в полости перикарда или развития гипотиреоидного полисерозита – гидроперикарда, гидроторакса, асцита.
Со стороны дыхательной системы у больных гипотиреозом отмечается синдром обструктивного апноэ во сне по причине отека и инфильтрации слизистой оболочки верхних дыхательных путей.
К гастроэнтерологическим маскам гипотиреоза можно отнести гипомоторную дисфункцию желчевыводящих путей, желчнокаменную болезнь, хронические запоры.
При субклиническом и манифестном гипотиреозе есть вероятнось нарушения менструальной функции и/или развития гиперпролактинемического гипогонадизма. Повышение секреции пролактина передней долей гипофиза обусловлено стимуляцией тиреотропин-рилизинг-гормоном по механизму отрицательной обратной связи при первичном гипотиреозе. Длительно существующий недиагностированный гипотиреоз может привести к образованию вторичной аденомы гипофиза.
Гипотиреоз иногда является причиной депрессивных состояний и когнитивных нарушений. Для него также характерны нарушение липидного обмена, повышение уровня атерогенных фракций липидного спектра и индекса атерогенности (ИА) [8, 9].
В 23–67% случаев больным первичным гипотиреозом ставят диагноз «артериальная гипертензия». Особенностями патогенеза АГ при гипотиреозе являются задержка натрия и воды вследствие избытка гликозаминогликанов и вазопрессина в тканях, увеличение периферического сосудистого сопротивления, снижение эластичности стенок сосудов, дислипидемия [10].
Гормональными маркерами заболеваний щитовидной железы служат тиреотропный гормон (ТТГ) и свободный тироксин (св. Т4). Подтверждением субклинического гипотиреоза – умеренное повышение уровня ТТГ при референсном интервале 0,4–4,0 мЕд/л на фоне нормального уровня св. Т4.
При манифестации гипотиреоза уровень ТТГ повышается, а значения св. Т4 снижаются.
Для выявления причин развития первичного гипотиреоза проводят ультразвуковое исследование щитовидной железы, определяют антитела к тиреопероксидазе, а также при необходимости назначают радиоизотопную сцинтиграфию и тонкоигольную аспирационную биопсию ткани щитовидной железы.
Заместительная терапия левотироксином
Лечение гипотиреоза заключается в назначении заместительной терапии синтетическими препаратами левотироксина. Согласно отечественным и международным клиническим рекомендациям абсолютным показанием к назначению заместительной терапии является манифестный гипотиреоз при сниженном уровне св. Т4 и субклинический гипотиреоз с повышенным уровнем ТТГ (более 10 мЕд/л) [11].
Вопрос о назначении левотироксина при субклиническом гипотиреозе, если уровень ТТГ – 4–10 мЕд/л, а уровень св. Т4 в норме, решается индивидуально.
Левотироксин показан лицам молодого возраста, при планировании беременности, наличии антител к тиреопероксидазе, а также при дислипидемии, диастолической артериальной гипертензии, депрессии [12].
L-Тироксин компании «Берлин-Хеми» (50 и 100 мкг) не содержит лактозы, что является одним из главных преимуществ препарата.
Проведенные исследования доказали, что лактоза в качестве вспомогательного вещества в пероральной лекарственной форме существенно влияет на биодоступность препарата, качество и эффективность лечения, поскольку способствует более быстрому разрушению препарата, снижает его активность и безопасность. Так, в исследовании о влиянии вспомогательных веществ на стабильность таблетированной формы левотироксина натрия пентагидрата установлено, что в препарате, содержащем лактозу, в отличие от препарата левотироксина натрия, содержащего двухосновный фосфат кальция, за шесть месяцев активность действующего вещества снижается на 30% и накапливается значительное количество влаги.
Следует отметить, что у лиц пожилого возраста с сопутствующими заболеваниями желудочно-кишечного тракта, сердечно-сосудистой системы нередко отмечается недостаточность лактазы. Дефицит данного фермента, участвующего в расщеплении лактозы в тонкой кишке, может вызывать метеоризм, боли в животе, диарею [13], что свидетельствует о непереносимости лактозы. Этот факт ограничивает возможность применения препаратов левотироксина, содержащих лактозу, у таких пациентов. В качестве альтернативы им может быть назначен L-Тироксин.
Степень всасывания препарата L-Тироксин достигает практически 80%. Однако есть данные, что с возрастом всасывание препарата ухудшается. Нарушению всасывания L-Тироксина может способствовать и прием препаратов кальция, солей железа, ципрофлоксацина, рифампицина, фенобарбитала.
Длительный период биологического полураспада L-Тироксина – шесть – восемь дней, а также время действия – 10–12 дней являются еще одним преимуществом препарата.
L-Тироксин следует принимать утром за 30 минут до еды.
Доза препарата устанавливается индивидуально и корректируется врачом. Например, пациентам, не имеющим сердечно-сосудистых заболеваний, L-Тироксин назначается исходя из их массы тела – 1,5 мкг/кг в день (около 75–100 мкг в сутки для женщин и 100–125 мкг для мужчин). Поскольку суточный ритм секреции тиреоидных гормонов практически отсутствует, ежедневный прием L-Тироксина в подобранной дозе хорошо имитирует эндогенную продукцию гормона.
У пациентов с сердечно-сосудистыми заболеваниями и лиц пожилого и старческого возраста терапию L-Тироксином в дозе 0,9–1 мкг/кг в сутки следует начинать с 12,5–25 мкг в сутки с медленным титрованием дозы на 12,5–25 мкг через 14–21 день. При этом необходимо ежедневно контролировать пульс, АД и регулярно проводить электрокардиографическое исследование. Однако в случае лечения нарушений сердечного ритма амиодароном доза L-Тироксина, как правило, увеличивается, поскольку амиодарон блокирует конверсию Т4 в Т3.
Время года также оказывает влияние на режим дозирования. Например, летом подобранная доза L-Тироксина обычно снижается.
Поскольку подбор правильной дозы препарата очень важен, необходимо обучить больных самоконтролю пульса, АД, массы тела, ведению дневника наблюдений [8, 11, 14].
Основным критерием адекватности дозы левотироксина является уровень ТТГ. Определение уровня ТТГ показано через четыре – восемь недель от начала терапии или после изменения дозы левотироксина. При наблюдении в динамике рекомендуется определять уровень ТТГ через шесть месяцев подобранной терапии левотироксином, а в последующем – один раз в год при условии адекватной заместительной дозы препарата.
Референсный интервал ТТГ у лиц репродуктивного возраста – 0,5–1,5 мЕд/л. У лиц пожилого возраста с сердечно-сосудистыми заболеваниями при невозможности назначения полной дозы заместительной терапии допускается уровень ТТГ в пределах 10 мЕд/л. В регионах с нормальным потреблением йода уровень ТТГ не должен превышать 4,12 мЕд/л [11].
Особенности сочетанной патологии
Сахарный диабет и аутоиммунные заболевания щитовидной железы занимают лидирующие позиции в структуре эндокринной патологии. Сочетание СД 2 типа и первичного гипотиреоза на сегодняшний день отмечено в 5,0–6,9% случаев.
Гипотиреоз может предшествовать СД, развиваться с ним одновременно или появиться на фоне уже существующего СД. Гипофункция щитовидной железы при наличии СД усугубляет нарушения углеводного обмена. С одной стороны, при гипотиреозе замедляется всасывание углеводов в кишечнике, подавляется глюконеогенез в печени и, следовательно, снижается продукция глюкозы, а с другой – в исследованиях с использованием эугликемического гиперинсулинемического клэмпа отмечены снижение утилизации глюкозы в мышечной и жировой тканях, обусловленное инсулинорезистентностью, и гиперинсулинемия как признак нарушения метаболизма глюкозы. Однако для подтверждения инсулинорезистентности при гипотиреозе необходимо рассчитать индекс HOMA-IR (Homeostasis Model Assessment of Insulin Resistance – гомеостатическая модель оценки инсулинорезистентности).
Сочетание СД 2 типа и первичного гипотиреоза приводит к серьезным нарушениям липидного обмена. Существенные изменения происходят в липидном спектре – усугубляется атерогенная дислипидемия.
У пациентов с СД 2 типа и гипотиреозом повышен риск развития как микрососудистых осложнений, так и сердечно-сосудистых заболеваний – АГ, ишемической болезни сердца [15].
Сочетание СД 2 типа, субклинического и декомпенсированного гипотиреоза сопряжено с такими негативными процессами, как тромбоцитарная гиперактивность и снижение дезагрегационных свойств крови, а также с гипертриглицеридемией [16].
Клиническое исследование эффективности заместительной терапии L-Тироксином при сочетании СД 2 типа и гипотиреоза
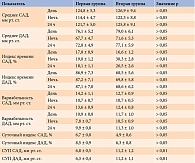
В эндокринологическом отделении Рязанской областной клинической больницы для оценки переносимости, эффективности и безопасности препарата у пациентов с комбинированной патологией было проведено наблюдение, длившееся три недели. В исследовании участвовало 49 больных СД 2 типа, которых разделили на две группы. Первая группа – 38 пациентов с СД 2 типа в сочетании с первичным гипотиреозом (аутоиммунный тиреоидит – 21 человек, послеоперационный гипотиреоз – 17 человек), возраст 57,6 ± 1,7 года, длительность СД 2 типа – 9,6 ± 0,9 года, гипотиреоза – 8,6 ± 0,9 года. Вторая группа – 11 больных СД 2 типа без нарушений функции щитовидной железы. Возраст пациентов – 57,8 ± 2,9 года, длительность СД 2 типа – 9,4 ± 1,3 года. Клиническая характеристика пациентов обеих групп представлена в табл. 1. Артериальная гипертензия второй и третьей степени имела место у всех пациентов первой группы и у 90,9% пациентов второй.
В качестве сахароснижающей терапии всем больным были назначены пероральные препараты метформин, гликлазид с модифицированным высвобождением, вилдаглиптин (моно- и комбинированная терапия) в сочетании с инсулинотерапией в базально-болюсном режиме (инсулин гларгин, детемир, аспарт, глулизин, Инсуман Базал ГТ). Лечение гипотиреоза проводилось левотироксином (препарат L-Тироксин, компания «Берлин-Хеми»).
Переносимость препарата была хорошей, побочных эффектов не наблюдалось.
Поскольку большинство пациентов страдали АГ, они получали два-три гипотензивных препарата (лизиноприл, валсартан, небиволол, амлодипин или моксонидин).
Проведено исследование углеводного обмена (гликемия натощак, постпрандиальная и HbA1c), липидного обмена (общий холестерин крови (ОХС), ЛПНП, ЛПВП, ТГ), сделан расчет ИА, индекса HOMA-IR. Уровень инсулина (иммунореактивный инсулин, ИРИ) определяли иммуноферментным методом. Суточное мониторирование АД проводилось по стандартной методике на аппарате диагностической системы «Валента». Обработка данных проводилась с использованием t-критерия Стьюдента. Коэффициент корреляции (r) определялся методом Пирсона.
К концу третьей недели уровень HbA1c в первой группе составил 8,9 ± 0,2%, во второй – 7,6 ± 0,4% (р < 0,05), уровень глюкозы крови натощак снизился в первой группе с 10,6 ± 0,4 до 8,7 ± 0,3ммоль/л (p< 0,01), во второй– с8,4 ± 0,9 до 6,2 ± 0,3 ммоль/л (р < 0,05). Показатели постпрандиальной гликемии в первой группе были в пределах 13,5 ± 0,4 – 11,2 ± 0,3 ммоль/л (р < 0,01), во второй – 10,7 ± 0,6 – 8,6 ± 0,5 ммоль/л (р < 0,05).
При сравнении показателей липидного спектра у пациентов первой группы отмечено достоверное повышение уровня ЛПНП, ТГ и ИА, а также умеренная тенденция к повышению ОХС (табл. 2).
При оценке уровня ИРИ выявлено достоверное повышение данного показателя у больных первой группы по сравнению с пациентами второй группы (16,9 ± 1,8 и 6,6 ± 0,8, р < 0,001), а также индекса HOMA-IR (6,63 ± 0,9 и 1,94 ± 0,3 мМЕ/л, р < 0,001). Установлена прямая корреляционная зависимость показателей ЛПНП (r = 0,78), ТГ (r = 0,82) и ИА (r = 0,68) от уровня ТТГ в группе больных СД 2 типа в сочетании с гипотиреозом.
При анализе результатов суточного мониторирования АД средние показатели систолического и диастолического давления (САД и ДАД) в дневное и ночное время у пациентов первой и второй групп существенно не различались и на фоне гипотензивной терапии находились в пределах нормы. Однако у пациентов обеих групп индекс времени ДАД был значительно повышен (более 50%) и составил соответственно днем 86,9 ± 7,3 и 68,5 ± 5,6% (р < 0,05), ночью – 87,2 ± 7,1 и 69,8 ± 5,8% (р < 0,05), в течение 24 часов – 87,1 ± 7,0 и 68,6 ± 6,2% (р < 0,05).
Скорость утреннего подъема (СУП) САД и ДАД была умеренно повышена у пациентов обеих групп. Это, скорее всего, связано с недостаточным снижением АД в ночные часы. Вариабельность САД и ДАД на фоне проводимой антигипертензивной терапии не превышала нормальных значений (15 мм рт. ст.) у всех пациентов (табл. 3).
У всех больных отмечено нарушение циркадного ритма АД: недостаточное снижение САД и ДАД в ночные часы, что, по-видимому, обусловлено развитием диабетической автономной кардиоваскулярной невропатии. Такое изменение суточного ритма АД сопряжено с максимальным риском развития сердечно-сосудистых осложнений.
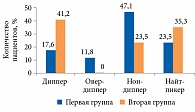
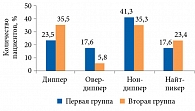
Нормальный профиль САД типа диппер зарегистрирован у пациентов первой группы в 17,6% случаев, у пациентов второй группы – в 41,2% случаев (р < 0,05). Профиль нон-диппер в первой группе – у 47,1% больных, во второй группе – у 23,5% (р < 0,05) (рис. 1). Суточный индекс ДАД: профиль нон-диппер в первой группе отмечен у 41,3% пациентов, во второй – у 35,3% больных, профиль диппер во второй группе зафиксирован у большего количества больных – 35,5 против 23,5% (рис. 2).
Таким образом, наблюдение показало, что использование в качестве заместительной терапии L-Тироксина при гипотиреозе в сочетании с СД 2 типа и АГ обеспечивает эффективное и безопасное лечение.
Заключение
При комбинированной эндокринной патологии своевременная диагностика и коррекция тиреоидной недостаточности, антигипертензивная терапия, достижение целевых уровней глюкозы и липидов крови должны стать обязательными лечебно-профилактическими мероприятиями, которые позволят снизить риск развития сердечно-сосудистых заболеваний и отсрочить развитие и прогрессирование микро- и макрососудистых осложнений СД.
I.I. Dubinina, S.V. Berstnyova
Pavlov Ryazan state medical university
Contact person: Inessa Ivanovna Dubinina, inessa.dubinina@mail.ru
Association of type 2 diabetes and hypothyroidism adversely affects carbohydrate metabolism, atherogenicity of serum, insulin resistance and diastolic blood pressure. L-Thyroxin Berlin-Chemie is a lactose-free levothyroxine preparation for the correction of hypothyroidism. The article addresses characteristics of L-Thyroxin, indications and recommendations for use, the results of the study of effects of levothyroxine on carbohydrate and lipid metabolism and blood pressure in patients with combination of type 2 diabetes and hypothyroidism.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.