Адъювантная таргетная терапия и анти-PD-1-иммунотерапия у пациентов с меланомой кожи III стадии с мутацией в гене BRAF. Данные реальной клинической практики
- Аннотация
- Статья
- Ссылки
- English
Введение
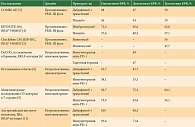
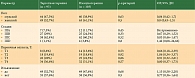
Адъювантная терапия в течение года для пациентов с меланомой кожи III стадии после радикального хирургического лечения остается одним из стандартных подходов большинства мировых рекомендаций, в том числе и в России [1, 2]. В отношении пациентов с мутацией в гене BRAF V600E/K возможно проведение как адъювантной таргетной терапии дабрафенибом с траметинибом, так и иммунотерапии анти-PD-1 (пембролизумабом или ниволумабом). В России данные режимы были зарегистрированы в 2019 г. Все опции продемонстрировали достоверное улучшение безрецидивной выживаемости (БРВ) в крупных рандомизированных исследованиях (табл. 1).
Дабрафениб с траметинибом (исследование COMBI-AD) достоверно улучшили трехлетнюю БРВ по сравнению с плацебо во всех подгруппах (58% против 39%, отношение рисков (ОР) 0,47) [3]. Трехлетняя общая выживаемость (ОВ) выше в группе таргетной терапии, однако различия не являются достоверными при заданной границе значимости p = 0,000019 (ОВ 86% против 77%, ОР 0,57; 95% доверительный интервал (ДИ) 0,42–0,79, p = 0,0006). Пембролизумаб (исследование KEYNOTE-054) достоверно увеличил трехлетнюю БРВ по сравнению с плацебо у пациентов с мутацией в гене BRAF с меланомой III стадии (62% против 37,1%, ОР 0,51) [4]. Ниволумаб (исследование CheckMate-238) достоверно увеличил трехлетнюю БРВ по сравнению с ипилимумабом у пациентов с мутацией в гене BRAF с меланомой IIIB–IIIC стадии (56% против 47,7%, ОР 0,79) [5].
На сегодняшний день доступны данные по улучшению пятилетней БРВ при использовании комбинированной таргетной терапии и иммунотерапии анти-PD-1, однако в статье мы делаем акцент на трехлетних результатах для лучшей демонстрации и сравнения данных рандомизированных клинических исследований (РКИ), других ретроспективных исследований и собственных данных.
Закономерно возникает вопрос, какое же лечение будет более эффективным для пациентов с мутацией в гене BRAF в адъювантном режиме? В настоящий момент нет рандомизированных исследований, сравнивающих таргетную и иммунотерапию напрямую. При непрямом сравнении упомянутых исследований нет существенных различий на трех годах наблюдения. В группе терапии трехлетняя БРВ составляет около 60% во всех исследованиях, в то время как в группе плацебо – около 40% (47,7% в группе ипилимумаба). Также не существует каких-либо маркеров, предсказывающих большую эффективность той или иной терапии, которые мы можем легко использовать в рутинной практике. Выбор между иммунотерапией или таргетной терапией у пациентов с мутацией в гене BRAF в основном обусловлен имеющимися у пациента противопоказаниями к тому или иному виду лечения, предпочтениями самого пациента и наличием препарата в клинике.
Тем не менее в последние годы появляется все больше ретроспективных данных, оценивающих как в целом эффективность адъювантной терапии у пациентов с меланомой кожи III стадии, так и отдельно у пациентов с мутацией в гене BRAF (табл. 1). Одно из таких исследований в 13 центрах Германии было представлено на конференции ASCO (American Society of Clinical Oncology – Американского общества клинической онкологии) 2022 г., которое освещало в целом адъювантную терапию меланомы III стадии [6]. Медиана наблюдения составила 25,7 месяца. В контексте пациентов с мутацией в гене BRAF, которых было 232 человека, двухлетняя БРВ составила 49% (95% ДИ 40,6–59,0%) в группе иммунотерапии и 67% (95% ДИ 58–77%) в группе таргетной терапии. Риск рецидива был выше в группе иммунотерапии по сравнению с группой таргетной терапии, хотя данные не были достоверно значимыми (ОР 1,99, 95% ДИ 1,34–2,96).
Еще одно исследование в двух центрах Италии, также изучавшее адъювантную терапию у пациентов с меланомой кожи III стадии вне зависимости от мутации в гене BRAF (в исследование было включено 113 пациентов), не доложило отдельно выживаемость в подгруппах, опубликовав лишь общую однолетнюю и двухлетнюю БРВ в 81 и 64% соответственно [7]. Однако исследователи отметили, что при анализе подгрупп в зависимости от типа лечения отмечался выигрыш в отношении таргетной терапии по сравнению с иммунотерапией (ОР 0,36, 95% ДИ 0,16–0,77, p = 0,01).
Одноцентровое исследование в Китае изучало уже непосредственно адъювантную терапию только пациентов с мутацией в гене BRAF [8]. В исследование были включены 93 пациента с меланомой кожи III стадии, которые получили дабрафениб с траметинибом (n = 25), вемурафениб (n = 23), иммунотерапию анти-PD-1 (n = 25) или остались под динамическим наблюдением (n = 20). Важно уточнить, что пациенты получали терапию в период с января 2017 г. по декабрь 2021 г., поэтому в исследовании есть пациенты, получавшие монотерапию вемурафенибом, – данный режим использовался ранее. В настоящее время вемурафениб не применяется в адъювантной терапии меланомы кожи III стадии. Анализ данных несколько затруднителен в связи с разным временем наблюдения в каждой группе (авторы объясняют данные различия разницей во времени регистрации адъювантных режимов). Тем не менее однолетняя и двухлетняя БРВ составили 81,7 и 81,7% в группе дабрафениба с траметинибом, 59,0 и 40,8% – в группе вемурафениба, 58,1 и 35,5% – в группе и 54,2 и 27,1% – в группе наблюдения. Отмечался выигрыш комбинированной таргетной терапии по сравнению с (p = 0,032), однако авторы обращают внимание на малый период наблюдения в группе таргетной терапии (медиана наблюдения всего лишь 11 месяцев), а также на возможные биологические особенности и потенциально меньшую чувствительность к иммунотерапии у китайской популяции пациентов с меланомой кожи.
Наиболее крупным исследованием является многоцентровое исследование в семи странах, включавшее 598 пациентов, которые получили адъювантное лечение в период с июля 2015 г. по октябрь 2022 г. [9]. Из них 393 (66%) пациента получили таргетную терапию, 205 (34%) пациентов – анти-PD-1-иммунотерапию. При медиане наблюдения 33 месяца таргетная терапия достоверно улучшила БРВ: медиана БРВ составила 51 месяц в группе таргетной терапии (95% ДИ 41,0 – не достигнуто (НД)) по сравнению с 44,8 месяца в группе иммунотерапии (95% ДИ 28,5–НД). Данные различия не привели к улучшению ОВ (ОР 1,00, 95% ДИ 0,65–1,55, p = 0,99). Подгрупповой анализ по большей части демонстрировал статистически незначимое преимущество в пользу таргетной терапии практически во всех подгруппах, однако единственным значимым различием оказался пол: женщины больше, чем мужчины, выигрывают от назначения таргетной терапии, по мнению исследователей (ОР 0,44, ДИ 95 0,28–0,69, p = 0,01).
Помимо поиска оптимального лечения в адъювантном режиме часть исследований направлена на деэскалацию лечения. В частности, это касается меланомы IIIA стадии. Внедрение 8-й версии системы стадирования AJCC (American Joint Commission on Cancer – Американского объединенного комитета по злокачественным опухолям) привело к изменению IIIA стадии в более благоприятную сторону: пяти- и десятилетняя выживаемость составляют относительно высокие значения (93 и 88%), что сопоставимо с IIA стадией (94 и 88% соответственно) [10].
На конференции ASCO 2023 г. представлены данные Австралийского института меланомы [11]. Было проанализировано 628 пациентов из различных стран. 226 пациентов получили иммунотерапию анти-PD-1 (из них 87 пациентов с мутацией в гене BRAF), 80 пациентов – таргетную терапию и 292 человека не получали терапию и находились под динамическим наблюдением. Ни один из вариантов лекарственной терапии не улучшил достоверно БРВ или выживаемость без отдаленных метастазов на медиане наблюдения 2,6 года. Авторы делают вывод о необходимости дальнейших исследований в этой области с более длительным наблюдением, однако это повод задуматься о необходимости адъювантного лечения отдельных категорий пациентов, принимая во внимание потенциальные побочные эффекты препаратов.
На базе отделения опухолей кожи Национального медицинского исследовательского центра (НМИЦ) онкологии им. Н.Н. Блохина с учетом имеющихся данных мы провели собственное одноцентровое наблюдательное ретроспективное исследование для сравнения и оценки эффективности различных режимов адъювантной терапии в реальной клинической практике.
Материал и методы исследования
Данное исследование является продолжающимся одноцентровым наблюдательным ретроспективным исследованием на базе НМИЦ онкологии им. Н.Н. Блохина. Исследование было одобрено ученым советом центра. В исследование включались все пациенты старше 18 лет (за исключением одной пациентки, которой было 14 лет на момент постановки диагноза), обратившиеся в центр, с меланомой кожи III стадии или ее эквивалентом с мутацией в гене BRAF после радикального хирургического лечения, которые получали адъювантную терапию в период с января 2019 г. по декабрь 2022 г. Пациенты, не получившие адъювантную терапию по различным причинам в этот период, также включены. Стадирование болезни производилось по 8-й версии AJCC.
Первичной конечной точкой в исследовании является БРВ, которая определялась как время от начала адъювантной лекарственной терапии до прогрессирования (локальный рецидив, прогрессирование в регионарных лимфоузлах или появление отдаленных метастазов) или смерти по любой причине. Локальный рецидив подтверждался посредством морфологической верификации, прогрессирование в регионарных лимфоузлах или отдаленных метастазах – по данным лучевых методов исследования (позитронно-эмиссионной и компьютерной томографии, компьютерной томографии или магнитно-резонансной томографии). Вторичной конечной точкой является ОВ, которая определялась как время от начала адъювантной лекарственной терапии до смерти по любой причине. Анализ выживаемости проведен с использованием метода Каплана – Мейера. Однофакторный регрессионный анализ Кокса проведен для оценки клинических прогностических факторов (пол, подстадия болезни, толщина и изъязвление первичной опухоли) в отношении БРВ. Статистический анализ и визуализация полученных данных проводились с использованием среды для статистических вычислений MedCalc Software Ltd.
Результаты
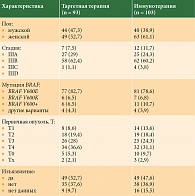
С октября 2022 г. по сентябрь 2023 г. в промежуточный анализ включено 209 пациентов, соответствующих критериям, из них 92 (44%) мужчины и 117 (56%) женщин. Медиана возраста – 50,6 года (14–81). Таргетную терапию получили 93 (44,4%) пациента, иммунотерапию – 103 (49,3%) пациента. 13 (6,3%) пациентов не получали адъювантную терапию (находились под наблюдением). Группа наблюдения не анализировалась ввиду малого количества пациентов. Другие характеристики представлены в табл. 2.
У всех пациентов методом ПЦР на опухолевом материале была выявлена мутация в гене BRAF. Преимущественно встречались мутации BRAF V600E/K.
Только у 8 пациентов были выявлены другие варианты BRAF-мутаций: BRAF V600R – три пациента, BRAF V600M – один пациент, BRAF K601E – три пациента, BRAF L597S – один пациент. Стоит отметить, что иммунотерапию получили шесть пациентов из восьми, таргетную терапию – два пациента (один с мутацией BRAF V600R, другой с мутацией BRAF L597S).
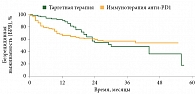
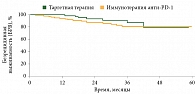
При медиане наблюдения 27 месяцев медиана БРВ составила 30 месяцев (95% ДИ 23–56) в группе таргетной терапии и не достигнута в группе иммунотерапии; медиана ОВ не достигнута в обеих группах (рис. 1 и 2). Не было выявлено достоверных различий между группами таргетной терапии и иммунотерапии ни в отношении БРВ (ОР 0,84, 95% ДИ 0,53–1,34, p = 0,47), ни в отношении ОВ (ОР 0,59%, 95% ДИ 0,26–1,34, p = 0,21). Показатели БРВ на 12 месяцах составили 91,4%, на 18 месяцах – 79,5%, на 24 месяцах – 68,8% в группе таргетной терапии и 67, 63,1 и 61,1% в группе иммунотерапии соответственно.
При подгрупповом анализе не выявлено достоверных различий ни по одному из критериев (табл. 3), хотя нумерически отмечается небольшое преимущество таргетной терапии в большинстве подгрупп (за исключением стадии IIID и пациентов с изъязвлением первичной опухоли). Пациенты с меланомой без выявленного первичного очага (T0, n = 15), а также с неизвестной толщиной первичной опухоли (Tx, n = 5) и неизвестным статусом изъязвления (n = 25) не включены в данный анализ.
Также стоит отметить, что в группе пациентов со стадией болезни IIIA (n = 19) на медиане наблюдения 33 месяца только у одного пациента в группе иммунотерапии развился локорегионарный рецидив спустя четыре месяца от начала адъювантной терапии. Других случаев рецидива/прогрессирования, а также случаев смерти не было зарегистрировано ни в группе иммунотерапии, ни в группе таргетной терапии.
Обсуждение
В данной работе не продемонстрировано статистически значимого улучшения БРВ в какой-либо группе лекарственной терапии, хотя нумерически значения однолетней и двухлетней БРВ значительно выше в группе таргетной терапии. При этом сами значения БРВ на первом и втором годах в обеих группах в целом сопоставимы с данными, полученными в других ретроспективных работах, описанных в этой статье ранее [6–9]. Возможно, различия в группе не получены, в отличие от некоторых других работ, в связи с малым временем наблюдения за пациентами и малым количеством пациентов в группах [7–9]. Различий в ОВ также не выявлено, как и в других исследованиях.
Подгрупповой анализ не выявил значимых клинических факторов, хотя, как и в другом многоцентровом исследовании [9], в подавляющем большинстве случаев таргетная терапия снизила риски прогрессирования более эффективно, чем иммунотерапия. Различия между таргетной терапией и иммунотерапией, вероятно, обусловлены их разным механизмом действия и чувствительностью пациентов с меланомой к этим двум терапевтическим опциям, что показано ранее во множестве работ на пациентах с метастатической меланомой кожи.
Отдельного внимания заслуживает группа пациентов со стадией IIIA, продемонстрировавших превосходные результаты в отношении БРВ и ОВ. Конечно, малое число больных в этой группе не позволяет делать далеко идущие выводы. Однако полученные значения в целом схожи с результатами более крупного ретроспективного анализа [11] и позволяют задуматься о возможном «избыточном» лечении именно этой категории пациентов, с учетом минимального опухолевого объема болезни («тонкие» меланомы только с микрометастазами в лимфоузлах) и высокими показателями выживаемости на 10 годах.
Стоит с осторожностью оценивать результаты данной работы, учитывая ее ретроспективный наблюдательный характер и, как было упомянуто ранее, малое число пациентов в подгруппах. Требуются более длительное наблюдение, чтобы оценить различия между таргетной терапией и иммунотерапией в отношении БРВ, и поиск возможных биомаркеров. В идеале проведение крупных проспективных рандомизированных исследований позволило бы пролить свет на этот вопрос, но, вероятно, в ближайшем будущем адъювантная терапия уйдет на второй план в связи с активным внедрением неоадъювантного подхода для пациентов с меланомой кожи.
Заключение
На медиане наблюдения 27 месяцев не выявлено достоверных различий между группами таргетной терапии и иммунотерапии. Не выявлено прогностических факторов, предсказывающих большую эффективность какого-либо варианта лечения. Тем не менее у пациентов в группе иммунотерапии прогрессирование болезни наступало чаще и раньше на первых двух годах, чем в группе таргетной терапии. Возможно, таргетная терапия более успешно предотвращает ранние рецидивы. Данные следует интерпретировать с осторожностью, учитывая отсутствие рандомизации, ретроспективный анализ и одноцентровой характер работы. Представлены промежуточные результаты, продолжаются дальнейшее включение пациентов и наблюдение за ними, а также анализ биомаркеров.
A.Ye. Akhmetianova, K.V. Orlova, PhD, V.V. Nazarova, PhD, K.A. Baryshnikov, PhD, I.V. Samoylenko, PhD, K.Yu. Ivanilov, L.V. Demidov, PhD
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Angelina E. Akhmetianova, a.e.akhmetianova@gmail.com
Targeted therapy and anti-PD1 immunotherapy are standard of adjuvant stage III (or equivalent stage III) melanoma treatment. Both treatments significantly improve relapse-free survival compared with placebo and ipilimumab. The impact of adjuvant immunotherapy on overall survival remains unclear. Targeted therapy improved 3-year overall survival, but data didn’t reach statistical significance. There is still a lack of direct comparison in randomized trials between targeted therapy and immunotherapy. Data limited to a few retrospective studies. We conducted a single-center observational retrospective study comparing two adjuvant treatment options in BRAF-mutated high-risk melanoma patients who were treated or consulted at the N.N. Blokhin National Medical Research Center of Oncology.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.