Альфа-липоевая кислота в коррекции электромиографических характеристик диабетической дистальной полинейропатии: фокус на маркеры окислительного стресса
- Аннотация
- Статья
- Ссылки
- English



Дистальная полинейропатия – одно из наиболее распространенных осложнений сахарного диабета (СД), в основе развития которого лежит гипергликемия и индуцированный ею окислительный стресс [1, 2].
Эффект альфа-липоевой кислоты (АЛК) в лечении диабетической полинейропатии, автономной нейропатии убедительно доказан рядом исследований: ALADIN III Study (семимесячное мультицентровое рандомизированное исследование) [3], ALADIN II Study (двухгодичное мультицентровое рандомизированное исследование) [4], DEKAN Study (четырехмесячное рандомизированное контролируемое исследование с использованием АЛК в лечении автономной кардиальной нейропатии) [5]. Эффективность применения таблетированных форм АЛК у детей и подростков продемонстрирована в работе Г.Т. Сивоус и соавт. (2002) [6], препаратов АЛК в лечении нейропатических поражений нижних конечностей у больных СД – в работе С.В. Подачиной и Е.С. Гуменюк (2007) [7].
М.И. Балаболкин и соавт. (2005) указали на возможность коррекции окислительного стресса у больных СД препаратами АЛК [8] и напрямую связывали этот механизм с положительной клинико-инструментальной динамикой.
Механизм действия АЛК давно привлекал внимание исследователей. Было показано, что АЛК корригирует индуцированный гипергликемией эндоневральный дефицит нейропептида Y и субстанции P – нейротрофических пептидов, которые ассоциируются с развитием экспериментальной диабетической нейропатии. Однако применение одной АЛК было недостаточно эффективным: потребовалось добавление гамма-линоленовой кислоты [9].
Биохимические эффекты АЛК были изучены Y. Kishi и соавт. Полученные данные свидетельствуют, что вещество опосредованно воздействует на нервную ткань – участвуя в метаболизме глюкозы, а также влияя на эндотелий, NBF и др. и параметры окислительного стресса [10].
Активация NF-kB (nuclear factor kappa В – ядерный фактор каппа би) может быть ингибирована интенсивной инсулинотерапией, а также такими антиоксидантами, как альфа-токоферол, ацетилцистеин и АЛК [11]. Установлено, что при использовании АЛК в дозе 600 мг/сут уровень NF-kB снижается независимо от гликемического контроля, степени эндотелиальной дисфункции [12].
A. Bierhaus и соавт. (1997) показали, что АЛК блокирует активацию и поступление в ядро NF-kB и экспрессию генов, находящихся под его контролем, в клетках эндотелия в условиях вызванного AGE-альбумином окислительного стресса. Так, M.A. Hofmann и соавт. (1999) отметили, что пероральный прием АЛК в дозе 600 мг в течение трех дней способствует снижению уровня NF-kB в моноцитах крови у больных СД [13].
Кроме того, АЛК демонстрирует редокс-потенциал -320 мВ, который ниже, чем у глютатиона (-280 мВ) [14]. Следовательно, при снижении уровня глютатиона АЛК может его генерировать, а также уменьшать переход цистеина в цистин, что важно для антиоксидантной защиты [2].
АЛК защищает сульфгидрильные группы системы транспортеров глюкозы, способствует фосфорилированию тирозиновых остатков инсулиновых рецепторов, активации транспортеров глюкозы 1 и 4 [15].
Поскольку препарат корригирует уровень эндоневрального глютатиона, можно ожидать повышение скорости проведения импульса по нервному волокну. Однако M.J. Stevens и соавт. (2000), анализируя влияние АЛК (доза 30 мг/кг) на кровоток и митохондриальный оксидативный статус, не зафиксировали увеличения скорости распространения волны (СРВ). Уровень глютатиона в бедренном нерве также оставался неизменным [16].
Информация о влиянии АЛК на окислительную модификацию белков (ОМБ) единична [13].
Целью нашего исследования стала оценка влияния АЛК на динамику электромиографических показателей у больных СД, осложненным дистальной сенсомоторной полинейропатией, путем сопоставления результатов с динамикой маркеров окислительного стресса.
Материал и методы
Исследование одобрено локальным этическим комитетом Нижегородской областной клинической больницы им. Н.А. Семашко.
Обследовано 72 пациента, страдавших СД типа 2, осложненным дистальной сенсомоторной полинейропатией. Все пациенты получали базисную сахароснижающую терапию. Участников разделили на три группы: основную (n = 46) – получала Берлитион (600 мг внутривенно капельно на 200 мл физиологического раствора хлорида натрия № 10), сравнения (n = 16) – не получала препаратов АЛК, плацебо (n = 10).
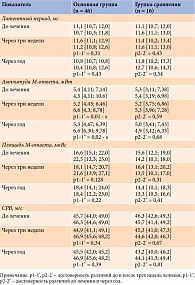
По полу, возрасту пациентов, длительности заболевания, уровню гликированного гемоглобина (HbA1c), наличию сопутствующих заболеваний, объему сахароснижающей терапии группы статистически значимо не различались (табл. 1).
У пациентов оценивалась динамика маркеров окислительного стресса до и после трех недель инфузионной терапии (вводили 200 мл физиологического раствора хлорида натрия).
Исходно, через три недели терапии в стационаре и через год проводились комплексные клинико-лабораторные и инструментальные обследования, включая электромиографию (ЭМГ), исследование динамики маркеров окислительного стресса.
ЭМГ осуществлялась на аппарате «MBN-нейромиограф» (Россия) при помощи стимулирующего поверхностного пластинчатого электрода (катод – дистально, анод – проксимально), а отведение – стандартным набором монополярных пластинчатых электродов диаметром 5 мм. Исследования проводились в стабильных микроклиматических условиях, экранированном кабинете. Использовался постоянный прямоугольный ток частотой 1 Гц, длительностью 200 мс. Подбиралась супрамаксимальная сила тока [17].
Оценивались моторные порции малоберцовых нервов: амплитуда моторного ответа (М-ответ), его длительность, площадь, латентность, СРВ, а также процессы свободнорадикального окисления (СРО): интенсивность и светосумма, молекулярные продукты, модифицированные белки, антиоксидантные ферменты. Использовали следующие показатели:
Imax – максимальная интенсивность свечения исследуемой пробы (в mV). Определялась методом индуцированной хемилюминесценции;
S – светосумма хемилюминесценции за определенное время. Показатель обратно пропорционален антиоксидантной активности пробы, в относительной степени отражает содержание радикалов, соответствующих обрыву цепи СРО [18];
первичные продукты перекисного окисления липидов (ПОЛ) (диеновые конъюгаты (ДК)) и вторичные (триеновые конъюгаты (ТК)). Регистрировались прямыми УФ-спектрофотометрическими методами. Молекулярные продукты ПОЛ плазмы крови определяли с помощью метода J. Folch [19].
Малоновый диальдегид (МДА) определяли в результате реакции с тиобарбитуровой кислотой при длине волны 532 нм [20].
Конечные продукты – основания Шиффа (ОШ) оценивали с помощью метода D.L. Fletcher [20].
Для определения ОМБ использовали метод R.L. Levine в модификации Е.Е. Дубининой [20, 21]. ОМБ оценивали по уровню карбонильных производных, выявляемых при реакции с 2,4-динитрофенилгидразином: альдегид-динитрофенилгидразоны (АДФГ) и кетон-динитрофенилгидразоны (КДФГ). Спонтанную и металл-зависимую индуцированную ОМБ анализировали одновременно. Оптическая плотность образовавшихся соединений регистрировалась при длинах волн 270 и 363 нм, измерение проводилось в относительных единицах.
Метод определения активности супероксиддисмутазы (СОД) был разработан M. Nishicimi, адаптирован Е.Е. Дубининой и соавт. Принцип определения активности каталазы (КАТ) разработан H. Aebi, адаптирован М.А. Королюк и соавт. (1988) [22].
Активность глутатионпероксидазы (ГП) и глутатионредуктазы оценивалась по методу А.Г. Гавриловой. Активность ГП определялась спектрофотометрически при длине волны 260 нм [20, 22].
Результаты исследования обрабатывались на компьютере IBM PC при помощи пакета прикладных программ для обработки медицинской и биологической информации STATISTICA 6.0 (StatSoft, Inc., США). Рассчитывались средняя (М) и стандартное отклонение (SD).
Характер распределения определялся при помощи критериев Шапиро – Вилко и Колмогорова – Смирнова. Параметрические данные описывали в виде М ± SD. Непараметрические данные – в виде медианы с указанием 25-го и 75-го процентилей – Мe [25%; 75%] [23].
Результаты и их обсуждение
В основной группе на фоне приема Берлитиона, в отличие от группы сравнения, достоверно повышались амплитуда М-ответа (p = 0,0002) и его площадь (p = 0,006). Изменение амплитуды М-ответа через год статистически значимо было только в основной группе (p = 0,02). СРВ вследствие терапии Берлитионом увеличилась в среднем на 1,4 м/с, и эти изменения сохранялись в течение года (результаты статистически недостоверны).
Динамика электромиографических показателей под действием Берлитиона представлена в табл. 2.
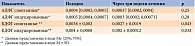
Анализ взаимосвязи интенсивности СРО и основных электромиографических показателей продемонстрировал, что амплитуда М-ответа достоверно отрицательно коррелирует с интенсивностью СРО (r = -0,56, p = 0,044) и содержанием МДА (r = -0,65, p= 0,021), однако слабо и недостоверно связана с общей антиоксидантной активностью (ОАА). Аналогичные данные получены и в отношении СРВ (табл. 3).
Возможно, ОАА как интегральный показатель недостаточно объективно отражает влияние всех звеньев антиоксидантной защиты на нервные волокна. Поэтому мы решили уточнить взаимосвязь отдельных антиоксидантных ферментов с электромиографическими показателями. У 64 пациентов отмечена положительная корреляция между СОД и СРВ (r = 0,54, p = 0,047) и обратная корреляция между ОШ и СРВ (r = -0,52, p = 0,044). При этом амплитуда М-ответа значимо коррелировала с активностью ГП (r = 0,61, p = 0,044), зафиксирована заметная отрицательная корреляционная зависимость между интенсивностью СРО и уровнем ДК и ТК (табл. 4).
Кроме того, прием Берлитиона способствовал достоверному снижению интенсивности СРО и активации ферментов антиоксидантной системы (p < 0,001). Статистически значимо повышались ОАА (p = 0, 033), КАТ (p = 0,004), ГП (p < 0,001), в связи с чем зафиксировано снижение интенсивности СРО (p < 0,001), уровня ДК (р = 0,07), ТК (р = 0,05), МДА (р = 0,004), ОШ (р = 0,036). Эти данные еще раз подтверждают универсальность механизма АЛК как антиоксиданта (табл. 5).
Применение АЛК останавливало ОМБ: как спонтанные (p = 0,043), так и индуцированные (p = 0,032) КДФГ (табл. 6). Известно, что повышенный уровень КДФГ свидетельствует об истощении резервно-адаптационных возможностей организма. Уменьшение содержания данного маркера подтверждает ограничение окислительного стресса, что, безусловно, положительно влияет на динамику электромиографических показателей.
Следовательно, ограничение окислительного стресса (ОМБ, ПОЛ) в результате нормализации активности Na+, K+-аденозинтрифосфатазы способствует восстановлению равновесного потенциала Na+ и уменьшению отека в перехватах Рантье, что приводит к восстановлению нервных волокон. Ограничение окислительного стресса также влияет на снижение неферментативного гликозилирования, что предупреждает новый виток генерации свободных радикалов. Кроме того, нормализуется содержание NO и его биологическая эффективность, в связи с чем корригируется эндоневральный кровоток. Все это способствует уменьшению проявлений дистальной нейропатии.
Заключение
Результаты исследования показали эффективность терапии Берлитионом у больных СД типа 2, осложненным дистальной сенсомоторной полинейропатией. В частности, отмечена динамика электромиографических характеристик, достоверно коррелирующих с разными маркерами окислительного стресса.
O.V. Zanozina, G.P. Runov, N.N. Borovkov, Yu.A. Sorokina
Nizhny Novgorod State Medical Academy
Contact person: Olga Vladimirovna Zanozina, zwx2@mail.ru
Lower limb distal polyneuropathy is among the most frequent late complications, more precisely, manifestations of diabetes mellitus. Therapeutic efficacy of alpha-lipoic acid during treatment of this complication was confirmed in several multi-center randomized studies. In the current paper, we demonstrated a therapeutic efficacy of Berlition in patients with type 2 diabetes mellitus complicated with distal sensorimotor polyneuropathy as evaluated by dynamics of electroneuromyographic parameters, which significantly correlated with various parameters of oxidative stress.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.