Алгоритм диагностики и дифференцированной иммуномодулирующей терапии при гнойно-воспалительных заболеваниях у иммунокомпрометированных детей
- Аннотация
- Статья
- Ссылки
- English
Цель – усовершенствовать методы диагностики и лечения иммунокомпрометированных детей с гнойно-воспалительными заболеваниями.
Материал и методы. Нами обследовано 174 ребенка в возрасте от одного года до 18 лет с ГВЗ: острая деструктивная пневмония – 67 детей; острая деструктивная пневмония, осложненная сепсисом, – 33 ребенка; острый гематогенный остеомиелит – 74 ребенка, из них с острым гематогенным остеомиелитом местноочаговой формы – 56 детей, с острым гематогенным остеомиелитом септикопиемической формы – 18 детей. Проводились следующие методы исследования: клинические, инструментальные, лабораторные, в том числе иммунологические (оценка Т-клеточного и гуморального иммунитета, естественных киллерных клеток, нейтрофильных гранулоцитов).
Результаты. На основании предложенных наиболее информативных клинических, инструментальных, лабораторных, в том числе иммунологических, критериев уточнены тяжесть течения ГВЗ и иммунофенотип вторичного иммунодефицита, что позволило разработать программы иммуномодулирующей терапии. В лечении детей с ГВЗ применялась тактика дифференцированной иммуномодулирующей терапии, включающая в себя использование одного иммунотропного препарата – внутривенных иммуноглобулинов (ВВИГ) или Имунофана, а также комбинированную иммунотерапию с последовательным применением ВВИГ и Имунофана. Персонифицированная иммуномодулирующая терапия при ГВЗ у детей демонстрирует позитивную клинико-иммунологическую эффективность и имеет преимущества по сравнению с традиционной терапией. На основе полученных результатов разработана программа ЭВМ «Лечебно-диагностическая технология выбора иммуномодулирующей и заместительной иммуномодулирующей терапии детей с гнойно-воспалительными заболеваниями», позволяющая использовать тактику дифференцированной иммуномодулирующей терапии при ГВЗ в зависимости от возраста детей, тяжести течения заболевания, иммунофенотипа вторичного иммунодефицита.
Заключение. Созданная программа позволяет оптимизировать лечебно-диагностический процесс за счет повышения точности диагностики и значительного упрощения принятия клинических решений врачами в выборе эффективной иммуномодулирующей терапии, что способствует улучшению течения и исхода ГВЗ у детей, восстановлению противоинфекционного иммунитета.
Цель – усовершенствовать методы диагностики и лечения иммунокомпрометированных детей с гнойно-воспалительными заболеваниями.
Материал и методы. Нами обследовано 174 ребенка в возрасте от одного года до 18 лет с ГВЗ: острая деструктивная пневмония – 67 детей; острая деструктивная пневмония, осложненная сепсисом, – 33 ребенка; острый гематогенный остеомиелит – 74 ребенка, из них с острым гематогенным остеомиелитом местноочаговой формы – 56 детей, с острым гематогенным остеомиелитом септикопиемической формы – 18 детей. Проводились следующие методы исследования: клинические, инструментальные, лабораторные, в том числе иммунологические (оценка Т-клеточного и гуморального иммунитета, естественных киллерных клеток, нейтрофильных гранулоцитов).
Результаты. На основании предложенных наиболее информативных клинических, инструментальных, лабораторных, в том числе иммунологических, критериев уточнены тяжесть течения ГВЗ и иммунофенотип вторичного иммунодефицита, что позволило разработать программы иммуномодулирующей терапии. В лечении детей с ГВЗ применялась тактика дифференцированной иммуномодулирующей терапии, включающая в себя использование одного иммунотропного препарата – внутривенных иммуноглобулинов (ВВИГ) или Имунофана, а также комбинированную иммунотерапию с последовательным применением ВВИГ и Имунофана. Персонифицированная иммуномодулирующая терапия при ГВЗ у детей демонстрирует позитивную клинико-иммунологическую эффективность и имеет преимущества по сравнению с традиционной терапией. На основе полученных результатов разработана программа ЭВМ «Лечебно-диагностическая технология выбора иммуномодулирующей и заместительной иммуномодулирующей терапии детей с гнойно-воспалительными заболеваниями», позволяющая использовать тактику дифференцированной иммуномодулирующей терапии при ГВЗ в зависимости от возраста детей, тяжести течения заболевания, иммунофенотипа вторичного иммунодефицита.
Заключение. Созданная программа позволяет оптимизировать лечебно-диагностический процесс за счет повышения точности диагностики и значительного упрощения принятия клинических решений врачами в выборе эффективной иммуномодулирующей терапии, что способствует улучшению течения и исхода ГВЗ у детей, восстановлению противоинфекционного иммунитета.





Введение
Актуальность проблемы лечения детей, страдающих нетипично протекающими гнойно-воспалительными заболеваниями (ГВЗ) на фоне нарушений противобактериальной иммунной защиты, не вызывает сомнений. В России ежегодно регистрируется около 12–13 тыс. детей с ГВЗ, при этом сохраняется высокая летальность (от 2 до 13%) и инвалидизация (от 5 до 30%) детского населения [1–3]. Многочисленными исследованиями показано, что при затяжных и вялотекущих инфекционно-воспалительных заболеваниях, в том числе ГВЗ, различные нарушения функционирования иммунной системы препятствуют своевременной элиминации патогенов, что в конечном итоге приводит к поддержанию воспаления, усугублению тяжести течения заболеваний [4–6]. Нарушения функционирования нейтрофильных гранулоцитов (НГ) способствуют возникновению тяжело и длительно протекающих ГВЗ, характеризующихся нетипичностью проявлений и не отвечающих на стандартную антибактериальную терапию [7, 8]. Нейтрофильные гранулоциты обладают большим комплексом возможностей и способны выполнять большой объем специализированных эффекторных функций, направленных на элиминацию патогенов, ассоциированных с их фенотипическими особенностями и наличием различных субпопуляций [9, 10]. Важно отметить, что традиционные методы лечения, заключающиеся в использовании имеющейся этиотропной и патогенетической терапии, могут быть малоэффективны, поскольку не включают иммунотерапевтические воздействия, направленные на коррекцию различных вариантов дефектов иммунной системы и их сочетаемости. Исходя из этого, актуальна разработка лечебных технологий с включением в комплексное лечение патогенетически обоснованной иммуномодулирующей терапии, направленной на восстановление как адекватного функционирования НГ в частности, так и иммунной системы в целом, что будет способствовать оптимизации лечения детей с ГВЗ, сокращению сроков госпитализации и расходов на лечение, профилактике антибиотикорезистентности и осложнений, что существенно снизит риск летальных исходов и инвалидизации [8, 11]. Кроме того, к настоящему времени в арсенале клиницистов находится большое количество иммунотропных препаратов разнонаправленного действия, что тоже создает определенные трудности в выборе тактики иммунотерапии. Разработка лечебно-диагностического алгоритма позволит облегчить эту задачу и предложить готовые решения по проведению иммуномодулирующей терапии на основе определения дефектов функционирования иммунной системы у пациентов с ГВЗ.
Цель исследования
Цель исследования – усовершенствовать методы диагностики и лечения иммунокомпрометированных детей с гнойно-воспалительными заболеваниями.
Материал и методы
Для реализации поставленной цели под нашим наблюдением находились дети от одного года до 18 лет с ГВЗ, поступившие в хирургическое отделение Детской краевой клинической больницы (г. Краснодар): с острой деструктивной пневмонией (ОДП) – 67 детей; острой деструктивной пневмонией, осложненной сепсисом, – 33 ребенка; острым гематогенным остеомиелитом (ОГО) – 74 ребенка, из них с острым гематогенным остеомиелитом местноочаговой формы – 56 детей, с острым гематогенным остеомиелитом септикопиемической формы – 18 детей.
При поступлении в стационар проводилось комплексное обследование детей с ГВЗ, включавшее клиническое обследование (сбор жалоб, анамнеза заболевания и жизни, объективный осмотр, оценку локального статуса), инструментальное обследование (рентгендиагностику – рентгенографию, компьютерную томографию, магнитно-резонансную томографию, ультразвуковое исследование), лабораторные исследования (общеклинические, биохимические, иммунологические, бактериологические).
В соответствии с Международной классификацией болезней 10-го пересмотра в исследуемые группы входили дети с установленными диагнозами:
- ОДП – J18.9 «Пневмония неуточненная»; J85.1 «Абсцесс легкого с пневмонией»; J86 «Пиоторакс»; J93 «Пневмоторакс»;
- ОГО – М86.0 «Острый гематогенный остеомиелит»; М86.9 «Остеомиелит неуточненный».
Проведено комплексное исследование иммунной системы детей с ГВЗ. Методом проточной цитофлуориметрии на Сytomics FC500 (Веckman Coulter, США) с соответствующими моноклональными антителами (Beckman Coulter International S.A., Франция) проведено иммунофенотипирование Т- и В-лимфоцитов (CD3+CD19-, CD3+CD4+, CD3+CD8+, CD3-CD19+), естественных киллерных клеток (ЕКК) (CD3-CD16+CD56+) периферической крови (ПК), рассчитан иммунорегуляторный индекс (ИРИ) (CD3+CD4+/CD3+CD8+).
Оценены субпопуляции НГ: %СD66b+CD16+CD33+HLA-DR+, CD16+СD32+СD11b+ и СD64+CD16+СD32+СD11b+ – с последующим определением расчетного индекса НГ (РИНГ) [12, 13]:
%СD64-CD16+СD32+СD11b+/%СD64+CD16+СD32+СD11b+.
Тестирование фагоцитарной и микробицидной функции НГ осуществлялось с определением количества активно фагоцитирующих Staphylococcus aureus НГ (%ФАН), с оценкой захвата бактерий (фагоцитарное число (ФЧ), фагоцитарный индекс (ФИ)) и переваривающей активности (процент переваривания (%П), индекс переваривания (ИП)). Методом иммуноферментного анализа определяли уровни сывороточных иммуноглобулинов (Ig) – IgA, IgM, IgG.
Для разработки программного обеспечения (программы ЭВМ), позволяющего оптимизировать диагностику и лечение детей с ГВЗ, возникла необходимость в комплексной оценке состояния детей (клинических, инструментальных, лабораторных и иммунологических показателей) не только при поступлении и перед оперативным вмешательством, но и при выписке из стационара при условии разрешения гнойно-воспалительного очага в целях оценки эффективности комплексного лечения с включением иммуномодулирующей терапии.
Нами разработана программа ЭВМ «Лечебно-диагностическая технология выбора иммуномодулирующей и заместительной иммуномодулирующей терапии детей с гнойно-воспалительными заболеваниями» (свидетельство о государственной регистрации программы для ЭВМ № 2025687394 от 09.10.2025).
Для статистической обработки данных применялась программа SPSS Statistics 20. Нормальность распределения данных в исследуемых выборочных совокупностях оценивалась с помощью критерия Шапиро – Уилка. При распределении, отличном от нормального, статистическая значимость различий между независимыми выборками устанавливалась с использованием непараметрического критерия Манна – Уитни.
Результаты представлены в виде медианы (Ме) и квартильного диапазона (Q1; Q3).
Статистически значимыми считали различия при p < 0,05.
Результаты и их обсуждение
В результате диагностического поиска при комплексном обследовании детей с ОДП и ОГО были выделены наиболее информативные клинические, лабораторные и рентгенологические признаки, позволяющие оценить тяжесть течения заболевания (табл. 1 и 2).
При исследовании иммунной системы детей с ГВЗ определены иммунологические параметры, наиболее полно отражающие полноценность функционирования Т-клеточного и гуморального иммунитета, ЕКК, НГ. Был использован комплексный подход к оценке системы НГ. В качестве наиболее показательных для установления дефектов функционирования НГ выбраны %НГ, %ФАН и %П. Дополнительными критериями оценки функционирования НГ являлись РИНГ и содержание субпопуляции CD66b+CD16+CD33+HLA-DR+ НГ, диагностически значимые для определения степени тяжести течения гнойно-воспалительных процессов различной локализации (патент № 2825251 от 22.08.2024). Для клинических критериев и инструментальных данных была разработана балльная шкала оценки. После статистической обработки результатов исследования для лабораторных и иммунологических параметров были определены интервалы, позволяющие принять значения в виде сниженных, нормальных или повышенных и отразить их в баллах, что позволило выявить дефекты Т-клеточного иммунитета (ТИ), дефекты ЕКК, дефекты гуморального иммунитета (ГИ), дефекты НГ (см. табл. 1 и 2). Дополнительные параметры дисфункции НГ (РИНГ и %CD66b+CD16+CD33+HLA-DR+ НГ) при отсутствии возможности их определения могут не учитываться при работе с программой ЭВМ. Это имеет значение только для итоговой суммы баллов и не повлияет на конечный результат, связанный с выбором программы иммуномодулирующей терапии при ОДП и ОГО у иммунокомпрометированных детей.
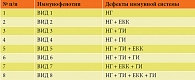
В результате исследований определено восемь возможных вариантов лабораторных иммунофенотипов вторичного иммунодефицита (ВИД) у иммунокомпрометированных детей с ОДП и ОГО (табл. 3).
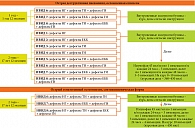
В зависимости от возраста пациента, тяжести гнойно-воспалительного заболевания (ОДП; ОДП, осложненная сепсисом; местноочаговая форма ОГО, септикопиемическая форма ОГО), выявленного лабораторного иммунофенотипа ВИД (ИВИД) были разработаны программы дифференцированной моно- или комбинированной иммуномодулирующей терапии, включенные в комплексное лечение детей с данной патологией. Препаратами выбора для проведения иммуномодулирующей терапии у детей с острыми ГВЗ были Имунофан и внутривенные иммуноглобулины (ВВИГ).
Имунофан (аргинил-α-аспартил-лизил-валил-тирозил-аргинин диацетат) является препаратом широкого спектра иммуномодулирующего действия, который влияет на различные иммунокомпетентные клетки через взаимодействие с толл-2-подобными рецепторами, никотиновыми ацетилхолиновыми рецепторами нейронального типа, а также молекулами комплекса гистосовместимости 2-го типа – HLA-DR. Кроме того, Имунофан усиливает действие антибактериальных препаратов и препятствует формированию резистентности патогенных микроорганизмов к антибактериальным препаратам, а также демонстрирует гепатопротективные свойства, антиоксидантную активность, нейтрализуя свободные радикалы и предотвращая оксидативный стресс [8, 11, 14].
Для восстановления антибактериального иммунитета, в первую очередь восполнения дефицита IgG, при тяжелых ГВЗ показаны и успешно используются препараты внутривенных иммуноглобулинов [15]. Иммуномодулирующий эффект ВВИГ также обусловлен усилением эффекторных функций НГ через их взаимодействие с рецепторами к иммуноглобулинам – FcγR, нейтрализацией и элиминацией микробных патогенов, бактериальных токсинов, суперантигенов и патологических иммунных комплексов, активацией системы комплемента и адаптивного иммунитета. Внутривенные иммуноглобулины обладают противовоспалительным эффектом за счет модуляции реакции воспаления, ингибирования провоспалительных цитокинов и стимуляции выработки их антагонистов [16, 17].
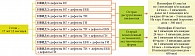
Моноиммуномодулирующая терапия включает использование Имунофана или ВВИГ, курсовая доза которых зависит от возраста пациента, тяжести течения ГВЗ и выявленного лабораторного иммунофенотипа ВИД. Комбинированная иммуномодулирующая терапия состояла из последовательного использования сначала ВВИГ, затем Имунофана в курсовых дозах, зависящих от возраста пациента, тяжести течения ГВЗ и выявленного лабораторного иммунофенотипа ВИД (рис. 1 и 2).
Разработанные программы дифференцированной иммуномодулирующей терапии продемонстрировали высокую клинико-иммунологическую эффективность. Так, на фоне позитивных иммунологических эффектов наблюдались выраженные клинические изменения в виде более быстрого регресса гнойного очага, уменьшения длительности дренирования гнойного очага, раннего купирования температурной реакции, интоксикационного синдрома и полиорганной недостаточности, сокращения дней пребывания в отделении реанимации и интенсивной терапии, длительности госпитализации и объемов антибактериальной терапии.
Анализ полученных данных позволил разработать для практикующих врачей алгоритм «Лечебно-диагностическая технология выбора иммуномодулирующей и заместительной иммуномодулирующей терапии детей с гнойно-воспалительными заболеваниями» (свидетельство о государственной регистрации программы для ЭВМ № 2025687394 от 09.10.2025), направленный на оптимизацию диагностики и лечения детей с различными ГВЗ, такими как ОГО и ОДП.
Эффективность предложенного лечебно-диагностического алгоритма демонстрируют следующие клинические примеры.
Клинический случай 1. Пациентка М. двух лет находилась на стационарном лечении в хирургическом отделении № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
Диагноз: Острая левосторонняя деструктивная полисегментарная пневмония. ДН 2 ст. Вторичный иммунодефицит, комбинированный.
Клинические проявления: в течение пяти дней отмечались жалобы на повышение температуры до 38,7 °С, малопродуктивный кашель, одышку. Проявления интоксикации: общая слабость, снижение аппетита, однократная рвота, бледность кожных покровов.
Рентгенографические признаки левосторонней деструктивной полисегментарной пневмонии.
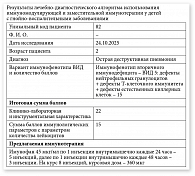
Лабораторно отмечались выраженный лейкоцитоз – 23,3 × 109/л, повышение скорости оседания эритроцитов (СОЭ) до 28 мм/ч и уровня С-реактивного белка (СРБ) до 106 мг/л. Иммунофенотип вторичного иммунодефицита – ВИД 5: дефекты НГ + дефекты ТИ + дефекты ЕКК (рис. 3). Ребенку проводилось комплексное послеоперационное лечение, включавшее антибактериальную терапию, противогрибковую, дезинтоксикационную, симптоматическую и иммуномодулирующую терапию препаратом Имунофан по следующей схеме: 45 мкг/мл по одной инъекции в/м каждые 24 часа – пять инъекций, далее по одной инъекции в/м каждые 48 часов – три инъекции (на курс восемь инъекций, курсовая доза – 360 мкг) (см. рис. 3).
На фоне комплексного лечения отмечались регресс гнойно-воспалительного очага в легких, санация респираторного тракта с улучшением эвакуации мокроты, купирование дыхательной недостаточности и интоксикационного синдрома.
Исход заболевания – выздоровление. Срок госпитализации – 20 дней.
Клинический случай 2. Пациент С. пяти лет находился на стационарном лечении в хирургическом отделении № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
Диагноз: Сепсис. Острая бактериальная деструктивная пневмония слева, легочно-плевральная форма. Абсцесс нижней доли левого легкого. Экссудативно-фиброзный плеврит слева. Напряженный гидроторакс слева. Катаральный двусторонний эндобронхит. ДН 3 ст. Анемия смешанного генеза средней степени тяжести. Ненапряженный гидроперикард. Острая гипоксически-дисметаболическая энцефалопатия. Вторичный комбинированный иммунодефицит.
Анамнез заболевания: ребенок в течение 11 дней переносил острую респираторную вирусную инфекцию, осложненную острой левосторонней полисегментарной пневмонией. Лечение проводилось амбулаторно и в условиях детской инфекционной больницы. В качестве этиотропной терапии использовались противовирусные препараты и антибактериальная терапия – перорально азитромицин в течении трех дней с переходом на цефиксим. Состояние ребенка ухудшилось, и он был переведен в хирургическое отделение № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края с диагнозом: Сепсис. Острая бактериальная деструктивная левосторонняя пневмония, легочно-плевральная форма. Левосторонний напряженный плеврит.
При поступлении в хирургическое отделение отмечались пиретическая температура тела – 39,2 °С, влажный кашель с гнойной мокротой, одышка в покое, вынужденное положение тела в постели – на левом боку, вялость, адинамия, мраморность кожных покровов, потеря аппетита. Ребенок не вступал в контакт.
Рентгенографические признаки инфильтрации легочной ткани в левом легком без четких границ с множественными мелкоячеистыми просветлениями, экссудативного плеврита.
Лабораторно отмечались: содержание лейкоцитов – 8,1 × 109/л, повышение СОЭ до 42 мм/ч и уровня СРБ до 153 мг/л. Иммунофенотип вторичного иммунодефицита – ВИД 7: дефекты НГ + дефекты ЕКК + дефекты ГИ (рис. 4). Ребенку проводилось комплексное послеоперационное лечение, включавшее антибактериальную терапию (цефтриаксон + сульбактам, ванкомицин), противогрибковую, дезинтоксикационную, симптоматическую терапию, восстановление гемодинамических нарушений, а также комбинированную иммуномодулирующую терапию ВВИГ в возрастной дозе в количестве трех инфузий через день с последующим переходом на инъекции препаратом Имунофан по схеме: 45 мкг/мл по одной инъекции в/м каждые 24 часа – пять инъекций, далее по одной инъекции в/м каждые 48 часов – пять инъекций (на курс десять инъекций, курсовая доза – 450 мкг) (см. рис. 4).
На фоне комплексного лечения отмечались регресс гнойно-воспалительного очага в легких, плеврита, купирование дыхательной недостаточности и интоксикационного синдрома, печеночной недостаточности, гемодинамических нарушений, нарушений водно-электролитного баланса.
Ребенок выписан с улучшением для дальнейшего наблюдения участковым врачом и иммунологом. Срок госпитализации – 42 дня.
Клинический случай 3. Пациент Д. восьми лет находился на стационарном лечении в хирургическом отделении № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
Диагноз: Острый гематогенный остеомиелит дистального метадиафиза правой бедренной кости, местноочаговая форма, среднетяжелое течение.
Анамнез заболевания: у ребенка было острое начало заболевания после короткого продромального периода, при поступлении в стационар на четвертый день от начала заболевания наблюдалась гипертермия до 39,7–40,0 °С, нарастающий интоксикационный синдром, боли распирающего характера в пораженной нижней конечности, максимально выраженные над очагом воспаления, и вынужденное положение конечности.
Рентгенологически отмечались признаки остеомиелита дистального метадиафиза правой бедренной кости.
Лабораторно отмечались: количество лейкоцитов – 9,36 × 109/л, высокий уровень СРБ – 60 мг/мл, высокая СОЭ – 17 мм/ч. Иммунофенотип вторичного иммунодефицита – ВИД 3: дефекты НГ + дефекты ТИ (рис. 5).
Ребенок получал комплексное лечение: хирургическое пособие, антибактериальную терапию, дезинтоксикационную терапию, иммуномодулирующую терапию препаратом Имунофан по схеме: 45 мкг/мл по одной инъекции в/м каждые 24 часа – три инъекции, далее по одной инъекции в/м каждые 48 часов – три инъекции, далее по одной инъекции в/м каждые 24 часа – четыре инъекции (на курс десять инъекций, курсовая доза – 450 мкг) (см. рис. 5), что сопровождалось позитивными клиническими эффектами и восстановлением иммунологических показателей.
Местный гнойно-воспалительный процесс купировался на шестые сутки. Восстановление функции в пораженной конечности произошло на 14-е сутки. Ранние послеоперационные осложнения отсутствовали.
Клинический случай 4. Пациент К. 15 лет. Находился на лечении в хирургическом отделении № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
Предварительный диагноз: острый гематогенный остеомиелит костей левого тазобедренного сустава.
Анамнез заболевания: на 14-й день от начала заболевания наблюдались гипертермия – 38,0–38,5 °С, выраженный интоксикационный сидром, боль и ограничение движений в левом тазобедренном суставе.
Выявлены гемодинамические нарушения, печеночная и почечная недостаточность.
Лабораторно отмечались: количество лейкоцитов – 6,13 × 109/л, выраженное повышение СРБ до 174 мг/л и СОЭ до 37 мм/ч.
Рентгенологически определено, что гнойно-воспалительный процесс локализовался в костях левого тазобедренного сустава. Иммунофенотип вторичного иммунодефицита – ВИД 8: дефекты НГ + дефекты ТИ + дефекты ЕКК + дефекты ГИ (рис. 6).
Окончательный диагноз: острый гематогенный остеомиелит костей левого тазобедренного сустава, септикопиемическая форма, тяжелое течение.
Ребенок получал комплексное лечение: хирургическое пособие, комбинированную антибактериальную терапию, дезинтоксикационную терапию, гепаринотерапию, коррекцию гемодинамических и водно-электролитных нарушений и иммунокорригирующую терапию – ВВИГ в возрастной дозе в количестве трех инфузий через день с последующим переходом на инъекции препаратом Имунофан по схеме: 45 мкг/мл по одной инъекции в/м каждые 24 часа – три инъекции, далее по одной инъекции в/м каждые 48 часов – три инъекции, далее по одной инъекции в/м каждые 24 часа – четыре инъекции (на курс десять инъекций, курсовая доза – 450 мкг) (см. рис. 6).
Наблюдались позитивный клинический эффект и восстановление иммунологических показателей. У пациента отмечались регресс гнойного очага в костной ткани, купирование проявлений почечной и печеночной недостаточности.
Срок госпитализации – 28 койко-дней. Восстановление функции в тазобедренном суставе наблюдалось на 40-е сутки.
Заключение
Несмотря на достигнутые успехи в лечении детей с тяжелой гнойно-воспалительной и гнойно-септической патологией, по-прежнему сохраняется высокая заболеваемость острой деструктивной пневмонией, острым гематогенным остеомиелитом, нередко осложняющихся сепсисом. Отчасти это связано с ростом антибиотикорезистентности, нарушением механизмов противоинфекционного иммунитета. Кроме того, впоследствии у детей, перенесших данные ГВЗ, регистрируется различная соматическая патология на фоне сохраняющейся дисфункции иммунной системы. Сложности в диагностике тяжести течения гнойно-воспалительных заболеваний, ассоциированных с вариативными дефектами функционирования иммунной системы, в выборе тактики иммуномодулирующей терапии диктуют необходимость комплексного подхода к решению поставленных задач, что позволит существенно улучшить и персонифицировать используемые лечебно-диагностические мероприятия. Предлагаемая лечебно-диагностическая технология имеет существенные преимущества по сравнению с применением только традиционной терапии. Она предусматривает использование дифференцированной иммуномодулирующей терапии в зависимости от возраста детей, тяжести течения ГВЗ, иммунофенотипа ВИД и включает моноиммунотерапию ВВИГ или Имунофаном, а также комбинированную иммунотерапию с последовательным применением ВВИГ и Имунофана. Созданная программа ЭВМ «Лечебно-диагностическая технология выбора иммуномодулирующей и заместительной иммуномодулирующей терапии детей с гнойно-воспалительными заболеваниями» включает наиболее информативные клинические, инструментальные, лабораторные, в том числе иммунологические, критерии, более емко характеризующие тяжесть течения гнойно-воспалительного процесса, что улучшает точность диагностики и значительно облегчает принятие клинических решений врачами в выборе эффективной иммуномодулирующей терапии.
Информация о финансировании. Исследование выполнено в рамках реализации мероприятий программы стратегического академического лидерства «Приоритет 2030» в ФГБОУ ВО КубГМУ Минздрава России на тему «Разработка диагностических и лечебных технологий при гнойно-воспалительных заболеваниях, ассоциированных с приобретенным/вторичным иммунодефицитом и вариативными дисфункциями нейтрофильных гранулоцитов».
I.V. Nesterova, MD, PhD, Prof., S.V. Kovaleva, MD, PhD, Prof., G.A. Chudilova, DBS, Prof., L.V. Lomtatidze, PhD, V.N. Chapurina, PhD, E.A. Poezzhaev, A.D. Safontseva, Yu.V. Teterin, S.N. Pikturno, A.I. Pirogova
Kuban State Medical University
Peoples' Friendship University named after Patrice Lumumba
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
The treatment of children with purulent inflammatory diseases (PIDs) is an urgent issue. Various immune dysfunctions play a key role in their development, hindering the timely elimination of pathogens and leading to aggravation of the disease's severity. Timely identification of clinical criteria for PIDs severity and diagnosis of immune dysfunctions can significantly improve the course and outcome of diseases and reduce the economic costs of providing medical care.
Objective – to improve diagnostic and treatment methods for immunocompromised children with PIDs.
Material and methods. We studied 174 children aged 1 to 18 years with PIDs: acute destructive pneumonia – 67 children; acute destructive pneumonia complicated by sepsis – 33 children; acute hematogenous osteomyelitis was diagnosed in 74 children, including 56 children with focal acute hematogenous osteomyelitis and 18 children with septicopyemic acute hematogenous osteomyelitis. The following examination methods were used: clinical, instrumental, laboratory, including immunological (assessment of T-cell and humoral immunity, natural killer cells, and neutrophil granulocytes).
Results. Based on the proposed most informative clinical, instrumental, laboratory, and immunological criteria, the severity of PIDs and the immunophenotype of secondary immunodeficiency were clarified, which enabled the development of immunomodulatory therapy programs. A differentiated immunomodulatory therapy approach was used to treat children with purulent inflammatory diseases. This approach included the use of a single immunotropic agent – intravenous immunoglobulins (IVIG) or Imunofan – as well as combination immunotherapy with sequential use of IVIG and Imunofan. Personalized immunomodulatory therapy for purulent inflammatory diseases in children demonstrates positive clinical and immunological efficacy and has advantages over traditional therapy. Based on the obtained results, a computer program, ‘Therapeutic and diagnostic technology for selecting immunomodulatory and replacement immunomodulatory therapy for children with purulent inflammatory diseases’, was developed. This program enables the use of differentiated immunomodulatory therapy for purulent inflammatory diseases depending on the child's age, disease severity, and the immunophenotype of the secondary immunodeficiency.
Conclusion. The developed program optimizes the treatment and diagnostic process by increasing diagnostic accuracy and significantly simplifying clinical decision-making for physicians in selecting effective immunomodulatory therapy. This improves the course and outcome of purulent inflammatory diseases in children and restores anti-infective immunity.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


