Оптимизированная программа таргетной комбинированной интерфероно- и иммунотерапии в лечении атипичных хронических активных герпесвирусных ко-инфекций
- Аннотация
- Статья
- Ссылки
- English
В группу исследования были включены 73 пациента в возрасте 23–60 лет, страдающих АХА-ГВИ. На базе проведенного комплексного клинико-иммунологического исследования нами уточнены основные иммунопатогенетические особенности, на фоне которых возникло и прогрессирует заболевание. Разработана программа комбинированной интерфероно- и иммунотерапии. В дополнение к стандартной базисной терапии синтетическими противовирусными препаратами пациенты получали локальную и системную интерферонотерапию рекомбинантным ИФН-α2β в комплексе с антиоксидантами (гель для локальной и суппозитории для системной терапии ИФН) и иммуномодулирующую терапию синтетическим аналогом активного центра гормона тимопоэтина аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин (гексапептид, Имунофан, Россия), действие которой было направлено на нормализацию регуляторного дисбаланса в иммунной системе. Позитивная клиническая и лабораторная эффективность разработанной нами программы комбинированной интерфероно- и иммунотерапии была подтверждена.
В группу исследования были включены 73 пациента в возрасте 23–60 лет, страдающих АХА-ГВИ. На базе проведенного комплексного клинико-иммунологического исследования нами уточнены основные иммунопатогенетические особенности, на фоне которых возникло и прогрессирует заболевание. Разработана программа комбинированной интерфероно- и иммунотерапии. В дополнение к стандартной базисной терапии синтетическими противовирусными препаратами пациенты получали локальную и системную интерферонотерапию рекомбинантным ИФН-α2β в комплексе с антиоксидантами (гель для локальной и суппозитории для системной терапии ИФН) и иммуномодулирующую терапию синтетическим аналогом активного центра гормона тимопоэтина аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин (гексапептид, Имунофан, Россия), действие которой было направлено на нормализацию регуляторного дисбаланса в иммунной системе. Позитивная клиническая и лабораторная эффективность разработанной нами программы комбинированной интерфероно- и иммунотерапии была подтверждена.

В настоящее время инфекции, вызываемые персистирующими вирусами, в частности вирусами, относящимися семейству герпесвирусов, представляют одну из наиболее сложных и актуальных проблем современной медицины, что связано с их широким распространением, атипичным течением и особенностями иммунопатогенеза [1, 2]. Большинство современных подходов к лечению герпесвирусных инфекций основаны на локальном и системном применении синтетических противовирусных препаратов. Однако для пациентов с упорно рецидивирующими или атипичными хроническими активными герпесвирусными ко-инфекциями (АХА-ГВИ) лечение синтетическими противовирусными препаратами, даже с использованием пролонгированных схем с включением индукторов интерферонов (ИФН), не дает длительного, стойкого клинического эффекта, поскольку после завершения курса терапии или даже на фоне проводимой противовирусной терапии отмечается тенденция к рецидивированию или выход пациентов в неполную клиническую ремиссию [3–5]. Кроме того, персистирующее течение этих инфекций приводит к развитию аутоиммунной патологии, индукции лимфопролиферативных заболеваний, ведущих к значительному снижению качества жизни пациентов, а зачастую и к инвалидизации [6].
В настоящее время частое, упорное рецидивирование герпесвирусных инфекций рассматривается как признак иммунокомпрометированности, которая может являться следствием первичных или вторичных дефектов в работе иммунной системы, то есть иммунодефицицитов [7, 8]. Различными авторами описаны нарушения функционирования иммунной системы, дисбаланс цитокиновой сети, системы интерферонов, однако имеющиеся данные весьма противоречивы и разрозненны [9–12]. Кроме того, на сегодняшний день отсутствуют эффективные алгоритмы диагностики АХА-ГВИ, что значительно затрудняет своевременную постановку диагноза и назначение адекватной терапии, что в целом обусловливает интерес к проведению соответствующих исследований. Существующие современные подходы к терапии основаны на этио- и патогенетических принципах, что не учитывает необходимость коррекции выявленных нарушений функционирования системы противовирусной защиты организма [1, 13–17]. Однако только восстановление (реабилитация) адекватной работы системы противовирусной защиты организма и системы интерферона препятствует рецидивированию и способствует выходу пациентов в длительную клиническую ремиссию. В связи с этим является актуальным для достижения клинического эффекта разработка иммунопатогенетически обоснованной программы, включающей в себя дифференцированную локальную и системную иммунотерапию, которая позволит улучшить эффективность комплексной реабилитации иммунокомпрометированных пациентов с АХА-ГВИ.
Цель исследования – создание программы дифференцированной интерфероно- и иммунотерапии АХА-ГВИ, разработанной с учетом особенностей выявленных нарушений механизмов иммунной противовирусной защиты.
Материал и методы
Под нашим наблюдением находились 73 пациента обоего пола в возрасте от 23 до 60 лет, страдающих хроническими моно- и микст-герпесвирусными ко-инфекциями (группа исследования). Группу сравнения составляли 30 условно-здоровых лиц, сопоставимых по полу и возрасту с пациентами группы исследования. Исследование было проведено на базе КДЦ «МЕДСИ на Белорусской» и одобрено комиссией по вопросам этики, у всех пациентов получено информированное согласие на участие в исследовании согласно Хельсинкской декларации Всемирной медицинской ассоциации (WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects, 2013) и на обработку персональных данных.
В комплексе исследований помимо традиционных методов (сбор анамнеза, методы физикального обследования, общий анализ крови и пр.) для детекции герпесвирусных инфекций использовали методы серодиагностики (определение в сыворотке крови титров антител классов IgM VCA EBV, IgG VCA EBV, IgM CMV, IgG CMV, IgM HSV1/2, IgG HSV1/2) и метод полимеразной цепной реакции в реальном времени для обнаружения генома герпесвирусов в различных биоматериалах (кровь, слюна, моча, соскоб с миндалин и задней стенки глотки), что имеет принципиальное значение для оценки степени выраженности вирусной нагрузки и позволяет оценить ее динамику на фоне проводимой терапии.
Для оценки функционирования основных механизмов противовирусного иммунитета (определение CD3+, CD3+CD4+, CD3+CD8+ T-лимфоцитов, естественных киллерных клеток (ЕКК) CD3-CD16+CD56+, количества нейтрофилов) и системы интерферонов использовали методы проточной цитофлуориметрии и метод ИФА (ELISA). Для статистической обработки полученных данных использованы компьютерные программы Microsoft Excel. Результаты представляли в виде медианы и верхнего и нижнего квартилей (Me (Q1; Q3)), применяли критерии Манна – Уитни и Вилкоксона. Достоверность различия определяли при p < 0,05.
Результаты и обсуждение
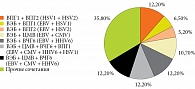
Анализ распределения частоты встречаемости моно- и микст-герпесвирусных инфекций в исследуемой когорте пациентов показал, что моно-герпесвирусные инфекции (моно-ГВИ) детектируются у 32,8% пациентов, а микст-герпесвирусные инфекции (микст-ГВИ) были выявлены у 68,2% от общего числа пациентов. Интересным представляется тот факт, что среди всех моно-герпесвирусных инфекций моно-ВЭБ-инфекцией страдали 55,5% пациентов. В то же время доминирование вируса Эпштейна – Барр (ВЭБ) было также отмечено и у пациентов с микст-ГВИ (48,1%).
В структуре микст-ГВИ лидируют сочетания: вирус простого герпеса первого типа (ВПГ1) + ВПГ второго типа (ВПГ2); ВЭБ + вирус герпеса человека шестого типа (ВЧГ6), ВЭБ + цитомегаловирус (ЦМВ) + ВЧГ6, а также ВЭБ + ЦМВ + ВЧГ6 + ВПГ1 – по 12,2%. Распределение микст-инфекций по встречаемости сочетаний было следующим: ВЭБ + ЦМВ (10,7%); ВЭБ + ЦМВ + ВПГ1 (6,8%); ВЭБ + ЦМВ + ВПГ2 (5,2%) (рис. 1).
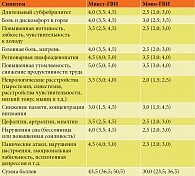
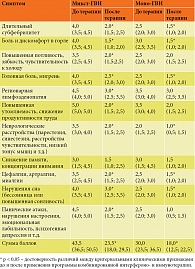
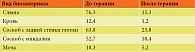
У всех пациентов группы исследования имели место клинические симптомы, характерные для АХА-ГВИ. Все эти симптомы были оценены по разработанной нами пятибалльной шкале, где наличие или отсутствие симптомов в зависимости от тяжести их проявления оценивалось в баллах от 0 до 5 (0 баллов – отсутствие симптомов; 1 балл – минимальные симптомы; 2 балла – средняя выраженность симптомов; 3 балла – тяжелая степень; 4 балла – очень тяжелая степень; 5 баллов – крайне тяжелая степень) (табл. 1) Выраженность симптомов по этой шкале при микст-ГВИ составляла 43,5 (36,5; 50,5) балла, а при моно-ГВИ – 30,0 (23,5; 36,5) балла.
Таким образом, наиболее выраженные клинические симптомы наблюдались у пациентов, страдающих микст-ГВИ. Наиболее значимыми и патогномоничными среди них являются длительное ощущение выраженной слабости, хронической усталости (синдром хронической усталости – СХУ), потливость, непостоянные боли в горле, мигрирующие боли и дискомфорт в мышцах и суставах (фибромиалгии), цефалгии, длительный субфебрилитет, регионарная лимфоаденопатия, нарушение структуры сна и процесса засыпания, снижение памяти, внимания, интеллекта, реже – психогенная депрессия. Кроме того, у всех пациентов отмечались возвратные респираторные инфекции в виде повторных эпизодов ОРВИ, частые обострения хронических бактериальных и грибковых ко-инфекций различной локализации (гаймориты, отиты, синуситы, фарингиты, циститы, уретриты, вульвовагиниты и пр.).
В ходе проведенного исследования нами были выявлены нарушения в системе функционирования противовирусного звена иммунной защиты организма, которые включали:
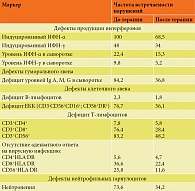
- нарушения естественных киллерных клеток (CD16+CD56+; CD16+CD56-), дефицит их количества и/или функции (цитотоксичности) – 76,7% случаев;
- снижение уровня антител класса IgG – 84,2%;
- нарушения нейтрофильных гранулоцитов (нейтропения) – 73,6%;
- нарушения Т-лимфоцитов – дефицит CD3+CD8+ – 76,4%;
- дефекты активации CD3+CD8+: дефицит или неадекватный ответ на вирусную инфекцию CD3+CD8+CD25+ у 36,6% пациентов и/или CD3+CD8+HLA-DR+ у 25,8%;
- дефекты в системе интерферонов, проявляющиеся нарушением спонтанной и индуцированной продукции ИФН-α в 100% случаев и ИФН-γ в 48% (табл. 2).
С учетом выявленных клинических особенностей пациентов группы исследования, наличия АХА-ГВИ с преобладанием ВЭБ, а также характера и степени выраженности выявленных нарушений в иммунной системе и в системе интерферонов нами была разработана программа комплексной иммунотерапии, включающая пролонгированную таргетную интерфероно- и иммуномодулирующую терапию.
Программа терапии:
- системная интерферонотерапия: использование рекомбинантного ИФН-α2b в сочетании с антиоксидантами – Виферон в суппозиториях с градиентно снижающимися дозами по схеме: 3 млн МЕ в день в течение 21 дня, далее 2 млн МЕ в день – 21 день, далее 1 млн МЕ – 21 день, далее 1 млн МЕ три раза в неделю в течение двух недель, далее 1 млн МЕ дважды в неделю в течение двух недель;
- локальная интерферонотерапия с использованием геля Виферон, который применяли в виде аппликаций на слизистую оболочку носовых ходов, заднюю стенку глотки и дужки миндалин с частотой до трех – пяти раз в день ежедневно на протяжении всего срока системной интерферонотерапии;
- иммуномодулирующая терапия с применением 0,005% раствора Имунофана – синтетического аналога активного центра гормона тимопоэтина аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин (гексапептид, Имунофан, Россия), таргетное действие которого направлено на коррекцию CD3+CD8+-лимфоцитов, – 10-дневные курсы один раз в месяц в течение трех месяцев;
- для коррекции ЕКК и подавления репликации герпесвирусов использовали инозин пранобекс (Изопринозин) из расчета 50 мг/кг массы тела в сутки – 10-дневные курсы один раз в месяц в чередовании с Имунофаном. Между каждым курсом Имунофана и Изопринозина был перерыв в течение пяти дней;
- противовирусная терапия герпесвирусных инфекций и в частности ВЭБ включала применение фамцикловира (Фамвир) 1500 мг в день в течение 10 дней один раз в месяц с перерывом в 20 дней.
После завершения программы комплексной иммунотерапии нами была оценена клиническая эффективность проводимой терапии с использованием пятибалльной шкалы в соответствии с разработанными ранее критериальными клиническими признаками (табл. 3).
Установлено, что выраженность клинических проявлений по пятибалльной шкале достоверно уменьшилась после проведения комбинированной интерфероно- и иммунотерапии с 43,5 (36,5; 50,5) до 23,5 (18,0; 29,5) балла при микст-ГВИ и с 30,0 (23,5; 36,5) до 18,0 (12,5; 22,5) балла при моно-ГВИ (р < 0,05).
После проведения комплексной интерфероно-, иммуномодулирующей и противовирусной терапии был осуществлен контроль особенностей функционирования и состояния иммунной системы. Анализ полученных данных выявил выраженные позитивные изменения, касающиеся основных параметров, оценивающих эффективность противовирусной иммунной защиты организма и системы интерферона. Так, после проведенной терапии значительно снизилась частота встречаемости дефектов нейтрофильных гранулоцитов – с 73,6 до 34,2%; дефицита ЕКК – с 76,7 до 36,1%; дефицита субпопуляций CD3+CD8+ – с 76,4 до 28,4%; а CD3+CD56+ – с 83,2 до 48,2%. Имеющаяся до лечения неадекватность иммунного ответа на наличие вирусной инфекции регрессировала с 25,8 до 11,6% (табл. 3).
Оценка показателей системы интерферонов выявила снижение частоты встречаемости нарушений как спонтанной, так и индуцированной продукции интерферонов обоих типов (рис. 2).
Был детектирован регресс нарушений продукции уровней ИФН-α и ИФН-γ в сыворотке на 7,1 и 4,6% соответственно, в то время как регресс нарушений индуцированной продукции ИФН-α и ИФН-γ наблюдался в 31,5 и 14,0% случаев соответственно.
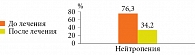
Оценка динамики состояния нейтрофильных гранулоцитов после проведенной комплексной иммунотропной и противовирусной терапии показала уменьшение случаев нейтропении с 73,6 до 34,2% (рис. 3).
Наряду с описанными позитивными изменениями со стороны иммунной системы, системы ИФН и значительной позитивной клинической динамикой произошло снижение вирусной нагрузки, что свидетельствует о прекращении репликативной активности герпесвирусов (табл. 4).
Таким образом, у пациентов, страдающих АХА-ГВИ, выявлены моно- и микст-герпесвирусные ко-инфекции с доминированием ВЭБ. Установлены особенности клинических проявлений АХА-ГВИ, которые выражались в развитии синдрома хронической усталости, мигрирующих болях и дискомфорте в мышцах и суставах (фибромиалгии), цефалгии, длительном субфебрилитете, регионарной лимфоаденопатии, боли в горле, нарушении структуры сна и процесса засыпания, снижении памяти, внимания, интеллекта, реже – психогенной депрессии.
Выявлены преобладающие комбинированные нарушения функционирования иммунной системы.
У 100% пациентов выявлен дефицит индуцированной продукции ИФН-α, в меньшей степени выражен дефицит индуцированной продукции ИФН-γ – в 48%. Выявлены нарушения естественных киллерных клеток (CD16+CD56+; CD16+CD56-), дефицит их количества и/или функции (цитотоксичности) в 76,7% случаев; нарушения нейтрофильных гранулоцитов (нейтропения) – в 73,6% случаев; нарушения Т-лимфоцитов – дефицит CD3+CD8+ – у 76,4% пациентов; дефекты активации CD3+CD8+: дефицит или неадекватный ответ на вирусную инфекцию CD3+CD8+CD25+ – у 36,6% и/или CD3+CD8+HLA-DR+ – у 25,8% пациентов.
Созданная на базе полученных клинических и иммунологических данных программа комплексной таргетной противовирусной, интерфероно- и иммунотерапии включала серию мероприятий: 1) с целью коррекции интерферонового статуса – пролонгированную локальную (гель) и системную (суппозитории) терапию рекомбинантным ИФН-α2b в комплексе с антиоксидантами; 2) иммунотерапию аргинил-альфа-аспартил-лизил-валил-тирозил-аргинином (гексапептид, Имунофан, Россия), таргетное действие которого направлено на коррекцию CD3+CD8+-лимфоцитов, и инозином пранобексом (Изопринозин) для коррекции ЕКК и подавления репликации герпесвирусов; 3) противогерпетическую противовирусную терапию с использованием синтетического противовирусного препарата фамцикловир (Фамвир), что привело к значительному регрессу клинических симптомов на фоне восстановления системы ИФН и иммунной системы (регресс нарушений индуцированной продукции ИФН-α и ИФН-γ наблюдался в 31,5 и 14,0% случаев соответственно; уменьшение случаев нейтропении с 73,6 до 34,2%; снижение частоты встречаемости дефектов нейтрофильных гранулоцитов с 73,6 до 34,2%; снижение дефицита ЕКК с 76,7 до 36,1%; дефицита субпопуляций CD3+CD8+ с 76,4 до 28,4%; а CD3+CD56+ – с 83,2 до 48,2%). Имеющаяся до лечения неадекватность иммунного ответа на наличие вирусной инфекции регрессировала с 25,8 до 11,6%.
Ликвидация репликативной активности герпесвирусов на фоне восстановления иммунной системы и системы ИФН привела к позитивной клинической динамике: регрессу СХУ и выраженных когнитивных расстройств, фибромиалгий, артралгий и иных симптомов.
Таким образом, показана выраженная клинико-иммунологическая эффективность разработанной комплексной программы таргетной иммуномодулирующей терапии.
Выводы
У пациентов, страдающих АХА-ГИ, наблюдаются клинические проявления периферических нейро- и сенсопатий, миалгии и артралгии (по типу фибромиалгий), выраженные и прогрессирующие когнитивные и мнестические расстройства, что косвенным образом свидетельствует о развитии нейроиммуновоспаления с локализацией процесса как в периферических, так и центральных отделах нервной системы.
На фоне проведения дифференцированной таргетной интерфероно- и иммунотерапии в группе пациентов, страдающих АХА-ГВИ, в 100% случаев были получены позитивные клинические эффекты: достигнуты полная регрессия СХУ, восстановление работоспособности, нормализовалась формула сна, регрессировали боли в горле, восстановились память, процессы запоминания, значительно улучшились настроение и качество жизни пациентов.
Результатом проведенной дифференцированной таргетной интерфероно- и иммунотерапии, базирующейся на выявленных особенностях иммунопатогенеза АХА-ГВИ, явилось восстановление нормального функционирования нарушенных до лечения основных механизмов иммунной противовирусной защиты и системы интерферонов.
Использование разработанных нами дифференцированных программ интерфероно- и иммунотерапии позволило восстановить контроль иммунной системы над герпесвирусными инфекциями, достичь прекращения репликативной активности герпесвирусов, результатом чего явились регресс клинических проявлений болезни, улучшение качества жизни пациентов и значительное снижение степени риска развития возможных аутоиммунных и онкологических заболеваний.
E.O. Khalturina, PhD, I.V. Nesterova, PhD, Prof., T.P. Markova, PhD, Prof.
I.M. Sechenov First Moscow State Medical University
People’s Friendship University of Russia, Moscow
The MEDSI Academy, Department of Clinical Immunology and Allergology. Clinical and diagnostic center MEDSI on Belorusskaya, Moscow
Academy of Postgraduate Education, Moscow
Contact person: Evgenia O. Khalturina, jane_k@inbox.ru
The problem of effective therapy of chronic atypical active herpes-viral co-infections (ACHA-HVI) is extremely urgent at present due to their high prevalence and the lack of effective integrated therapy regimens that take into account immunopathogenetic features, which are based on disruptions in the functioning of the body's antiviral immune defense system and interferon system. In this regard, the aim of our study was to create a program of differentiated interferono- and immunotherapy of ACHA-HVI, developed taking into account the peculiarities of detected disorders of the mechanisms of immune antiviral defense.
The study group included 73 patients aged 23–60 years suffering from ACHA-HVI. On the basis of a comprehensive clinical-immunological study, we refined the main immunopathogenetic features, against the background of which the disease arose and progresses. A program of combined interferon and immunotherapy has been developed. In addition to standard base therapy with synthetic antiviral drugs, patients received local and systemic interferon therapy with recombinant IFNα2β in combination with antioxidants (gel for local and suppository for systemic IFN therapy) and immunomodulatory therapy with a synthetic analog of the active center of the hormone timopoietin arginyl-alpha-aspartyl-lysyl-valyl-tyrosyl-arginine (hexapeptide, Imunofan, Russia). The positive clinical and laboratory efficacy of our combined interferon and immunotherapy program has been confirmed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.