Авандамет – новые перспективы раннего использования фиксированной комбинации в лечении больных с СД типа 2
- Аннотация
- Статья
- Ссылки
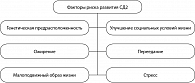

В основе стремительного роста заболеваемости сахарным диабетом лежит улучшение качества жизни. Для большинства стран, особенно развивающихся, это является результатом быстрых культурных и социальных изменений, старения населения, снижения физической активности, урбанизации, увеличения количества рафинированных продуктов, продуктов, обедненных клетчаткой.
В России число зарегистрированных больных сахарным диабетом составляет чуть более двух миллионов человек. По экспертным оценкам их истинное количество оценивается на уровне восьми миллионов, т.е. большая часть больных СД2 остаются не выявленными.
Таким образом, совершенствование методов лечения и профилактики диабета гарантирует многим миллионам пациентов с СД2 достойное качество жизни, снижение риска инвалидизации и уменьшение смертности от причин, связанных с СД.
Сахарный диабет типа 2 – заболевание, обусловленное инсулинорезистентностью (ИР) и относительным дефицитом инсулина. Сохранение функции β-клеток частично или полностью у большинства больных не вызывает необходимости инсулинотерапии. Проявления СД2 нарастают достаточно медленно; осложнения развиваются позже и среди них, в отличие от СД1, преобладают макрососудистые.
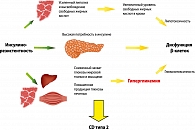
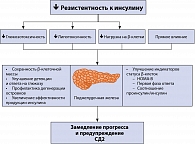
Инсулинорезистентность обусловлена генетическими факторами и другими факторами риска, среди которых пол, возраст, этническая принадлежность и образ жизни. В условиях инсулинорезистентности для поддержания нормального уровня глюкозы в крови необходима усиленная секреция инсулина. Снижение секреторной активности β-клеток до уровня недостаточного для преодоления инсулинорезистентности приводит к дефициту инсулина и нарушениям обмена глюкозы. Они манифестируют как нарушение толерантности к глюкозе, а впоследствии в присутствии факторов риска эволюционируют в СД2 (рисунок 1). Компенсаторная гиперинсулинемия приводит к развитию артериальной гипертензии, повышению уровня триглицеридов, снижению уровня липопротеидов высокой плотности (ЛПВП) и ускорению процессов атерогенеза.
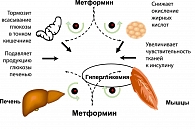
ИР клеток печени за счет усиления глюконеогенеза приводит к повышению продукции глюкозы. В результате повышается уровень глюкозы в крови натощак. Из-за ИР скелетных мышц повышается уровень глюкозы в крови после приема пищи, поскольку именно утилизация глюкозы в мышцах является главным механизмом удаления глюкозы из крови. ИР жировой ткани проявляется в резистентности к антилиполитическому действию инсулина, приводящей к накоплению свободных жирных кислот (СЖК) и глицерина. СЖК поступают в печень, где становятся основным источником формирования атерогенных липопротеинов очень низкой плотности (рисунок 2).
Ранние стадии СД2 характеризуются повышенной секрецией инсулина, постепенно β-клетки истощаются, происходит усиление нарушений углеводного обмена. В результате глюкозотоксического действия на β-клетки нарушается синтез и секреция инсулина (увеличивается отношение проинсулин/инсулин). Попутно происходит выпадение ранней фазы стимулированной секреции, и нарушается импульсная секреция инсулина.
Гетерогенность заболевания, обусловленная наличием инсулинорезистентности и нарушением секреции инсулина β-клетками островков поджелудочной железы, обусловливает многообразие подходов к терапии СД2. Целью лечения СД типа 2 является достижение и обеспечение стабильного метаболического контроля – от момента установления диагноза и в продолжение всей жизни пациента, позволяющее задержать или отсрочить время появления поздних осложнений СД.
Основными принципами лечения больных СД 2 являются:
- индивидуальный подход к лечению с учетом особенностей течения и тяжести заболевания, образа жизни и характера питания больного;
- поддержание нормального уровня глюкозы и липидов в крови;
- диетотерапия и дозированные физические нагрузки, позволяющие поддерживать нормальный вес;
- применение пероральных сахароснижающих препаратов (ПСП) и/или инсулина в случаях, когда не удается устранить гипергликемию и нормализовать вес с помощью диеты и физических нагрузок;
- обучение больных СД2 и повышение их комплаентности к проводимой терапии;
- профилактика и раннее начало лечения осложнений сахарного диабета.
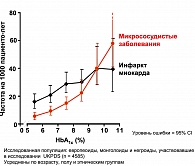
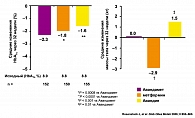
Одним из наиболее значимых массовых исследований сахарного диабета за последнее время явилось Британское проспективное исследование по контролю сахарного диабета и развитию осложнений (UKPDS). На протяжении 20 лет в 23 клинических центрах Великобритании было обследовано 5102 пациента. Больные СД были разделены на группы, получавшие с момента выявления диабета разное лечение: диетотерапия в виде монотерапии, ПСП в различных комбинациях, инсулинотерапия в виде монотерапии и в комбинации с ПСП. Результаты исследования убедительно доказали возможность снижения частоты осложнений СД при адекватном контроле гликемии на фоне подобранной терапии. Длительное наблюдение продемонстрировало, что снижение уровня HbA1с на 1% снижает частоту осложнений в целом на 21%, микрососудистых осложнений – на 25%, инфаркта миокарда – на 16%, ОНМК на 44%, общую смертность от причин, связанных с СД, – на 25% (рисунок 3).
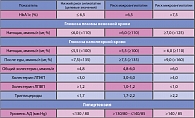
Многочисленные исследования выявили прямую зависимость между степенью компенсации углеводного обмена, сроками возникновения и темпами прогрессирования микро- и макроваскулярных осложнений СД2. Завершение исследования UKPDS позволило обосновать ужесточение критериев компенсации СД (таблица 1).
Лечение СД2 сопряжено с большими трудностями, поскольку обычно назначается не с момента нарушения углеводного обмена, а лишь при появлении клинических признаков диабета, свидетельствующих о присутствии необратимых изменений в тканях и органах.
Помимо того на пути эффективного управления уровнем гликемии стоят объективные и субъективные факторы, которые можно разделить на несколько групп.
1. Консервативность терапии:
- неэффективность диеты и физических упражнений;
- снижение эффективности из-за медленного ступенчатого подхода к терапии;
- несовершенство системы ведения пациентов с СД2.
2. Пониженная эффективность получаемого лечения:
- недостаточное обучение пациентов;
- низкая приверженность пациента лечению.
3. Ятрогенные факторы:
- недостаточное знание патофизиологии диабета;
- некорректное назначение лекарственных препаратов.
Алгоритм действий, названный «Десять шагов в достижении целей контроля гликемии у пациентов с СД2», предложенный Del Prato S. et al. в 2005 г. предлагает:
- нацелить пациента на хороший контроль гликемии, а именно уровень HbA1c <6,5%, или уровень глюкозы плазмы натощак <110 мг/дл (6,0 ммоль/л), если измерение HbA1c невозможно;
- мониторировать уровень HbA1c каждые 3 месяца в дополнение к регулярному самоконтролю уровня глюкозы;
- применять агрессивный и одинаково интенсивный подход к терапии гипергликемии, дислипидемии и гипертензии для достижения лучшей компенсации пациентов;
- направлять всех вновь выявленных пациентов в специализированное диабетологическое учреждение (если возможно);
- лечить причины возникновения сахарного диабета типа 2, включая лечение инсулинорезистентности;
- интенсивно лечить пациента с целью достижения целевого значения HbA1c <6,5% в течение 6 месяцев от постановки диагноза;
- спустя 3 месяца, если пациент не достигает целевого значения HbA1c <6,5%, перевести его на комбинированную терапию;
- немедленно назначить комбинированную терапию или инсулин всем пациентам с уровнем HbA1c ³9% в момент постановки диагноза;
- использовать комбинации пероральных сахароснижающих препаратов с комплементарным механизмом действия;
- внедрять мульти- и интердисциплинарный командный подход к управлению диабетом, поощрять образование и самоконтроль пациентов, делить с пациентом ответственность в достижении целей терапии диабета.
Принципы, заложенные в данном алгоритме действий позволяют достичь максимально адекватной комплексной терапии и достижения компенсации заболевания у больных СД2 и во многом легли в основу совместного консенсуса EASD и ADA (2006 год). По этому консенсусу метформин назначается сразу после установления диагноза СД типа 2, а чуть ранее, в 2005 году, IDF также рекомендовала метформин в качестве препарата первого выбора у данной группы больных. Таким образом, коррекция инсулинорезистентности является главной и первостепенной составляющей лечения сахарного диабета типа 2.
И, как указано выше, использовать в том числе комбинации пероральных сахароснижающих препаратов с комплементарным механизмом действия.
Бигуаниды, обладающие выраженным сахароснижающим действием, применяются в терапии СД2 с 1957 г. и представлены на сегодняшнем рынке метформином Его значимость в терапии диабета была оценена за длительное время благодаря интенсивным экспериментальным и клиническим фармакологическим исследованиям, показавшим роль метформина в нормализации гликемии и инсулиновой резистентности при СД2 (N.Wiernsperger,1999). Метформин не подвергается никакой биотрансформации и не инактивируется в печеночной ткани, не связывается с белками плазмы и полностью экскретируется с мочой в неизмененном виде при нормальной функции почек, не аккумулируется и быстро выводится из организма при приеме его 1-2 раза в день. Биодоступность метформина при приеме per os составляет 50-60%. Метформин не изменяет секрецию инсулина и не оказывает сахароснижающего эффекта при его отсутствии. В присутствии инсулина он увеличивает периферическую утилизацию глюкозы, уменьшает глюконеогенез, замедляет всасывание глюкозы в кишечнике, а также снижает повышенное содержание инсулина в сыворотке крови у больных, страдающих ожирением и СД2. Влияние бигуанидов на углеводный и жировой обмен у больных СД2 не сопровождается стимуляцией секреции инсулина. Метформин снижает уровень липидов, циркулирующих в плазме крови (холестерина, триглицеридов, холестерина липопротеидов низкой плотности липопротеидов очень низкой плотности (ЛПНП и ЛПОНП), а также повышает уровень холестерина ЛПВП), препятствует отложению жира в печени, способствуя при этом накоплению гликогена и препятствуя его распаду и поступлению в кровь.
При терапии метформином наблюдается умеренное снижение массы тела за счет легкого анорексигенного эффекта.
Терапия метформином сопровождается снижением гликемии в среднем на 2,5 ммоль/л; уменьшением уровня HbA1c в крови на ≈1,5%. Метформин хорошо переносится больными и обладает высокой безопасностью.
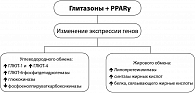
Последние 10 лет ознаменовались внедрением в практику диабетологов глитазонов или тиазолидиндионов, основной терапевтический эффект которых связан с повышением чувствительности периферических тканей к инсулину и увеличением поглощения глюкозы периферическими тканями. Тиазолидиндионы (сенситайзеры или глитазоны) являются агонистами PPARγ, снижающими ИР, что сопровождается снижением уровня глюкозы, липидов и инсулина в сыворотке крови у больных СД2.
Эффект глитазонов проявляется улучшением действия инсулина на мышцы скелета, жировую ткань и в печени. Глитазоны обладают умеренным антигипертензивным действием, изменяют профиль липидов в сыворотке крови, повышая уровень холестерина липопротеидов высокой плотности (ЛПВП), снижая концентрацию липопротеидов очень низкой плотности (ЛПОНП) и увеличивая содержание более крупных частиц липопротеидов низкой плотности (ЛПНП), обладающих менее выраженным атерогенным эффектом, снижая уровень триглицеридов и улучшая гемореологические показатели, что сопровождается снижением факторов риска развития сосудистых осложнений диабета. Являясь центральным регулятором адипогенеза, PPARγ обеспечивает дифференцировку преадипоцитов в адипоциты.
К препаратам этой группы относится Авандия (росиглитазон). Тиазолидиндионы взаимодействуют также с субстратами инсулинового рецептора и способствуют тем самым экспрессии генов, кодирующих белки, являющиеся мишенью для действия инсулина, в частности, транспортеров глюкозы. Росиглитазон участвует в регуляции эндокринной функции жировой ткани, изменяя секрецию соответствующих гормонов жировой ткани (ФНО–a, ингибитор 1 типа активатора плазминогена, адипонектин, лептин и др.), влияя на факторы развития сосудистых осложнений диабета.
Имеются данные о том, что росиглитазон осуществлет свое влияние и через другие механизмы, не связанные со стимуляцией PPARγ, под влиянием тиазолидиндионов происходит сдвиг утилизации энергии в митохондриях от аэробного к анаэробному пути, проявляющийся стимуляцией высвобождения лактата и угнетением образования СО2.
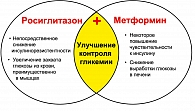
Тиазолидиндионы и бигуаниды обладают комплементарным влиянием на углеводный и липидный обмены, при различии молекулярных механизмов их действия. Известно, что влияние метформина в реализации улучшения чувствительности к инсулину в большей степени реализуется на уровне печени, в то время как росиглитазона на уровне периферических инсулинзависимых тканей. Так, K.A. Virtanen et al. при изучении влияния росиглитазона (4 мг 2 раза в сутки) и метформина (1 г 2 раза в сутки) у больных СД2 выявили, что при монотерапии Авандией на 44% улучшалось поглощение глюкозы тканями организма при стимуляции инсулином. Вес больных, при этом не изменялся. При лечении метформином масса тела уменьшалась на 2 кг. На фоне приема терапии Авандией поглощение глюкозы в висцеральных жировых депо увеличивалось до 29%, под влиянием метформина – до 17%. Висцеральные депо жира уменьшались одинаково в обеих группах больных, однако под влиянием Авандии отмечалось увеличение поглощения глюкозы жировыми депо в бедренных областях. Одним из побочных влияний Авандии является увеличение массы тела пациентов за счет подкожного, а не висцерального депо жировой ткани, объем которого имеет влияние на степень выраженности ИР и риск развития сердечно-сосудистых осложнений.
Получено достаточное количество экспериментальных и клинических данных по идентификации механизмов, посредством которых глитазоны повышают чувствительность к инсулину. Однако некоторые вопросы остаются нерешенными, в частности – почему глитазоны, оказывая основное влияние на экспрессию рецепторов в жировой ткани, приводят к повышению чувствительности к инсулину и в других тканях? Действительно, содержание PPARγ в жировой ткани в 10-100 выше, чем в других тканях-мишенях для инсулина (мышцы и печень). Однако и в этих тканях под влиянием глитазонов четко отмечается увеличение экспрессии PPARγ. Поэтому под влиянием глитазонов и в других (нежировых) тканях организма значительно снижается резистентность к инсулину.
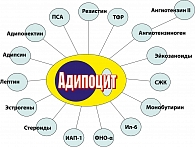
В жировой ткани синтезируются гормоны и биологически активные пептиды, такие как: лептин, пантофизин, резистин, ФНО-a и др., большинство из которых влияют на повышение степени выраженности инсулиновой резистентности (рисунок 7).
Важным положительным эффектом применения Авандии у больных СД2 является уменьшение отношения проинсулин/инсулин в сыворотке крови, что указывает на восстановление функциональной активности β-клеток островков Лангерганса.
К сожалению, еще в исследовании UKPDS была показана неизбежная потеря контроля гликемии при применении всех изученных подходов к лечению в качестве монотерапии и уже через 3 года от манифестации СД в комбинированной терапии нуждаются 50%, а через 9 лет – 75% больных. Комбинированной терапией называют одновременное использование ПСП разных групп в случае неэффективности использования терапии одним препаратом в максимальной дозе. Обычно это сочетание секретогенов и препаратов периферического действия. Единственным исключением из этого правила является сочетание тиазолидиндионов и метформина. Комбинированная терапия показана при СД как первичная терапия при поздней его диагностике, изначально агрессивном течении, а также при неэффективности монотерапии. Для улучшения качества жизни пациентов с СД типа 2 в клинической практике используют препараты с фиксированной комбинацией.
Фирмой ГлаксоСмитКляйн разработан комбинированный препарат – Авандамет. На рынке предполагается две формы препарата с различной фиксированной дозой росиглитазона и метформина (росиглитазон 2 мг и 500 мг метформина и росиглитазон 1 мг в комбинации с 500 мг метформина). Рекомендуемый режим приема – 1-2 таблетки 2 раза в сутки. Это дает возможность принимать минимальное число таблеток, воздействуя при этом потенциирующе на патогенетические звенья развития сахарного диабета. Препарат обладает более выраженным сахароснижающим действием по сравнению с действием каждого компонента в отдельности, при этом не происходит увеличения массы тела.
Авандамет показан пациентам с СД2, особенно тем из них, у которых назначение антидиабетических средств в максимальных терапевтических дозах в режиме монотерапии не позволяет достичь желаемого эффекта. Следует отметить, что применение комбинации препаратов класса бигуанидов и тиазолидиндионов признано рациональным и внесено в международные рекомендации и руководства по лечению СД2. Многие пациенты apriori нуждаются в терапии, включающей сразу несколько сахароснижающих средств для долговременного адекватного контроля гликемии. В частности, инициировать комбинированную терапию или инсулинотерапию рекомендовано всем пациентам с HbA1c³9% при постановке диагноза. Таким образом, при сахарном диабете 2 типа:
Авандамет используется в двухкомпонентной комбинированной терапии при неэффективности диеты или монотерапии тиазолидиндионом или метформином, или при предшествующей комбинированной терапии препаратами тиазолидиндиона и метформина;
Авандамет также назначается в составе трехкомпонентной комбинированной терапии с сульфонилмочевиной для достижения контроля гликемии.
Противопоказания:
- повышенная чувствительность к любому из компонентов препарата;
- сердечная недостаточность III и IV функционального класса по NYHA;
- острые или хронические заболевания, приводящие к гипоксии тканей (например, сердечная или дыхательная недостаточность, недавно перенесенный инфаркт миокарда, шок);
- печеночная недостаточность;
- алкоголизм, острая алкогольная интоксикация;
- диабетический кетоацидоз или диабетическая прекома;
- почечная недостаточность (при концентрации креатинина в сыворотке более 135 мкмоль/л у мужчин и более 110 мкмоль/л у женщин) и/или клиренс креатинина менее 70 мл/мин;
- острые состояния с риском развития почечной недостаточности (дегидратация, тяжелые инфекции, шок);
- внутрисосудистое введение йодосодержащих рентгеноконтрастных средств.
Благодаря своему составу Авандамет позволяет воздействовать на различные патогенетические звенья развития СД2: снижать инсулинорезистентность, интенсивность глюконеогенеза в печени и сохранять функциональную активность b-клеток.
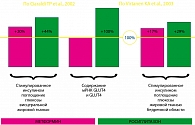
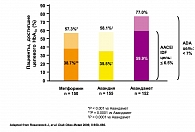
По результатам многоцентрового рандомизированного плацебо-контролируемого клинического исследования с участием 348 пациентов с сахарным диабетом II типа, у которых применение метформина в максимальной терапевтической дозе в режиме монотерапии оказалось недостаточно эффективным, назначение комбинации метформина с росиглитазоном в двух дозах 4 и 8 мг позволяло обеспечить более надежный контроль гликемии. В общем, целевого уровня контроля гликемии удалось достичь у 28,1% пациентов при применении комбинации росиглитазона и метформина, в то время как при использовании монотерапии метформином – только у 8%. Из побочных эффектов только появление отечного синдрома было отмечено у части пациентов при включении в комплексную терапию росиглитазона. Таким образом, комбинированная терапия росиглитазоном и метформином позволяет более эффективно контролировать уровень глюкозы крови, повышать чувствительность тканей к инсулину и улучшать функцию b-клеток поджелудочной железы. Особенно высокой эффективность применения такой комбинации оказалась у пациентов с ожирением. При этом риск развития гипогликемии весьма низок, а частота других побочных реакций сопоставима с таковой при использовании других схем лечения. Кроме того, раннее начало комбинированной терапии Авандаметом – еще до повышения дозы одного из его компонентов до максимальной – позволяет улучшить профиль безопасности этого препарата, снизив риск развития побочных эффектов каждого из них.
Стоит отметить и еще одно важнейшее преимущество применения препарата Авандамет – высокую приверженность пациентов к соблюдению назначенного режима лечения: ведь включение в состав одного препарата сразу двух антидиабетических средств обеспечивает удобство его приема для пациентов, которым необходимо такое лечение. Только 30% пациентов твердо придерживается терапии одним лекарственным средством и менее 13% – большим количеством препаратов и в больших дозах – раздельной комбинацией (исследование DARTS). Назначение комбинации росиглитазона и метформина с фиксированной дозой каждого компонента по сравнению с их одновременным назначением в качестве отдельных препаратов, безусловно, принесет не только удобство для пациентов с сахарным диабетом 2 типа, но и повысит эффективность лечения.
Таким образом, сегодня и отечественные врачи могут назначать пациентам Авандамет – современный комбинированный антидиабетический препарат, позволяющий получить лучшие результаты лечения, обеспечивающий возможность более надежно контролировать уровень глюкозы в крови, а значит, и влиять на само течение заболевания.
Данная статья опубликована при финансовой поддержке компании «ГлаксоСмитКляйн». Мнение автора может не совпадать с позицией компании.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


