количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Беременность у пациенток с хронической болезнью почек
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и гинекология" № 3 (35)
- Аннотация
- Статья
- Ссылки
- English
В статье охарактеризовано соотношение понятий «хроническая болезнь почек» и «хроническая почечная недостаточность». Приведены данные по распространенности хронической болезни почек среди женщин репродуктивного возраста. Описаны частота и характер акушерских и перинатальных осложнений и исходов беременности в этой группе женщин. Рассматриваются особенности прегравидарной подготовки, ведения беременности, тактики родоразрешения и наблюдения в послеродовом периоде пациенток с хронической болезнью почек.

Таблица 1. Классификация хронической болезни почек в зависимости от уровня клубочковой фильтрации
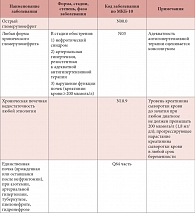
Таблица 2. Медицинские показания для искусственного прерывания беременности (болезни мочеполовой системы)
Введение
До недавнего времени заболевания почек традиционно считались редкими, но в настоящее время их социальная значимость и существенная распространенность не вызывают сомнений. Хронической болезнью почек (ХБП) страдают 10–11% населения во всем мире. При этом распространенность стойкого снижения почечной функции (скорость клубочковой фильтрации (СКФ) в диапазоне 15–59 мл/мин/1,73 м²) составляет в общей популяции не менее 3,8%. Всемирная организация здравоохранения признала ХБП пятой «болезнью-убийцей» (первые четыре – рак, сердечно-сосудистые заболевания, болезни легких и сахарный диабет) [1, 2].
Нередко заболевания почек длительно не имеют яркой клинической симптоматики, иногда даже не сопровождаются существенными изменениями в общем анализе мочи, а трактовка изменений биохимического состава крови вызывает затруднения у практических врачей. Это приводит к несвоевременной диагностике ХБП, позднему началу лечения, высокой частоте развития хронической почечной недостаточности (ХПН).
Большинство больных узнают о своем заболевании слишком поздно, когда медикаментозное лечение уже не способно улучшить состояние пациента и требуется применение методов заместительной почечной терапии – гемодиализа или перитонеального диализа с последующей возможной трансплантацией почки. Интересно, что основными причинами развития терминальной хронической почечной недостаточности в развитых странах являются не «чисто нефрологические» болезни (хронический гломерулонефрит, хронический пиелонефрит, амилоидоз почек, поликистозная болезнь), а весьма распространенные «популяционные» заболевания – сахарный диабет, эссенциальная артериальная гипертензия, ожирение и гиперурикемия [3, 4].
ХПН – клинико-лабораторный симптомокомплекс, обусловленный постепенной гибелью нефронов в исходе любого прогрессирующего заболевания почек и характеризующийся невозможностью почек поддерживать нормальный состав внутренней среды организма. К сожалению, несмотря на проведение комплексной нефропротективной терапии, ХПН необратима и рано или поздно вступает в терминальную стадию [5]. В этой связи на сегодняшнем этапе развития медицины возможно только замедлить прогрессирование ХПН и в лучшем случае длительно стабилизировать почечную функцию на максимально возможном для данного пациента (хотя и сниженном по сравнению с нормой) уровне.
Хроническая почечная недостаточность и концепция хронической болезни почек: взаимосвязь понятий и классификация
Ранее было предложено несколько различающихся между собой классификаций ХПН, основанных преимущественно на значениях сывороточного креатинина, что затрудняло реальную оценку состояния почечной функции у отдельных пациентов, сравнение результатов клинических исследований и выработку единых подходов к лечению и профилактике.
С целью создания единой классификации и универсальных критериев оценки тяжести поражения почек в 2002 г. Национальным почечным фондом США (National Kidney Foundation) впервые была сформулирована концепция ХБП (Chronic Kidney Disease), которая в дальнейшем обсуждалась и дорабатывалась экспертами Европейской почечной ассоциации – Европейской ассоциации диализа и трансплантации (European Renal Association – European Dialysis and Transplant Association), а также инициативной группой по улучшению глобальных исходов заболеваний почек (Kidney Disease: Improving Global Outcomes) [5, 6]. В настоящее время понятие ХБП и ее классификация получили признание во всем мире. В нашей стране рабочей группой членов правления Научного общества нефрологов России под руководством А.В. Смирнова с учетом международного опыта были созданы национальные рекомендации «Хроническая болезнь почек: основные положения, определение, диагностика, скрининг, подходы к профилактике и лечению» [7].
Напомним: под ХБП следует понимать наличие любых маркеров повреждения почек, персистирующих в течение более трех месяцев вне зависимости от нозологического диагноза. Диагноз ХБП устанавливается на основании следующих критериев:
- наличие любых клинических маркеров повреждения почек, подтвержденных с интервалом не менее трех месяцев;
- любые маркеры необратимых структурных изменений органа, выявленные однократно при прижизненном морфологическом исследовании органа или при его визуализации;
- снижение СКФ < 60 мл/мин/1,73 м² в течение трех и более месяцев вне зависимости от наличия других признаков повреждения почек.
Важно, что больные с трансплантированной почкой вне зависимости от наличия или отсутствия маркеров почечного повреждения всегда рассматриваются как пациенты с ХБП.
Другими словами, для диагностики ХБП необходимо подтвердить наличие маркеров повреждения почек как минимум с трехмесячным интервалом (для исключения обратимого почечного повреждения). Такой же интервал необходим для верификации снижения уровня СКФ < 60 мл/мин/1,73 м² в том случае, если это является единственным маркером ХБП. Иногда можно сразу диагностировать ХБП, например если данные однократно выполненных визуализирующих инструментальных методов или прижизненного морфологического исследования явно указывают на необратимые структурные изменения почек.
Концепция ХБП не отменяет необходимости установления нозологического диагноза. Согласно отечественным национальным рекомендациям в медицинской документации должен быть записан сначала нозологический диагноз, а затем ХБП с указанием стадии по СКФ (табл. 1), индекса альбуминурии/протеинурии и вида заместительной почечной терапии [7].
Очевидно, что ХБП – более широкое понятие, чем ХПН, основным признаком которой является стойкое снижение СКФ < 60 мл/мин/1,73 м². Больные с ХБП первой и второй стадии еще не являются пациентами с ХПН, но ХБП стадии 3а–5 (СКФ < 60 мл/мин/1,73 м²) соответствуют ХПН [6, 7].
Немаловажным является способ определения СКФ. Безусловно, золотым стандартом остаются клиренсные методики, но в клинической практике вполне допустимо использование простых расчетных методов, не требующих суточного сбора мочи: формулы Кокрофта – Голта, MDRD и CKD-EPI. Российские национальные рекомендации называют CKD-EPI предпочтительным методом оценки СКФ в амбулаторной клинической практике. Однако существуют ситуации, когда использование вышеуказанных расчетных методов определения СКФ неприемлемо: беременность, выраженное истощение или ожирение, заболевания скелетной мускулатуры, быстрое снижение функции почек, решение о начале заместительной почечной терапии, наличие почечного трансплантата и некоторые другие [8].
Распространенность хронической болезни почек среди женщин репродуктивного возраста и осложнения беременности при хронической болезни почек
Распространенность ХБП в общей популяции высока, при этом признаки поражения почек нередко выявляются и у женщин в репродуктивном периоде. По данным зарубежных авторов, распространенность ХБП первой – второй стадии у женщин детородного возраста (20–39 лет) составляет не менее 3%, а ХБП третьей – пятой стадии – примерно 0,6–0,7% [9]. В этой связи возникает актуальный вопрос: как влияет ХБП на течение и исходы беременности, а сама беременность – на прогноз заболевания почек?
Известно, что беременность у женщин с заболеваниями почек даже при сохранной почечной функции (ХБП первой стадии) сопровождается серьезными проблемами: повышенной по сравнению с общей популяцией частотой акушерских и перинатальных осложнений и преждевременных родов, необходимостью абдоминального родоразрешения, потребностью новорожденных в интенсивной терапии. По данным систематического обзора (2011), включившего 13 исследований, частота неблагоприятных материнских событий (гестационная артериальная гипертензия, преэклампсия, эклампсия и материнская смертность) у пациенток с ХБП составила 11,5% по сравнению с 2% у здоровых женщин [10].
Нельзя не отметить, что реальная частота осложнений беременности у больных с ХБП может существенно недооцениваться. По мере ухудшения функции почек частота этих осложнений растет, то есть стадия ХБП наряду с артериальной гипертензией и протеинурией более 1 г/сут увеличивает риск неблагоприятного исхода как для матери, так и для ребенка. Указанные факторы в большей степени, чем нозологический диагноз, влияют на прогноз беременности, конечно, за некоторыми исключениями [9, 11, 12].
Например, беременности однозначно следует избегать при узелковом периартериите, поражении почек в рамках системной склеродермии, амилоидозе почек [13]. Для других заболеваний определены специфические риски и особенности течения беременности. Так, системная красная волчанка повышает риск невынашивания, сопровождается высоким риском рецидивов в период гестации, повышенной материнской (1,15%) и перинатальной (до 23%) смертностью. Диабетическая нефропатия обусловливает высокий риск развития нефротического синдрома и высокую перинатальную смертность (до 10%), а рефлюкс-нефропатия – значимый риск мочевой инфекции во время беременности [13].
Совсем недавно, в середине XX века, нередко прерывали беременность по медицинским показаниям не только у женщин с артериальной гипертензией, нефротическим синдромом, но и у пациенток с умеренным мочевым синдромом, а беременность при сниженной функции почек практически не имела перспектив. Однако с течением времени исходы беременности у женщин с заболеваниями почек и ХПН улучшались.
Если в 1950 г. перинатальная смертность в группе пациенток с креатинином сыворотки 1,5–3,0 мг/дл (132,5–265 мкмоль/л) составляла 58%, а при уровне креатинина > 3,0 мг/дл (> 265 мкмоль/л) – 100%, то к 1980 г. данный показатель снизился до 10 и 53% соответственно. По обобщенным данным 1985–2007 гг., у женщин с сывороточным креатинином 125–180 мкмоль/л перинатальная смертность составляла 5%, стойкая потеря почечной функции в послеродовом периоде более чем на 25% от исходной – 20%, частота развития терминальной ХПН через год после родов – 2%. При повышении уровня содержания креатинина в плазме крови > 180 мкмоль/л эти показатели увеличивались до 10, 50 и 35% соответственно.
Таким образом, результаты беременности даже при значениях сывороточного креатинина 125–180 мкмоль/л (что соответствует в основном ХБП 3а и 3б стадии) выглядят обнадеживающими. Эти данные вполне согласуются с действующим приказом Минздравсоцразвития России от 03.12.2007 № 736 «Об утверждении перечня медицинских показаний для искусственного прерывания беременности». В приказе отмечается, что основанием для прерывания беременности служит ХПН любой этиологии с уровнем креатинина крови до зачатия выше 200 мкмоль/л или с прогрессирующим нарастанием креатинина крови в любой срок гестации.
Характеристика осложнений беременности при хронической болезни почек
В целом осложнения беременности у пациенток с ХПН можно условно разделить на две большие группы.
I. Осложнения, связанные с наличием/прогрессированием ХБП:
- присоединение или усугубление артериальной гипертензии;
- присоединение или усугубление протеинурии;
- ухудшение почечной функции (развитие не всегда обратимого острого почечного повреждения на фоне ХБП);
- анемия;
- присоединение/обострение уже имеющихся инфекционно-воспалительных заболеваний мочевыделительной системы;
- более частое по сравнению с беременными без ХБП присоединение преэклампсии (с трудностями проведения дифференциального диагноза между обострением заболевания почек и симптомами преэклампсии).
II. Осложнения, связанные с патологией фетоплацентарного комплекса:
- перинатальные потери (прерывание беременности по медицинским показаниям, самопроизвольный выкидыш, неразвивающаяся беременность, перинатальная смертность);
- фетоплацентарная недостаточность, синдром задержки роста плода, гипотрофия, рождение детей с экстремально малой для гестационного срока массой тела, хроническая внутриутробная гипоксия плода;
- преждевременные роды;
- возможность рождения детей с аномалиями развития [9, 13–16].
Даже у здоровых беременных наблюдается снижение гемоглобина, которое объясняется нарастающим дефицитом железа, обусловленным быстрым ростом плода, и феноменом «разведения» крови в связи с физиологической задержкой жидкости во время беременности. Однако у больных с ХПН снижение гемоглобина более выражено, чем у здоровых женщин, и развивается раньше.
Преэклампсия у беременных с хронической болезнью почек
Одной из самых серьезных проблем у беременных с ХБП, особенно при сниженной почечной функции, является более высокая по сравнению со здоровыми женщинами частота развития преэклампсии (гестоза). Чем выше уровень креатинина, тем выше частота преэклампсии. При значениях креатинина до беременности < 125 мкмоль/л преэклампсия развивалась у 20% беременных, 125–180 мкмоль/л – у 40%, более 180 мкмоль/л – у 60%, а у пациенток на диализе – в 75% случаев [1, 9, 11, 13, 16, 17]. В этих условиях важную роль приобретает профилактика преэклампсии у беременных с ХПН.
Преэклампсия представляет собой акушерское осложнение, которое развивается после 20 недель гестации и проявляется артериальной гипертензией, протеинурией, в некоторых случаях отеками. Тяжелые формы преэклампсии могут быстро приводить к развитию таких осложнений, как инсульт, острое почечное повреждение, острая левожелудочковая недостаточность, полиорганная недостаточность, и являются одной из основных причин материнской смертности [14, 15, 18].
Патогенез этого осложнения в настоящее время остается не совсем ясным, однако известно, что недостаточная инвазия трофобласта в ранние сроки приводит к неполноценной гестационной перестройке миометральных сосудов и ишемии плаценты. При неосложненной беременности в результате первой волны инвазии трофобласта (первые 12 недель беременности) децидуальные сегменты спиральных артерий замещаются прорастающим в них трофобластом и формирующимся фибриноидом, что сопровождается значительным притоком крови к межворсинчатому пространству. Во время второй волны инвазии трофобласта (14–19 недель гестации) последний внедряется в стенки артериальных сосудов, расположенных в миометральном сегменте. Процесс гестационной перестройки сосудистой системы матки сопровождается интенсивной продукцией простагландинов класса Е2, снижением общего сосудистого сопротивления и соответственно снижением системного артериального давления у матери (в среднем на 10–12 мм рт. ст.). Снижение глубины инвазии трофобласта и неполноценная имплантация в последующем приводят к нарушениям маточно-плацентарного и плодово-плацентарного кровотоков, задержке роста плода, его внутриутробной гибели, а также присоединению преэклампсии. Развивается массивное поражение эндотелия, артериальная гипертензия, поражение почек, фетоплацентарная недостаточность, в тяжелых случаях – полиорганная недостаточность. Тяжелые формы преэклампсии обусловливают в некоторых случаях и стойкое снижение почечной функции после родов.
Причины более частого возникновения преэклампсии у женщин с заболеваниями почек до конца не ясны, однако высказана гипотеза, объясняющая предрасположенность к развитию преэклампсии пациенток с ХБП общим патогенетическим механизмом этих двух состояний – дисбалансом ангиогенных и антиангиогенных факторов.
В профилактике развития преэклампсии достаточно давно используются антитромбоцитарные препараты и/или антикоагулянты [19, 20]. Нередко применяется сочетание ацетилсалициловой кислоты (аспирина) и дипиридамола, особенно у женщин с заболеваниями почек. Крупный систематический обзор (42 исследования) продемонстрировал, что прием антитромбоцитарных препаратов (низкие дозы аспирина или дипиридамол) по сравнению с плацебо или отсутствием лечения указанными выше препаратами у женщин с высоким риском преэклампсии снижал риск преэклампсии (на 15%), преждевременных родов до 37 недель гестации (на 8%) и смерти новорожденных (на 14%) [19].
При высоком риске преэклампсии с целью улучшения исходов беременности назначаются также прямые антикоагулянты. Гепарин как нефракционированный, так и низкомолекулярный прочно занял место в акушерско-гинекологической практике [21]. Известно, что у женщин с тяжелой преэклампсией в анамнезе профилактика преэклампсии, задержки внутриутробного роста плода и неблагоприятного исхода беременности гепарином в сочетании с аспирином была более эффективной, чем применение с этой целью только аспирина. У женщин с антифосфолипидными антителами сочетание гепарина с аспирином также превосходило аспирин по эффективности в достижении более высокой частоты рождения живых детей [20].
У пациенток с генетическими тромбофилиями гепарин не только снижает частоту спонтанных абортов, но и уменьшает риск задержки внутриутробного роста плода, преждевременных родов и преэклампсии [22]. При этом действие гепарина не ограничивается антикоагулянтным эффектом. Он либо прямо, либо опосредованно через гепарансульфат протеогликан или гепарин-связывающий фактор роста, подобный эпидермальному, участвует в адгезии бластоцисты к эндометрию и последующей инвазии.
Одним из важнейших патогенетических механизмов преэклампсии является снижение уровня фактора роста эндотелия сосудов и увеличение уровня его растворимых рецепторов (sFlt1). Применение низкомолекулярных гепаринов во время беременности повышает уровень циркуляции фактора роста эндотелия сосудов и sFlt1, при этом уровень фактора роста эндотелия сосудов в большей степени. По данным исследований in vitro, и нефракционированный, и низкомолекулярный гепарин усиливает ангиогенез в кондиционированной клетками человеческой плаценты среде, что косвенно подтверждает роль неантикоагулянтного эффекта гепарина в профилактике преэклампсии [23].
Процесс децидуализации эндометрия, имплантации плодного яйца и полноценной гестационной перестройки сосудистой системы матки является прогестеронозависимым, поэтому дефицит прогестерона – серьезный предиктор невынашивания беременности. По этой причине у женщин группы высокого риска особое значение приобретает гормональная поддержка лютеиновой фазы на этапе планирования беременности – применение гестагенов на протяжении первого и частично второго триместра гестации (в период первой и второй волны инвазии трофобласта).
Очевидно, что все пациентки с ХБП, даже с первой и второй стадией, относятся к группе высокого риска развития преэклампсии. С учетом приведенных данных у беременных с ХБП оправданно для профилактики преэклампсии и ухудшения почечной функции использовать гепарин и антитромбоцитарные препараты (дипиридамол или ацетилсалициловую кислоту в малых дозах – 75–125 мг/сут), особенно при снижении почечной функции и/или подтвержденной тромбофилии. На этапе прегравидарной подготовки женщинам с ХБП целесообразно применять гестагенсодержащие лекарственные средства (Дюфастон или Утрожестан). Если беременность не планировалась, эти препараты назначаются в ранние сроки гестации.
Беременность у женщин с заболеваниями почек даже при сохранной почечной функции (ХБП первой стадии) может сопровождаться повышенной по сравнению с общей популяцией частотой акушерских и перинатальных осложнений, а при развитии ХПН, то есть стойком снижении СКФ < 60 мл/мин/1,73 м², частота этих осложнений только возрастает. Тем не менее благоприятный исход беременности у женщин с ХПН возможен.
Принятие решения о возможности беременности у пациенток с хронической почечной недостаточностью (хроническая болезнь почек третьей – пятой стадии)
Одной из наиболее сложных задач для акушеров-гинекологов и нефрологов является принятие решения о возможности планирования беременности или пролонгирования незапланированной беременности у пациенток с известной ХПН, а также сохранения ребенка у женщин с ХПН, впервые диагностированной во время беременности.
В таблице 2 приведена часть Перечня медицинских показаний для искусственного прерывания беременности, касающаяся болезней мочеполовой системы, из уже упоминавшегося приказа Минздравсоцразвития № 736. Как видно из представленного документа, показаниями к прерыванию беременности, связанными со снижением почечной функции, являются любая форма хронического гломерулонефрита в стадии обострения с креатинином крови 200 мкмоль/л и выше; ХПН любой этиологии с уровнем креатинина сыворотки крови до зачатия, превышающим 200 мкмоль/л, или с прогрессирующим нарастанием креатинина сыворотки в любой срок беременности; единственная почка при азотемии.
Постановка диагноза ХПН во время беременности может вызывать затруднения и требует от врачей определенного опыта работы и знаний об особенностях функциональных изменений почечного кровотока и почечной функции в период гестации. Нормы некоторых лабораторных показателей во время беременности изменяются, что усложняет дифференциальную диагностику нормы и патологии. Так, вследствие специфики изменений гемодинамики при беременности и увеличения СКФ нормальные значения СКФ на самых ранних сроках гестации повышаются, составляя в среднем 120–150 мл/мин/1,73 м², поэтому нормальный уровень креатинина сыворотки оказывается ниже, чем до беременности. Следовательно, показатели, считающиеся верхней границей нормы креатинина (80–96 мкмоль/л) и нижней границей нормальных значений СКФ (80–90 мл/мин/1,73 м²) для небеременных, во время беременности могут свидетельствовать о нарушении функции почек. Для точного установления стадии ХБП необходимо, конечно, иметь данные об уровне креатинина и СКФ до беременности, что на практике далеко не всегда возможно.
Следует помнить: известные формулы расчета СКФ не предназначены для использования у беременных. Именно поэтому оценка почечной функции у беременных основывается на исследовании креатинина сыворотки в динамике и СКФ по клиренсу эндогенного креатинина (проба Реберга со сбором суточной мочи).
Для пациентки с ХПН, перед которой встает вопрос о целесообразности осуществления своей репродуктивной функции, важно реально оценить акушерские и нефрологические риски. Помощь в принятии верного решения является сложной этической и клинической задачей как для акушеров-гинекологов, так и для нефрологов.
Беременность можно планировать при отсутствии обострения основного заболевания и артериальной гипертензии (или при адекватном контроле артериального давления препаратами, разрешенными во время беременности), стабильной почечной функции (без ее быстрого снижения), ХБП первой и второй стадии. На третьей стадии ХБП беременность возможна, но решение принимается консилиумом специалистов индивидуально в каждом конкретном случае. Безусловно, стадия 3а (СКФ 45–59 мл/мин/1,73 м²) более благоприятна в отношении исхода беременности, чем стадия 3б (СКФ 30–44 мл/мин/1,73 м²). При ХБП четвертой и пятой стадии риски очень высоки и лучше рекомендовать женщине воздержаться от беременности. Если беременность у таких пациенток пролонгируется, то, как правило, дальнейшее снижение СКФ во время гестации обусловливает необходимость экстренного проведения заместительной почечной терапии (лечение диализом). В некоторых случаях следует убедить женщину отложить беременность на некоторое время до получения стойкой ремиссии заболевания с возможным улучшением почечной функции, например если проводится патогенетическая терапия и ухудшение функции почек хотя бы частично обратимо.
Для женщин с ХБП пятой стадии, получающих лечение диализом (программным или перитонеальным), как правило, характерны ановуляторные циклы и бесплодие. Тем не менее частота беременности у женщин детородного возраста, находящихся на диализном лечении, составляет около 0,5% в год, при этом далеко не все беременности заканчиваются успешно. В последнее время результаты несколько улучшились – различные исследования и регистры сообщают о рождении живых детей у пациенток, находящихся на диализном лечении, в 40–85% случаев [24, 25]. Случаи успешной беременности у женщин, получающих программный гемодиализ, описаны и в отечественной литературе.
В то же время беременность у диализных пациенток сопряжена с повышенной частотой серьезных материнских и фетальных осложнений, таких как невынашивание беременности, преждевременная отслойка нормально расположенной плаценты, анемия, инфекции, многоводие, неконтролируемая артериальная гипертензия, преэклампсия/эклампсия, акушерские кровотечения, необходимость выполнения кесарева сечения, материнская смертность, задержка внутриутробного роста плода, преждевременные роды, респираторный дистресс-синдром и потребность в интенсивной терапии новорожденных, внутриутробная смерть плода или смерть ребенка в неонатальном периоде [6].
Если женщина получает лечение диализом и не имеет противопоказаний к трансплантации почки, лучше планировать беременность в посттрансплантационном периоде, поскольку вероятность благоприятного исхода беременности у пациенток с хорошо функционирующим ренальным трансплантатом гораздо выше, чем у больных на программном диализе. Выделяют следующие предикторы благоприятного течения беременности у женщин с трансплантированной почкой [26, 27]:
- интервал между трансплантацией почки не менее двух и не более семи лет;
- уровень креатинина сыворотки не выше 0,15 ммоль/л;
- суточная протеинурия не более 0,5 г;
- артериальное давление не выше 140/90 мм рт. ст.;
- минимальные дозы иммуносупрессантов: доза преднизолона менее 15 мг/сут, концентрация циклоспорина в крови 100–150 нг/мл.
Следует также добавить, что у реципиенток почечного трансплантата, планирующих беременность, не должно быть урологических осложнений, вызывающих нарушение оттока мочи из трансплантированной почки, а также тяжелых инфекционных осложнений, прежде всего рецидивирующего пиелонефрита трансплантата.
В случае настойчивого желания пациенткой материнства нефрологи и акушеры-гинекологи совместно должны разрабатывать индивидуальные (с учетом конкретной клинической ситуации) алгоритмы прегравидарной подготовки и ведения беременности, тактику родоразрешения и послеродового наблюдения для каждой пациентки с ХПН. В зависимости от характера заболевания почек и сопутствующих заболеваний следует привлекать к ведению таких беременных врачей других специальностей: ревматологов (при системной красной волчанке, других системных заболеваниях), урологов, трансплантологов, эндокринологов, гематологов, генетиков. Только междисциплинарный подход, слаженная работа команды врачей и полное взаимопонимание с пациенткой обеспечат успех.
Самые сложные ситуации возникают, когда пациентка с ХПН не планирует беременность и обращается к врачу уже по факту наступления беременности, иногда уже на довольно большом сроке гестации. Конечно, исходы таких беременностей хуже, чем у женщин с той же стадией ХБП, но планировавших беременность с акушером-гинекологом и нефрологом, прошедших прегравидарную подготовку и получивших весь комплекс мероприятий по профилактике осложнений с ранних сроков беременности. При принятии решения о возможности пролонгирования беременности необходимо руководствоваться упомянутым выше приказом Минздравсоцразвития России № 736.
Если пациентка желает сохранить беременность, то комиссия в составе врача акушера-гинеколога, врача нефролога и главного врача больницы оформляет документ информированности пациентки о ее состоянии здоровья и имеющихся у нее противопоказаниях к вынашиванию беременности, а также о ее отказе от прерывания беременности. Отказ заверяется подписями пациентки, членов комиссии и печатью медицинского учреждения и приобщается к медицинской документации. Такая беременная вплоть до родоразрешения должна наблюдаться в многопрофильном медицинском центре, имеющем в своей структуре нефрологическое (или терапевтическое), акушерско-гинекологическое и неонатальное отделения. Если в регионе подобного центра нет, то с 28-й недели гестации пациентка должна находиться в стационаре акушерского профиля с возможностью постоянной консультативной поддержки нефролога [13].
Особенности прегравидарной подготовки у пациенток с хронической болезнью почек
Во время прегравидарной подготовки важно отменить препараты, использование которых опасно в период гестации (категории C и D по классификации FDA), или заменить их на лекарства, разрешенные беременным. Многие компоненты нефропротективной стратегии у женщин с ХБП во время беременности должны быть исключены. Ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина II противопоказаны при беременности, так как нарушают развитие и функционирование не только почек, но и других органов плода с отдаленными последствиями, если новорожденный выживает. Для обозначения данного состояния недавно был предложен термин «фетальный синдром блокады ренин-ангиотензин-альдостероновой системы».
Должен быть прекращен прием статинов. Если беременность была незапланированной, то препараты, блокирующие ренин-ангиотензин-альдостероновую систему, и статины отменяют сразу после констатации беременности. Если пациентка постоянно получала варфарин, то на этапе прегравидарной подготовки необходимо заменить его гепаринотерапией. Что касается иммуносупрессивных препаратов, то прием кортикостероидов и/или циклоспорина A или такролимуса может быть продолжен во время беременности. В то же время микофенолаты (микофенолат мофетил, микофенолат натрия) должны быть отменены не позднее чем за четыре – шесть недель до предполагаемого зачатия. То же относится и к препаратам – ингибиторам пролиферативного сигнала (сиролимусу, эверолимусу), использующимся в трансплантологии. После окончания лечения циклофосфамидом до наступления беременности должно пройти не менее двух лет.
При высоком риске преэклампсии и фетоплацентарной недостаточности (по нашему мнению, все женщины с ХБП относятся к этой группе) уже на этапе планирования беременности необходимо начинать прием гепарина и дипиридамола. Возможно применение как нефракционированных, так и низкомолекулярных гепаринов. Предпочтительнее использовать низкомолекулярные гепарины, поскольку они обладают значительно большей активностью в отношении X фактора свертывания, вызывая при этом меньше геморрагических осложнений. Кроме того, низкомолекулярные гепарины корригируют основные патогенетические осложнения, вызванные прогрессированием ХБП: улучшают липидный профиль (в отличие от нефракционированных низкомолекулярные гепарины не активируют фермент липопротеинлипазу), а также снижают эффект потери костной массы, свойственной для данной группы пациентов. По сравнению с нефракционированными низкомолекулярные гепарины имеют ряд преимуществ:
- более высокую биодоступность;
- более продолжительный период полувыведения после подкожной инъекции;
- возможность амбулаторного применения;
- удобство дозирования из-за более широкого терапевтического диапазона и прогнозируемого ответа;
- отсутствие необходимости рутинного лабораторного контроля антикоагулянта;
- однократное ежедневное подкожное введение.
У пациентов с ХБП гепарины лидируют в схемах профилактики прогрессирования и лечения разнообразных нефропатий, особенно во время беременности [28, 29, 30]. С этой точки зрения интерес представляет препарат второго поколения из группы низкомолекулярных гепаринов – бемипарин натрия, выпускаемый под торговым названием Цибор®. Отличительными от других низкомолекулярных гепаринов особенностями препарата Цибор® являются:
- самый низкий молекулярный вес;
- минимальное по сравнению с другими низкомолекулярными гепаринами ингибирование IIa фактора;
- самая высокая среди низкомолекулярных гепаринов анти-Xa активность;
- самое высокое соотношение анти-Xa/IIa факторной активности, позволяющее минимизировать серьезные геморрагические осложнения.
Антикоагулянты обычно применяются в течение всей беременности, а отменяются не позднее чем за 12 часов до родов. С целью профилактики ухудшения почечной функции и тромбоэмболических осложнений после кесарева сечения, частота которого у пациенток с второй – пятой стадией ХБП очень высока и достигает 50–75%, лечение препаратом Цибор® целесообразно возобновлять в первые сутки послеродового периода (но не ранее чем через шесть часов после родов) и продолжать не менее пяти-шести недель. С профилактической целью препарат Цибор® вводится путем подкожных инъекций в дозе 3500 МЕ один раз в сутки [31–35].
Пациенткам с ХБП и доказанным антифосфолипидным синдромом в течение всей беременности и послеродовом периоде показано лечение аспирином перорально в дозе 75–100 мг/сут и подкожное введение низкомолекулярных гепаринов.
Дипиридамол (Курантил®) также является незаменимым препаратом при ведении беременности у пациенток с ХБП. Действуя на микроциркуляторном уровне почек, он влияет на уродинамику, способствует активации обменных процессов в почках и, возможно, развитию коллатерального кровообращения, улучшает функции фетоплацентарного кровотока. Данный препарат оказывает антиагрегантное, антитромбоцитарное действие. Он умеренно снижает протеинурию и гематурию, уменьшает темпы прогрессирования нефрологической патологии, обладает антиоксидантными свойствами [36].
На этапе прегравидарной подготовки пациенткам с ХБП по решению акушера-гинеколога назначаются гестагенсодержащие медикаменты (Дюфастон или Утрожестан). Препараты принимаются во вторую фазу менструального цикла с продолжением терапии в непрерывном режиме с момента положительного теста на беременность до 20-й недели гестации с постепенной их отменой в течение недели. Дюфастон применяется по 10 мг два раза в сутки перорально, Утрожестан – до 12 недель 200 мг/сут вагинально, после 12 недель 300 мг/сут перорально. Женщины, не планировавшие беременность, начинают прием этих препаратов в ранние сроки гестации. Учитывая прогестероновую составляющую указанных препаратов, в период лечения особое внимание необходимо уделять профилактике развития инфекций мочевыводящих путей и выявлению бактериурии.
Ведение беременности у женщин с хронической болезнью почек
Беременная с ХБП должна наблюдаться и акушером-гинекологом, и нефрологом с частотой визитов не реже одного раза в две недели до 28-й недели гестации, далее еженедельно. Пациентка ежедневно должна осуществлять самоконтроль артериального давления (минимум два раза в день) и массы тела. Необходимо чаще, чем у здоровых беременных, контролировать уровень креатинина сыворотки, мочевой кислоты, суточной протеинурии, сравнивать результаты коагулограммы, ультразвуковой картины почек, показатели состояния плода, обязательно мониторировать бессимптомную бактериурию.
Общий анализ мочи выполняется один раз в неделю, а клинический анализ крови (с обязательным определением тромбоцитов), определение суточной протеинурии, посев мочи, биохимическое исследование сыворотки крови (в том числе определение уровня креатинина, натрия, калия, общего белка, альбумина) производятся один раз в две недели до 30–32 недель гестации, далее еженедельно [13]. Обязателен мониторинг концентрации кальция и фосфора в крови, поскольку нарушения фосфорно-кальциевого обмена, свойственные ХБП, могут влиять на развитие скелета плода и неблагоприятно сказаться на состоянии беременной. Известно, что концентрация циклоспорина и такролимуса в крови значительно снижается во время беременности. В этой связи у беременных, принимающих циклоспорин или такролимус, следует регулярно контролировать концентрацию этих препаратов в крови – не реже одного раза в две – четыре недели, а при необходимости и чаще, а также корректировать их дозу.
С момента диагностики беременности пациенткам рекомендовано избегать жесткого ограничения потребления соли (не менее 5–6 г/сут) и жидкости (не менее 1800 мл/сут), а также повысить потребление белка до 1,0–1,2 г/кг/сут, а во второй половине беременности – до 1,6–1,8 г/кг/сут. Рекомендуемая суточная доза потребления белка на гемодиализе составляет до 1,5 г/кг/сут, а на перитонеальном диализе – до 1,8 г/кг/сут с калорийностью рациона 30–35 ккал/кг/сут. Жесткое ограничение соли и снижение квоты белка в пищевом рационе недопустимы у беременных даже при ХПН. Это может привести к задержке внутриутробного роста плода, недостаточному образованию числа почечных клубочков у плода в процессе эмбриогенеза, а следовательно, и стать причиной будущей предрасположенности ребенка к артериальной гипертензии и ХБП. Необходимо также обеспечить потребность беременной в водорастворимых витаминах [16].
Если беременность наступила у пациентки, получающей терапию программным гемодиализом, и больная категорически настроена на пролонгирование беременности, необходимо интенсифицировать диализную программу. Однозначных рекомендаций относительно оптимальной дозы диализа при беременности не существует, но увеличение диализного времени свыше 20 часов в неделю улучшает исходы. Ежедневный диализ с медленной ультрафильтрацией позволяет достигнуть максимального снижения азотемии, избежать эпизодов гиповолемии и артериальной гипотонии, а также нарушений маточно-плацентарно-плодового кровотока. Объем потребления жидкости и удаления ее в процессе гемодиализа устанавливается врачом строго индивидуально. Обычно начиная со второго триместра беременности «сухой вес» (постдиализный) постепенно увеличивают в среднем на 450 г в неделю [24, 25].
У беременных с ХБП для коррекции артериального давления в плановом порядке применяются дигидропиридиновые антагонисты кальция (нифедипин, амлодипин) иногда в сочетании с селективными бета-адреноблокаторами (бисопрололом, небивололом), метилдопой, гидралазином. Желательно для диагностики артериальной гипертензии и контроля эффективности терапии использовать суточное мониторирование артериального давления.
При лечении преэклампсии в обязательном порядке используется классическая магнезиальная терапия, при этом суточная доза сульфата магния при ХПН должна уменьшаться в соответствии со снижением СКФ для предотвращения тяжелой гипермагниемии. Оптимально применение сульфата магния под контролем уровня магния в крови. Терапевтической концентрацией магния в сыворотке крови на фоне лечения сульфатом магния считается уровень 2,0–4,0 ммоль/л, пограничным в отношении развития осложнений (парезов, нарушений дыхания) – 5,0 ммоль/л, критическим – 6,5 ммоль/л [37].
Для лечения анемии во время беременности используются пероральные (при тяжелой анемии – внутривенные) препараты железа в сочетании с фолиевой кислотой. Беременным, получающим диализную терапию, препараты железа назначают внутривенно под контролем гемоглобина и ферритина сыворотки. Необходимо помнить, что за время беременности мать и плод должны получить около 800–1000 мг железа. Эритропоэтины редко используются у беременных с ХБП третьей стадии, но почти всегда входят в протокол лечения анемии после родоразрешения, а также при беременности у пациенток на гемодиализе или с трансплантированной почкой. Целевыми значениями гемоглобина и гематокрита у беременных на диализе считаются значения 100–110 г/л и 30–35% соответственно [13].
Следует стремиться поддерживать нормальные показатели кальция и фосфора сыворотки крови у беременных с ХПН. Для устранения гипокальциемии и в качестве фосфатсвязывающих препаратов может использоваться карбонат кальция до 2–3 г/сут. С целью коррекции вторичного гиперпаратиреоза и/или гипокальциемии можно также дополнительно назначать активные метаболиты витамина D – кальцитриол или альфа-D₃ в дозе 0,125–0,25 мкг/сут или через день. Препараты кальция и витамина D₃ должны приниматься под тщательным контролем кальция и фосфора в сыворотке. При чрезмерном повышении уровня кальция, повышении фосфорно-кальциевого произведения (кальций × фосфор) до ≥ 4,4 ммоль²/л² препараты должны быть отменены, поскольку высок риск внескелетной кальцификации и острого почечного повреждения. Такие препараты, как севеламер, лантана карбонат, алюминия гидроксид, цинакалцет и парикальцитол, применяющиеся для коррекции костно-минеральных нарушений у диализных больных, у беременных не исследовались [37].
Беременность у пациенток с ХБП часто осложняется присоединением/обострением инфекции мочевыводящих путей, клиническая картина которой, как правило, стерта. Возможная инфекция мочевыводящих путей у беременных с ХБП может проявляться внезапным падением СКФ и повышением креатинина сыворотки крови, присоединением/усугублением гипертензии, необъяснимым ухудшением общего состояния. В этой связи необходимо проводить мониторинг бессимптомной бактериурии и в случае обнаружения инфекции назначать препараты, разрешенные к приему во время беременности и не обладающие нефротоксичностью. Пиелонефрит у беременных необходимо лечить только в стационаре в течение не менее трех-четырех недель. При обструктивном пиелонефрите важно до начала антибактериальной терапии восстановить нормальный отток мочи [17].
Одними из ведущих патогенетических механизмов развития фетоплацентарной недостаточности являются нарушения маточно-плацентарно-плодового и фетоплацентарного кровотока. Нарушения сопровождаются повышением вязкости крови, гиперагрегацией эритроцитов и тромбоцитов, расстройством микроциркуляции и сосудистого тонуса, недостаточностью артериального кровообращения.
Дипиридамол (Курантил®) активирует аденилатциклазу и ингибирует фосфодиэстеразу, увеличивая тем самым содержание циклического аденозинмонофосфата и аденозина в клетках гладкой мускулатуры сосудов, что приводит к их расслаблению и вазодилатации. Под действием препарата Курантил® увеличивается концентрация циклического аденозинмонофосфата в тромбоцитах, что предотвращает их агрегацию, адгезию, выделение активаторов агрегации, факторов свертывания крови и вазоконстрикторов, а также стимулирует синтез простациклина в сосудистой стенке, препятствуя адгезии тромбоцитов к эндотелию сосудов. Фибринолитическое действие препарата обусловлено высвобождением плазминогена из стенки сосудов [38]. Стимулируя аденозиновые рецепторы, Курантил® увеличивает плотность капиллярного русла, активизирует коллатеральное кровообращение, компенсирует снижение маточно-плацентарно-плодового кровотока. Благодаря применению препарата Курантил® улучшается маточно-плацентарно-плодовой и фетоплацентарный кровоток (повышается артериальный приток и нормализуется венозный отток из межворсинчатого пространства), снижается или устраняется гипоксия плода, редуцируются морфофункциональные нарушения в плаценте. Будучи стимулятором продукции эндогенного интерферона, Курантил® способствует антивирусной защите организма беременной. Курантил® не повышает тонус матки и не обладает эмбриотоксическим действием. Препарат принимается за один час до еды, доза постепенно увеличивается с 75 до 225 мг/сут, курс терапии составляет четыре – шесть недель [39, 40].
При развитии фетоплацентарной недостаточности используется Эссенциале Н по 5 мл (250 мг) внутривенно в течение десяти дней с последующим переходом на пероральный прием по 300–600 мг три раза в сутки. Кроме того, применяется Актовегин по 4–5 мл (160–200 мг) на 200 мл 5%-ного раствора глюкозы внутривенно капельно через день, курс лечения – десять инфузий с последующим пероральным приемом Актовегина форте по одному драже (200 мг) три раза в сутки в течение двух недель.
У беременных с высокой суточной потерей белка с мочой в комплекс лечения фетоплацентарной недостаточности целесообразно включать растворы аминокислот, обладающие метаболическим действием (Аминостерил КЕ, Аминовен), по 400 мл внутривенно капельно через день. Длительность лечения аминокислотами зависит от степени выраженности страдания плода. При фетоплацентарной недостаточности с повышенной сократительной активностью матки рекомендуются бета-адреномиметики: Гинипрал по 0,25–0,5 мг четыре – шесть раз в сутки внутрь или внутривенно капельно в дозе 5 мг в 400 мл 0,9%-ного раствора хлорида натрия со скоростью 10–30 капель в минуту. При высоком риске досрочного родоразрешения (угроза преждевременных родов, преэклампсия) всем пациенткам в течение двух суток обычно проводится профилактика респираторного дистресс-синдрома плода дексаметазоном трехкратно внутримышечно в дозе 12 мг на курс.
Как указывалось выше, иногда сложно диагностировать у пациенток с ХБП присоединение преэклампсии. Особенно трудно разграничить преэклампсию и гипертонический криз у беременных на гемодиализе, поскольку для большинства диализных пациентов характерна анурия. В этой связи использование важнейшего критерия преэклампсии – появления или нарастания протеинурии становится невозможным. При подозрении на преэклампсию необходима срочная госпитализация в акушерский стационар, мониторинг артериального давления, диуреза и состояния плода, ежедневный контроль гемоглобина, количества тромбоцитов периферической крови, суточной протеинурии, креатинина, мочевины, мочевой кислоты, лактатдегидрогеназы, трансаминаз, натрия, калия, а также желательно магния, кальция и фосфора сыворотки крови.
Преэклампсия диагностируется при появлении (или нарастании тяжести) артериальной гипертензии в сочетании с протеинурией не менее 300 мг/сут после 20-й недели беременности и отсутствии других причин повышения артериального давления и появления белка в моче. У женщин с исходно имевшейся протеинурией неуклонное нарастание протеинурии в сочетании с появлением/усугублением артериальной гипертензии расценивается как преэклампсия. Дополнительными, хотя и не патогномоничными признаками, свидетельствующими о преэклампсии, можно считать падение СКФ в динамике и ухудшение маточно-плацентарно-плодового кровотока по данным ультразвуковой допплерографии.
Тактика родоразрешения и ведения пациенток с хронической болезнью почек в послеродовом периоде
Особенностью беременности при ХБП третьей – пятой стадии является высокая частота преждевременного родоразрешения: в среднем роды происходят на 36–37-й неделе гестации. Метод родоразрешения при ХПН выбирается акушером-гинекологом в зависимости от наличия акушерских осложнений.
Абсолютным показанием к абдоминальному родоразрешению является прогрессирующая фетоплацентарная недостаточность при недоношенности плода. Высокая частота операций кесарева сечения (более 50%) у таких больных связана с усугублением артериальной гипертензии, частым присоединением тяжелых форм гестоза (преэклампсии), возможностью прогрессивного ухудшения функции почек в сочетании с неготовностью родовых путей к родам.
Показанием к экстренному кесареву сечению может стать сочетание врожденных аномалий развития мочевыделительной системы с аномалиями строения матки и влагалища, однако данный вопрос решается строго индивидуально при наблюдении за развитием родовой деятельности и динамикой открытия маточного зева в родах.
Среди урологических показаний к кесареву сечению следует выделить выраженный гидронефроз с риском разрыва почки в родах, нейрогенный мочевой пузырь, экстрофию мочевого пузыря, выраженную тазовую дистопию почки, препятствующую рождению плода через естественные родовые пути, некупирующуюся почечную колику, возникшую из-за обструкции мочевыводящих путей конкрементом при доношенном сроке беременности. В то же время наличие трансплантированной почки, располагающейся в подвздошной области, не является препятствием для успешного родоразрешения через естественные родовые пути при их готовности к родам. Если же имеются акушерские показания к кесареву сечению, то желательно участие в оперативном вмешательстве хирурга-трансплантолога, чтобы избежать риска повреждения почечного трансплантата и его мочеточника.
Особенностью ведения послеродового периода у пациенток с ХБП, родоразрешенных путем кесарева сечения, является прием низкомолекулярных гепаринов с целью профилактики тромбоэмболических осложнений и ухудшения функции почек в течение пяти – шести недель.
Если пациентка получала во время беременности кортикостероиды, то во время родов (или кесарева сечения) целесообразно ввести метилпреднизолон 500 мг внутривенно капельно и еще 250–500 мг в первые сутки послеродового периода. В дальнейшем можно продолжить прием стероидных гормонов перорально. Прием микофенолатов в послеродовом периоде можно возобновить через семь – десять дней при отсутствии инфекционных осложнений, а лечение циклоспорином или такролимусом желательно не прерывать. При этом не следует забывать, что после родов могут отмечаться резкие колебания концентрации данных препаратов в крови, чаще в сторону превышения терапевтических значений. Это может вызывать нефро- и гепатотоксический эффекты.
При родоразрешении беременной с ХБП неонатологическая служба должна быть готова к выхаживанию новорожденных с задержкой внутриутробного роста плода, перинатальным поражением центральной нервной системы гипоксически-ишемического генеза, возможным внутриутробным инфицированием, респираторным дистресс-синдромом. Дети, рожденные от женщин, получающих лечение диализом, подлежат госпитализации в отделение интенсивной терапии даже при удовлетворительном общем состоянии, так как осложнения у них могут развиться в первые несколько суток послеродового периода. Особенно опасны возможная дегидратация и электролитные нарушения, связанные с полиурией за счет повышенного уровня мочевины при рождении. Через один – три дня показатели азотемии обычно приходят в норму, и полиурия прекращается.
В послеродовом периоде у матери важно продолжить мониторинг показателей почечной функции, артериального давления и протеинурии. Необходимо избегать назначения лекарственных препаратов, которые могут вызвать острое ухудшение функции почек на фоне ХПН: нефротоксичных антибиотиков (прежде всего аминогликозидов), нестероидных противовоспалительных препаратов, часто применяющихся в общей акушерской практике для обезболивания в послеоперационном периоде, ингибиторов фибринолиза аминокапроновой и транексамовой кислоты в качестве профилактики повышенной кровопотери во время оперативных родов [13].
До выписки из родильного отделения следует провести обследование, включающее в себя общий анализ мочи, крови, ультразвуковое исследование почек, матки, исследование почечной гемодинамики, общего белка, креатинина, мочевины, мочевой кислоты, электролитов, печеночных ферментов сыворотки крови, а также суточной протеинурии. После получения данных обследования акушеры и нефрологи совместно принимают решение:
- о возможности лактации;
- выписки из стационара или перевода в терапевтическое (нефрологическое) отделение;
- возобновлении терапии лекарственными средствами, прием которых был прерван из-за их тератогенности;
- особенностях диеты, антианемической и антигипертензивной терапии;
- методах контрацепции;
- алгоритме диспансерного наблюдения у нефролога.
Если после родоразрешения сохраняется высокая протеинурия, плохо корригируемая артериальная гипертензия, существенное или прогрессирующее снижение почечной функции, гипергидратация, электролитные нарушения, то есть отсутствует возможность выписать пациентку из стационара, больную переводят из родильного дома в отделение терапевтического профиля.
Врачам-терапевтам необходимо помнить, что морфологические признаки перенесенной преэклампсии в почках (гломерулярно-капиллярный эндотелиоз), а также протеинурия сохраняются на протяжении не менее шести – восьми недель после родов. В этой связи диагностическую нефробиопсию, если нет показаний к ускоренному проведению морфологического исследования, следует выполнять не ранее этого срока, а лучше через три-четыре месяца после родоразрешения. Риск прогрессирующего ухудшения почечной функции у пациенток с ХПН сохраняется в течение 6–12 месяцев после родов, у некоторых из них может возникнуть потребность в заместительной почечной терапии в течение первого года после родов.
Заключение
У женщин с ХБП первой – второй стадии и у части пациенток с ХПН (ХБП третьей стадии) при стабильной почечной функции, отсутствии тяжелой артериальной гипертензии и/или обострения заболевания почек на момент зачатия вероятность благоприятного исхода беременности достаточно высока. Это относится и к пациенткам после трансплантации почки: при определенных условиях (стабильная удовлетворительная функция трансплантата, отсутствие кризов отторжения пересаженной почки и тяжелых инфекционных осложнений, хорошо контролируемое артериальное давление) у них также возможна успешная беременность.
Однако эти беременные относятся к группе высокого риска развития тяжелых акушерских осложнений, неудовлетворительного перинатального исхода и стойкого снижения почечной функции после родов. Вероятность успеха повышается при планировании беременности, интенсивном совместном наблюдении беременных акушером-гинекологом и нефрологом, проведении профилактики преэклампсии с ранних сроков беременности, организованности и дисциплинированности самих пациенток.
1. Руководство по нефрологии / под ред. Р.В. Шрайера, пер. с англ. под ред. Н.А. Мухина. М.: ГЭОТАР-Медиа, 2009.
2. Шилов Е.М., Козловская Н.Л., Бобкова М.Ю. и др. Хроническая болезнь почек и программа народосбережения Российской Федерации // Клиническая нефрология. 2010. № 3. С. 29–38.
3. Мухин Н.А., Тареева И.Е., Шилов Е.М. и др. Диагностика и лечение болезней почек. Руководство для врачей. М.: ГЭОТАР-Медиа, 2008.
4. Нефрология / под ред. Е.М. Шилова. 2-е изд., испр. и доп. М.: ГЭОТАР-Медиа, 2008.
5. Williams D., Davison J. Chronic kidney disease in pregnancy // BMJ. 2008. Vol. 336. № 7637. P. 211–215.
6. Levey A.S., Eckardt K.U., Tsukamoto Y. et al. Definition and classification of chronic kidney disease: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO) // Kidney Int. 2005. Vol. 67. № 6. P. 2089–2100.
7. Нефрология: национальное руководство / под ред. Н.А. Мухина. М.: ГЭОТАР-Медиа, 2009.
8. Нефрология: неотложные состояния / под ред. Н.А. Мухина. М.: Эксмо, 2010.
9. Piccoli G.B., Attini R., Vasario E. et al. Pregnancy and chronic kidney disease: a challenge in all CKD stages // Clin. J. Am. Soc. Nephrol. 2010. Vol. 5. № 5. P. 844–855.
10. Nevis I., Reitsma A., Dominic A. et al. Pregnancy outcomes in women with chronic kidney disease: a systematic review // Clin. J. Am. Soc. Nephrol. 2011. Vol. 6. № 11. P. 2587–2598.
11. Davison J.M., Lindheimer M.D. Chronic renal disease // Clin. Obstet. Gynecol. 1984. Vol. 27. № 4. P. 891–901.
12. Piccoli G.B., Fassio F., Attini R. et al. Pregnancy in CKD: whom should we follow and why? // Nephrol. Dial. Transplant. 2012. Vol. 27. Suppl. 3. P. 111–118.
13. Экстрагенитальная патология и беременность: практическое руководство / под ред. Л.С. Логутовой. М.: Литтерра, 2012.
14. Bakker R., Steegers E.A., Hofman A. et al. Blood pressure in different gestational trimesters, fetal growth, and the risk of adverse birth outcomes: the generation R study // Am. J. Epidemiol. 2011. Vol. 174. № 7. P. 797–806.
15. Leshchinskiĭ L.A., Gaĭsin I.R., Maksimov N.I.. Basic and metabolic therapy of hypertensive disease in pregnant women // Klin. Med. (Mosk.). 2008. Vol. 86. № 9. P. 25–28.
16. Никольская И.Г., Новикова С.В., Баринова И.В. и др. Хроническая болезнь почек и беременность: этиология, патогенез, классификация, клиническая картина, перинатальные осложнения // Российский вестник акушера-гинеколога. 2012. № 5. С. 21–30.
17. Никольская И.Г., Новикова С.В., Будыкина Т.С. и др. Беременность у беременных с хронической почечной недостаточностью: тактика ведения и родоразрешения при консервативно-курабельной стадии // Российский вестник акушера-гинеколога. 2012. № 6. С. 21–28.
18. Сидорова И.С. Гестоз. М.: Медицина, 2007.
19. Knight M., Duley L., Henderson-Smart D.J. et al. WITHDRAWN: Antiplatelet agents for preventing and treating pre-eclampsia // Cochrane Database Syst. Rev. 2007. Vol. 18. № 2. CD000492.
20. Sergio F., Maria Clara D., Gabriella F. et al. Prophylaxis of recurrent preeclampsia: low-molecular-weight heparin plus low-dose aspirin versus low-dose aspirin alone // Hypertens. Pregnancy. 2006. Vol. 25. № 2. P. 115–127.
21. Gris J.C., Chauleur C., Molinari N. et al. Addition of enoxaparin to aspirin for the secondary prevention of placental vascular complications in women with severe pre-eclampsia. The pilot randomised controlled NOH-PE trial // Thromb. Haemost. 2011. Vol. 106. № 6. P. 1053–1061.
22. Badawy A.M., Khiary M., Sherif L.S. et al. Low-molecular weight heparin in patients with recurrent early miscarriages of unknown aetiology // J. Obstet. Gynaecol. 2008. Vol. 28. № 3. P. 280–284.
23. Hull R.D., Liang J., Townshend G. Long-term low-molecular-weight heparin and the post-thrombotic syndrome: a systematic review // Am. J. Med. 2011. Vol. 124. № 8. P. 756–765.
24. Европейские рекомендации по оптимальной практике гемодиализа (часть 1) / пер. с англ. А.Г. Строкова // Нефрология и диализ. 2005. Приложение. С. 65–74.
25. Руководство по диализу / под ред. Дж.Т. Даугирдаса, П.Дж. Блейка, Т.С. Инга / пер с англ. под ред. А.Ю. Денисова и В.Ю. Шило. 3-е изд. Тверь: Триада, 2003.
26. Данович Г.М. Трансплантация почки: руководство / пер. с англ. под ред. Я.Г. Мойсюка. М.: ГЭОТАР-Медиа, 2013.
27. Мурашко Л.Е., Кандидова И.Е., Сухих Г.Т. Заболевания почек у беременных и беременность после трансплантации почки. М.: Авторская Академия, 2012.
28. Guler T., Polat Z.A., Yayci E. et al. Effects of low molecular weight heparins and unfractionated heparin on viability of human umbilical vein endothelial cells // Arch. Gynecol. Obstet. 2013. Vol. 287. № 2. P. 217–222.
29. San Norberto García E.M., Merino B., Taylor J.H. et al. Low-molecular-weight heparin for prevention of venous thromboembolism after varicose vein surgery in moderate-risk patients: a randomized, controlled trial // Ann. Vasc. Surg. 2013. Vol. 27. № 7. P. 940–946.
30. Loira-Pastoriza C., Sapin-Minet A., Diab R. et al. Low molecular weight heparin gels, based on nanoparticles, for topical delivery // Int. J. Pharm. 2012. Vol. 426. № 1–2. P. 256–262.
31. Ciccone M.M., Cortese F., Corbo F. et al. Bemiparin, an effective and safe low molecular weight heparin: a review // Vascul. Pharmacol. 2014. Vol. 62. № 1. P. 32–37.
32. Sánchez-Ferrer C.F. Bemiparin: pharmacological profile // Drugs. 2010. Vol. 70. Suppl. 2. P. 19–23.
33. Alalaf S. Bemiparin versus low dose aspirin for management of recurrent early pregnancy losses due to antiphospholipid antibody syndrome // Arch. Gynecol. Obstet. 2012. Vol. 285. № 3. P. 641–647.
34. Cruz M., Fernández-Alonso A.M., Rodríguez I. et al. Postcesarean thromboprophylaxis with two different regimens of bemiparin // Obstet. Gynecol. Int. 2011. Vol. 2011. ID 548327.
35. Dogan O.T., Polat Z.A., Karahan O. et al. Antiangiogenic activities of bemiparin sodium, enoxaparin sodium, nadroparin calcium and tinzaparin sodium // Thromb. Res. 2011. Vol. 128. № 4. P. 29–32.
36. Шилов Е.М. Достижения и проблемы лечения гломерулонефрита // Лечащий врач. 2002. № 11. С. 34–37.
37. Никольская И.Г., Прокопенко Е.И., Ватазин А.В. и др. Тактика ведения беременности при хронической почечной недостаточности: осложнения и исходы // Эффективная фармакотерапия. Вып. 11. Акушерство и гинекология. № 1. С. 4–15.
38. Овсянникова Т.В., Шешукова Н.А. Применение Курантила при лечении гинекологических заболеваний // Гинекология. 2005. № 4. С. 254–256.
39. Dodd J.M., McLeod A., Windrim R.C. et al. Antithrombotic therapy for improving maternal or infant health outcomes in women considered at risk of placental dysfunction // Cochrane Database Syst. Rev. 2013. Vol. 7. CD006780.
40. Zamudio S., Kovalenko O., Echalar L. et al. Evidence for extraplacental sources of circulating angiogenic growth effectors in human pregnancy // Placenta. 2013. Vol. 34. № 12. P. 1170–1176.
Pregnancy in women with chronic renal disease
I.G. Nikolskaya, Ye.I. Prokopenko
Moscow regional scientific institute of obstetrics and gynecology
Moscow regional research clinical institute named after M.F. Vladimirsky
Contact person: Irina Georgiyevna Nikolskaya, guzmoniiag@gmail.com
A relationship between the concepts of chronic renal disease and chronic renal insufficiency is characterized. The data about incidence rate of chronic renal disease in women of reproductive age are represented. Frequency and pattern of obstetric and perinatal complications, and pregnancy outcomes in such women are described. Features of pregravid preparation, maintenance of pregnancy, tactics of delivery and observation of women with chronic renal disease during postpartum period are discussed.
Новости на тему
19.08.2022 01:00:00
15.08.2022 01:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.