COVID-19 и противоревматические препараты: ожидания и реальность
- Аннотация
- Статья
- Ссылки
- English
Нарушение регуляции цитокинов и гипервоспаление (цитокиновый шторм) послужили основанием для репозиционирования и применения по незарегистрированным показаниям широкого спектра препаратов, которые разрабатывались для лечения иммуновоспалительных ревматических заболеваний. Хотя проведено огромное количество клинических исследований указанных препаратов, многие проблемы остаются нерешенными, в частности разработка реальных и экономичных методов лечения пациентов, наиболее подверженных риску развития гипервоспаления и связанных с ним тяжелых исходов.
В статье проанализированы результаты применения противовоспалительных препаратов у больных COVID-19.
Нарушение регуляции цитокинов и гипервоспаление (цитокиновый шторм) послужили основанием для репозиционирования и применения по незарегистрированным показаниям широкого спектра препаратов, которые разрабатывались для лечения иммуновоспалительных ревматических заболеваний. Хотя проведено огромное количество клинических исследований указанных препаратов, многие проблемы остаются нерешенными, в частности разработка реальных и экономичных методов лечения пациентов, наиболее подверженных риску развития гипервоспаления и связанных с ним тяжелых исходов.
В статье проанализированы результаты применения противовоспалительных препаратов у больных COVID-19.
Введение
С декабря 2019 г., когда в китайском Ухане был обнаружен новый коронавирус SARS-CoV-2 (Severe Acute Respiratory Coronavirus 2), пандемия коронавирусной инфекции (COVID-19) распространилась по всему миру. На сегодняшний день насчитывается более 157 млн верифицированных случаев и более 3,2 млн смертельных исходов [1].
Несмотря на прогресс, достигнутый в отношении изучения механизмов, лежащих в основе заболевания, патогенез COVID-19 до конца не установлен. Известно, что основные клинические проявления и осложнения связаны с нарушением регуляции цитокинов и гипервоспалением, определяемым как цитокиновый шторм. Гипервоспаление может привести к острому респираторному дистресс-синдрому (ОРДС), полиорганной недостаточности и смерти [2].
Развитие этой тяжелой патологии послужило основанием для репозиционирования (drug repurposing) и применения по незарегистрированным показаниям широкого спектра противовоспалительных препаратов, которые специально разрабатывались для лечения иммуновоспалительных ревматических заболеваний (ИВРЗ) [3–7]. Не случайно на сегодняшний день именно ревматологи обладают колоссальным опытом применения иммуномодулирующих противовоспалительных препаратов. Он представляется особенно актуальным, поскольку существующие противовирусные препараты не показали значимого увеличения благоприятных исходов при COVID-19 [8–10].
По состоянию на середину июня 2021 г. в библиографической системе PubMed размещено более 3000 публикаций, освещающих аспекты применения разных иммуномодулирующих препаратов при новой коронавирусной инфекции. В то же время при попытке перепрофилировать антиревматические препараты для лечения COVID-19 «обязательный сбор всех вспомогательных данных, касающихся биомаркеров, фармакодинамики и безопасности, в целевой группе был ограничен или проигнорирован, хотя и из лучших побуждений» [11]. Как отмечают индийские ученые, пандемия COVID-19 представляет собой классический конфликт между клинической и академической медициной. Клиническая медицина, или медицина у постели больного, основанная на широкой доказательной базе, также позволяет назначать методы лечения, которые могут быть основаны на доклинических данных in vitro или ограниченных клинических результатах [12].
Гидроксихлорохин
Вышесказанное в первую очередь относится к гидроксихлорохину (ГХ). Подоплека «воодушевления» была обусловлена активностью препарата in vitro против SARS-Cov-2 наряду с данными незначительного по объему неконтролируемого исследования, выполненного в Китае. ГХ, обладающий антивирусными и иммуномодулирующими свойствами, широко позиционировался как терапевтическое и/или профилактическое средство от COVID-19. Возникший в результате ажиотажный спрос на ГХ существенно сократил предложение, что отразилось на больных ИВРЗ (прежде всего ревматоидным артритом и системной красной волчанкой (СКВ)), которые успешно применяли этот препарат на протяжении десятилетий. Однако по мере того, как увеличивались размеры и требования к проведению наблюдательных исследований, данные становились все менее обнадеживающими. Неудивительно, что результаты рандомизированных клинических исследований (РКИ) совпали с отрицательными данными наблюдательных исследований [11].
Важно отметить, что, согласно результатам исследования RECOVERY, по сравнению со стандартной терапией добавление ГХ увеличило риск таких исходов, как дыхательная недостаточность с необходимостью искусственной вентиляции легких (ИВЛ) и смерть [13]. Кроме того, у получавших ГХ в составе комбинированной терапии, преимущественно в сочетании с азитромицином, отмечалась более высокая частота нежелательных явлений, чем при использовании стандартных схем лечения. Так, у пациентов с тяжелой формой COVID-19 на фоне применения ГХ зафиксировано удлинение интервала QT на электрокардиограмме, повышение уровня печеночных ферментов и более высокий риск смерти из-за сердечно-сосудистых осложнений [14].
В середине прошлого года возникла и широко обсуждалась идея применения ГХ как средства профилактики COVID-19, учитывая его относительно невысокую стоимость и хорошую переносимость при длительной терапии, в частности, ИВРЗ [15, 16]. Однако, по данным ряда авторов, позитивного или негативного влияния на течение COVID-19 у пациентов, страдавших ИВРЗ, на фоне лечения ГХ не наблюдалось. Так, A. Mathian и соавт. (2020 г.) представили информацию о 17 пациентах с СКВ, заболевших COVID-19, несмотря на длительный (медиана 7,5 года) прием ГХ. Вирусная пневмония была диагностирована у 13 (76%) больных, в том числе с осложнениями в виде дыхательной недостаточности у 11 (65%) и ОРДС у 5 (29%). Авторы сделали вывод об отсутствии профилактического эффекта ГХ в отношении COVID-19 у больных СКВ [17]. По данным M. Konig и соавт. (2020 г.), из 80 наблюдавшихся больных СКВ с COVID-19 аминохинолиновые препараты (гидроксихлорохин или хлорохин (ХЛ)) до заражения SARS-CoV-2 получали 64%. При этом частота госпитализаций по поводу COVID-19 не различалась между использовавшими ХЛ/ГХ и не принимавшими их – 55 и 57% соответственно [18].
Был выполнен ряд РКИ, в которых оценивалась возможность применения ГХ для постконтактной профилактики COVID-19 в надежде на то, что этот доступный и недорогой препарат сможет помочь на ранних стадиях заболевания и предотвратить госпитализацию. В исследование, выполненное сотрудниками Университета штата Миннесота, был включен 821 человек старше 18 лет без симптомов заболевания, но контактировавших с больными COVID-19 на расстоянии менее 6 футов (1,83 м) более 10 минут. Из них 87,6% (719/821) относились к группе высокого риска заражения (на момент контакта были без маски и средств защиты для глаз), остальные – к группе среднего риска (в маске, но без средств защиты для глаз). В течение четырех дней после контакта участники были рандомизированы на группы плацебо (n = 407) или ГХ в виде таблеток по 200 мг (n = 414). Режим применения ГХ – 800 мг однократно, затем 600 мг через 6–8 часов и далее по 600 мг ежедневно в течение четырех дней. Общая продолжительность терапии составила пять дней. В течение 14 дней последующего наблюдения на основании результатов полимеразной цепной реакции или клинических признаков диагноз COVID-19 был поставлен 13% (107) исследуемых. Данный показатель значимо не отличался в группах ГХ и плацебо – 11,8 и 14,3% при 95%-ном доверительном интервале (ДИ) -7,0– -2,2 (p = 0,35). Медицинские работники заражались преимущественно от пациентов (76,7%), но не от сотрудников. В остальных случаях – от супругов/партнеров (46,5%) или родителей (17,6%). Нежелательные явления чаще отмечались в группе ГХ, чем в группе плацебо, – 40,1 против 16,8%. Наиболее частыми были тошнота, расстройство стула и дискомфорт в животе. Таким образом, эффективность ГХ для постконтактной профилактики COVID-19 оказалась не выше, чем у плацебо [19].
В ходе других РКИ также не получено доказательств эффективности ГХ в качестве средства предотвращения инфицирования SARS-CoV-2 после контакта с заболевшими [20, 21].
Несмотря на то что ГХ в качестве противовирусного средства не оправдал возлагавшихся на него надежд, он остается в арсенале ревматологов как основной противовоспалительный препарат при ряде ИВРЗ. Эксперты Американской коллегии ревматологов подчеркивают, что в контексте нехватки лекарств из-за COVID-19 следует избегать новых назначений ГХ по показаниям, не утвержденным Управлением по контролю качества пищевых продуктов и лекарственных средств (Food and Drug Administration – FDA) [22]. Учитывая благоприятные плейотропные эффекты ГХ, такие как антитромботический, гипогликемический, гиполипидемический [23], можно предположить, что применение этого препарата будет целесообразно у пациентов с COVID-19, имеющих клинико-лабораторные проявления коагулопатии в сочетании с аутоиммунными нарушениями (гиперпродукция антител к фосфолипидам) и коморбидной патологией (атеросклеротическое поражение сосудов, метаболический синдром и др.), а также при постковидном синдроме (post-COVID-19 syndrome).
Глюкокортикостероиды
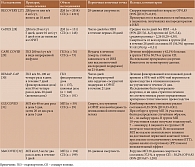
Глюкокортикостероиды (ГКС), обладающие широким спектром противовоспалительных и иммуномодулирующих эффектов, стали одной из первых групп препаратов, которые начали применять при COVID-19 [24, 25]. Однако в работе итальянских ученых, опубликованной в июне 2020 г., было отмечено, что из 117 пациентов с ревматической патологией и подтвержденным COVID-19 умерло 20 (10%), при этом 7 (58%) из них принимали более 30 мг преднизолона в день [26]. В то же время получены данные о положительном эффекте ГКС у больных COVID-19 (таблица) [27–32].
В исследовании RECOVERY показано, что применение дексаметазона (ДМ) в дозе 6 мг/сут в течение десяти дней у больных COVID-19 привело к значимому снижению частоты смертей у находившихся на ИВЛ (29,3 и 41,4%, относительный риск (ОР) 0,64 (95% ДИ 0,51–0,81)) и нуждавшихся в кислородной поддержке (23,3 и 26,2% (ОР 0,82 (95% ДИ 0,72–0,94)). Однако среди пациентов, у которых не было необходимости в оксигенации, различий в эффективности ДМ по сравнению с контролем не наблюдалось [27].
В ходе исследования CoDEX, в котором ДМ вводили внутривенно 299 пациентам в условиях отделения реанимации и интенсивной терапии (ОРИТ), установлено, что такая терапия ассоциировалась с увеличением количества дней без ИВЛ (р = 0,04) и более низким средним значением шкалы оценки органной недостаточности через семь дней (р = 0,004) по сравнению со стандартным лечением. Смертность от любых причин составила 53% в группе дексаметазона и 61,5% в группе стандартной терапии [28].
В двойном слепом РКИ MetCOVID добавление метилпреднизолона (МП) к стандартной терапии снизило 28-дневную смертность только у пациентов 60 лет и старше, но общего снижения смертности не наблюдалось [32].
Согласно результатам метаанализа, выполненного голландскими исследователями (44 исследования с участием 20 197 пациентов), ГКС способствовали снижению 28-дневной смертности и потребности в ИВЛ.
В то же время в отдельных работах обращали на себя внимание задержка клиренса SARS-CoV-2, что, вероятно, могло быть обусловлено преждевременным назначением ГКС (в период активной вирусной репликации), и возрастание числа вторичных инфекций [33].
Применение ГКС в фазу вирусной нагрузки, то есть в течение первых семи – десяти дней болезни, может повлечь усугубление последней с дальнейшим нарастанием интенсивности воспалительного ответа и выраженным ухудшением состояния.
Следовательно, ГКС могут оказывать как отрицательное, так и положительное влияние на разных стадиях SARS-CoV-2-инфекции, поражения легких и ОРДС [34].
Оптимальное время назначения, доза и продолжительность приема ГКС с точки зрения эффективности и безопасности остаются предметом дальнейших исследований. С учетом доступности ГКС как по цене, так и по наличию в аптечной сети указанная область исследований должна стать всеобщим приоритетом [33].
Тоцилизумаб
Применение тоцилизумаба (ТЦЗ) – моноклонального антитела к человеческому рецептору интерлейкина (ИЛ) 6 при COVID-19 имело определенный успех, преимущественно в открытых исследованиях и сериях наблюдений. Однако, по данным абсолютного большинства крупных РКИ и метаанализов, препарат практически не уменьшал частоту смертей [35–38]. Так, в РКИ COVACTA с участием пациентов, госпитализированных с тяжелой пневмонией, вызванной COVID-19, использование ТЦЗ не привело к значительному улучшению клинического статуса или более низкой смертности через 28 дней по сравнению с плацебо [39].
В ходе международного РКИ EMPACTA были изучены эффективность и безопасность ТЦЗ у 389 госпитализированных пациентов с пневмонией в рамках COVID-19, которым не проводили ИВЛ. У получавших ТЦЗ наблюдали значимое снижение риска перевода на ИВЛ или смерти по сравнению с принимавшими плацебо – 12,2 и 19,4% соответственно (ОР 0,56 (95% ДИ 0,33–0,97); р = 0,04). Однако показатели смертности между группами через 28 дней существенно не различались – 10,4 и 8,6% соответственно. Был сделан вывод, что у определенной части больных с COVID-19-пневмонией ТЦЗ снижает вероятность перевода на ИВЛ, но не уменьшает летальность [40].
В многоцентровое РКИ CORIMUNO-19 были включены пациенты с умеренной или тяжелой пневмонией в рамках COVID-19, которым требовалась кислородная поддержка в объеме как минимум 3 л/мин в отсутствие необходимости в ИВЛ или пребывания в ОРИТ. На 14-й день в группе ТЦЗ отмечено 33%-ное уменьшение частоты инвазивной/неинвазивной вентиляции легких или смертей. Однако показатели смертности на 28-й день в данной группе значимо не отличались от таковых в группе контроля, получавшей стандартную терапию [36].
В ретроспективном когортном исследовании у пациентов с тяжелой COVID-19-пневмонией, нуждавшихся в респираторной поддержке в условиях ОРИТ, российские ученые не выявили снижения смертности как при более раннем (до интубации), так и при позднем (после начала ИВЛ) введении ТЦЗ в дозе 400 мг по сравнению со стандартной терапией [41].
При ретроспективном анализе медицинской документации 5776 больных из электронной медицинской базы данных Northwell Health, крупнейшей частной некоммерческой системы здравоохранения в штате Нью-Йорк, установлено, что у получавших комбинацию ГКС и ТЦЗ была более низкая смертность по сравнению с получавшими лечение согласно стандарту (ОР 0,44 (95% ДИ 0,35–0,55); р < 0,0001), только ГКС (ОР 0,66 (95% ДИ 0,53–0,83); p = 0,004) или ГКС в сочетании с анакинрой (ОР 0,64 (95% ДИ 0,50–0,81); p = 0,003) [42].
Таким образом, поиск места ТЦЗ в алгоритме лечения COVID-19 продолжается. Необходимо проведение новых РКИ для определения профиля пациента и четких показаний для применения ТЦЗ при COVID-19.
Ингибиторы интерлейкина 1
Предполагается, что помимо ИЛ-6 важную роль в патогенезе воспаления при COVID-19 играет ИЛ-1. На этом основании были предприняты попытки лечения тяжелых и находящихся в критическом состоянии больных COVID-19 с помощью анакинры – рекомбинантного антагониста человеческого рецептора ИЛ-1.
При проведении метаанализа нерандомизированных когортных исследований с участием 184 больных показано, что смертность в группе анакинры была значимо ниже, чем в контрольной группе, – 10 и 41% соответственно (p < 0,0001). Более того, при лечении анакинрой риск потребности в ИВЛ также был значимо ниже – 16 и 36% соответственно (p = 0,008) [43].
В то же время многоцентровое открытое исследование CORIMUNO-ANA-1, в котором сопоставляли лечение анакинрой со стандартной терапией у пациентов с пневмонией легкой и средней степени тяжести в рамках COVID-19, было прекращено досрочно Комитетом по мониторингу данных в отсутствие положительного эффекта при этапном анализе результатов 116 пациентов (59 получали анакинру, 57 – стандартное лечение). Не выявлено значимых различий между группами в отношении четырехдневного улучшения, частоты потребности в вентиляции легких или смертей в течение двух недель, что позволило предположить отсутствие положительной динамики при лечении анакинрой указанной категории больных COVID-19 [44]. Позже данное исследование подверглось критике за критерии включения, в которые не вошли параметры, указывающие на гипервоспаление. В целом, как полагают датские исследователи, ингибирование ИЛ-1 обоснованно у отдельных пациентов с COVID-19 и явными доказательствами гипервоспаления [45].
Барицитиниб
Препарат барицитиниб (БАРИ) – ингибитор янускиназ 1-го и 2-го типов, обладающий противовоспалительным действием, в начале 2020 г. привлек внимание исследователей в связи со способностью подавлять активность определенных ферментов (AP-2-ассоциированной протеинкиназы и циклин-G-ассоциированной киназы), регулирующих процесс рецептор-опосредованного эндоцитоза, то есть основного пути проникновения SARS-CoV-2 в клетки-мишени. Помимо этого минимальное взаимодействие БАРИ с ферментами семейства P450 позволяло применять его в сочетании с такими противовирусными препаратами, как лопинавир/ритонавир и ремдесивир. В ноябре 2020 г. FDA выдало разрешение на экстренное применение БАРИ в сочетании с ремдесивиром для лечения предполагаемого или лабораторно верифицированного COVID-19 у госпитализированных взрослых и детей в возрасте двух лет и старше, которым требовались дополнительная оксигенация, ИВЛ или экстракорпоральная мембранная оксигенация. Данное решение FDA базировалось на результатах РКИ ACTT-2, проведенного Национальным институтом аллергии и инфекционных заболеваний (США) и включавшего 1033 пациента с умеренным или тяжелым COVID-19. 515 пациентов (первая группа) получали БАРИ (4 мг/сут в течение 14 дней) плюс ремдесивир, 518 больных (вторая группа) – плацебо плюс ремдесивир. Длительность наблюдения составила 29 дней. Под выздоровлением понималось состояние пациента, когда он был готов к выписке (не нуждался в дополнительном кислороде или постоянном медицинском наблюдении) или уже выписан из стационара к концу срока наблюдения. Медиана времени, необходимого для выздоровления, составила семь дней в первой группе и восемь во второй (р = 0,04). Кроме того, в первой группе к 15-му дню лечения отмечено 30%-ное увеличение вероятности улучшения клинического статуса по восьмибалльной ординальной шкале (р = 0,04). Частота смертей в обеих группах значимо не различалась – 5,1 и 7,8% соответственно (р = 0,09). Однако риск ухудшения состояния вплоть до перевода на ИВЛ или смерти на 29-й день был ниже в первой группе (ОР 0,77 (95% ДИ 0,60–0,98)) [46].
В то же время, как подчеркивают эксперты FDA, вышеуказанный регуляторный вердикт вынесен в рамках процедуры экстренного разрешения, но не полноценного одобрения. Статус экстренного разрешения означает более широкое внедрение указанной комбинации препаратов в клиническую практику, при этом доказательная база их эффективности по-прежнему остается неполной, что не позволяет выносить безоговорочно положительное решение в пользу их применения при COVID-19. Поэтому БАРИ не одобрен в качестве самостоятельного средства для лечения COVID-19. Изучение безопасности и эффективности этого метода экспериментальной терапии COVID-19 продолжается [47].
Антикомплементарная терапия
Активация комплемента может быть одним из механизмов тромбовоспаления и гиперкоагуляции на фоне инфекции SARS-CoV-2, что сближает COVID-19 с другими тромботическими микроангиопатиями, в том числе развивающимися при СКВ и антифосфолипидном синдроме. Недавно внедренный в клиническую практику препарат экулизумаб подавляет терминальную активность комплемента человека, обладая высокой аффинностью с его С5-компонентом. Как следствие, полностью блокируется расщепление компонента С5 на С5а и С5b и образование терминального комплекса комплемента С5b-9.
В ходе наблюдательного исследования с участием 80 больных COVID-19, находившихся в ОРИТ, лечение экулизумабом (n = 35) привело к значимому снижению смертности на 28-й день по сравнению со стандартным лечением – 51,1 и 80,0% соответственно (р = 0,04). Изменение лабораторных показателей и биомаркеров на фоне терапии экулизумабом свидетельствовало об инактивации компонентов комплемента, уменьшении гипоксии и воспаления [48].
Исследование PANAMO, выполненное в рамках фазы II изучения другого ингибитора C5a – вилобелимаба, применявшегося у пациентов с тяжелыми формами COVID-19, также выявило тенденцию к уменьшению потребности в кислороде, количества смертей на 28-й день и тяжелых легочных эмболий по сравнению с поддерживающей терапией [49].
Следовательно, антикомплементарная терапия может иметь двойное преимущество – как в лечении воспалительного процесса, так и в снижении тромбоэмболического риска у пациентов с COVID-19. Поэтому подчеркивается необходимость срочного поиска биомаркеров, позволяющих определять пациентов для этой сложной терапии [45].
Колхицин
Колхицин обладает мощным противовоспалительным действием за счет ингибирования инфламмасомы NLRP3 и тем самым подавления высвобождения ИЛ-1β, ИЛ-18, в дальнейшем и ИЛ-6.
В открытом нерандомизированном исследовании пациентов, госпитализированных с COVID-19, более высокая выживаемость на 21-й день отмечена среди получавших колхицин (n = 122) по сравнению с находившимися на стандартной терапии (n = 140) – 84,2 и 63,6% соответственно (p = 0,001).
При многофакторном анализе лечение колхицином было значимо связано со снижением смертности (ОР 0,15 (95% ДИ 0,06–0,37)), хотя имелись заметные ограничения, в частности дисбаланс в использовании ГКС между группами (пациенты, принимавшие колхицин, получали большее количество ГКС) и отсутствие четкой информации о времени, прошедшем от появления симптомов до применения колхицина [50].
В январе 2021 г. в форме препринта были опубликованы результаты РКИ COLCORONA, включавшего 4488 амбулаторных пациентов с COVID-19. Авторы отметили снижение риска госпитализаций или смерти у получавших колхицин (0,5 мг два раза в день в течение трех дней и в дальнейшем один раз в день в течение 30 дней), которое, однако, не было статистически значимым, – 4,7% в группе колхицина и 5,8% в группе плацебо (ОР 0,79 (95% ДИ 0,61–1,03)). О серьезных нежелательных явлениях сообщалось у 4,9 и 6,3% больных в группах колхицина и плацебо соответственно (р = 0,05). Общая смертность в этой амбулаторной когорте была очень низкой – 0,2% в группе колхицина и 0,4% в группе плацебо (ОР 0,56 (95% ДИ 0,19–1,66)) [51].
В целом потенциальное преимущество колхицина в отношении COVID-19 остается неясным.
Заключение
COVID-19 явился серьезным вызовом человечеству и беспрецедентной возможностью составить представление о реальных достижениях современной биологии и медицины. Развитие COVID-19-ассоциированного гипервоспалительного синдрома послужило основанием для репозиционирования препаратов, применяющихся для лечения ИВРЗ. Вместе с тем в рамках рассматриваемой темы еще существует круг проблем, требующих дальнейших исследований. К ним относятся:
- расшифровка механизмов и поиск биомаркеров гетерогенности COVID-19-ассоциированного гипервоспалительного синдрома с целью персонификации противовоспалительной терапии;
- подбор оптимальных доз, времени начала и продолжительности противовоспалительной терапии;
- изучение эффективности комбинированной (с противовирусными препаратами) и эскалационной терапии таргетными противовоспалительными препаратами;
- прогнозирование риска осложнений, связанных с бактериальной инфекцией.
В целом можно надеяться, что усилия ученых и врачей всего мира не только позволят улучшить прогноз при COVID-19 и получить новые знания для успешной борьбы с эпидемиями вирусных инфекций в будущем, но и будут способствовать совершенствованию фармакотерапии широко распространенных ИВРЗ [52].
B.S. Belov, MD, PhD, N.V. Muravyova, PhD, Ye.S. Aronova, PhD, M.A. Litvinova
V.A. Nasonova Research Institute of Rheumatology
Contact person: Boris S. Belov, belovbor@yandex.ru
Despite the progress in studying the mechanisms of COVID-19 development, the disease pathogenesis is completely unclear.
Violation of cytokines regulation and hyper inflammation (cytokine storm) served as the basis for the repositioning and the use for unregistered indications of a wide range of drugs that were developed for the treatment of immuno-inflammatory rheumatic diseases. Although a huge number of clinical studies of these drugs have been conducted, many problems remain unsolved, in particular, the development of real and cost-effective methods of treating patients who are most at risk of developing hyperinflammation and associated severe outcomes.
The article analyzes the results of anti-inflammatory drugs use in patients with COVID-19.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.