Можно ли говорить о смене парадигмы при лечении хронического гепатита C?
- Аннотация
- Статья
- Ссылки
- English


Введение
Проблема хронического гепатита С (ХГС) остается актуальной из-за высокой заболеваемости и отсутствия вакцин против вируса гепатита C (hepatitis C virus, HCV). Кроме того, HCV-инфекция – наиболее частая причина развития цирроза печени (ЦП), гепатоцеллюлярной карциномы, а также одна из основных причин трансплантации печени. Заболевания, ассоциированные с HCV-инфекцией, часто становятся основанием для госпитализации. Так, доля пациентов, госпитализированных в отделение гепатологии Центрального научно-исследовательского института гастроэнтерологии с заболеваниями, ассоциированными с HCV-инфекцией (ХГС и ЦП), в 2011–2013 гг., составила 20–25%.
За последние годы взгляды на противовирусную терапию (ПВТ) ХГС существенно изменились. Применение комбинированной (двойной) терапии пегилированным интерфероном альфа (ПЭГ-ИФН-альфа) и рибавирином в клинической практике позволило значительно улучшить результаты лечения: при генотипе 1 достижение устойчивого вирусологического ответа (УВО) отмечалось в 45–50% случаев. Между тем многие специалисты не сочли такие результаты удовлетворительными, тем более что длительность терапии составляла 48 недель, а весь период лечения сопровождался широким спектром нежелательных явлений (НЯ).
2011 г. ознаменовался появлением прямых противовирусных агентов (direct-acting antiviral, DAA). В 2011 г. FDA (Food and Drug Administration – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) и ЕМА (European Medicines Agency – Европейское медицинское агентство) одобрили для клинического применения первые препараты прямого противовирусного действия – телапревир и боцепревир для лечения ХГС у больных, инфицированных HCV генотипа 1, в 2014 г. – симепревир, софосбувир и даклатасвир. Три последних препарата можно использовать в комбинациях для безинтерфероновых схем ПВТ, а софосбувир и даклатасвир являются еще и препаратами выбора у пациентов с генотипами 2 и 3. В России телапревир зарегистрирован в 2012 г., боцепревир – в 2013 г., симепревир – в феврале 2014 г. Остальные препараты находятся в стадии регистрации.
Что изменилось с внедрением в клиническую практику DAA?
Двойная комбинированная терапия ПЭГ-ИФН-альфа и рибавирином перестала считаться стандартом лечения HCV при генотипе 1. Именно с этого момента стандартной при генотипе 1 HCV стала тройная ПВТ, обязательным компонентом которой считается один из ингибиторов протеазы первого поколения (табл. 1) в сочетании с ПЭГ-ИФН-альфа и рибавирином.
Вместе с тем при генотипе 3 HCV двойная терапия оставалась стандартом лечения (в России таковой остается и теперь).
В ходе рандомизированных клинических исследований стало понятно, что тройная терапия с применением DAA (ингибиторов протеазы первого поколения) не только достоверно более эффективна для пациентов с генотипом 1 HCV. Это единственная альтернатива для пациентов с неэффективной предшествующей двойной ПВТ.
Любопытно, что опыт применения тройной терапии в российской популяции был более успешным, чем в европейской или американской [1]. Так, частота достижения УВО в российской популяции у пациентов с выраженным фиброзом или циррозом, включенных в программу раннего доступа ПВТ с применением телапревира, составила:
-
у пациентов, ранее не получавших лечения, – 82%;
-
пациентов с рецидивом – 96%;
-
пациентов с «нулевым» ответом – 67%.
Высокая эффективность, по мнению авторов, обусловлена тем, что подавляющее большинство пациентов в российской выборке имели генотип 1b, при котором применение ингибиторов протеазы эффективнее, чем при генотипе 1а.
Между тем применение ингибиторов протеазы первого поколения сопровождалось достаточно агрессивными НЯ (анемия, кожный зуд, сыпь и др.). Это не послужило поводом к отмене препаратов, особенно у «трудных» пациентов. В то же время наличие НЯ у данной группы препаратов позволило отказаться от них, как только появились ингибиторы протеазы второго поколения, а также DAA других классов. В настоящее время хорошо известны отличия ингибиторов протеазы первого и второго поколения, их преимущества и недостатки, а также алгоритмы применения [2, 3].
Безусловно, процесс совершенствования схем ПВТ направлен на повышение эффективности и улучшение профиля безопасности. Очевидно, что идеальной схемой может быть комбинация, предусматривающая пероральный прием препаратов и не включающая интерфероны, что практически решило бы проблему побочных эффектов (если НЯ развиваются, это не влияет на переносимость ПВТ), исключающая взаимодействие с большинством лекарственных препаратов, используемых при сопутствующих заболеваниях. Кроме того, идеальной считается схема с одно- или двукратным суточным режимом приема и минимальной по длительности терапии (8/12/24 недели), высокой эффективностью (близкой к 100%) независимо от исходных характеристик пациента.
Несмотря на доступность данных о новых подходах к лечению ХГС, вопрос доведения информации до врачей, занимающихся лечением пациентов данной категории, а также врачей других специальностей остается нерешенным. Проведенное нами анкетирование по оценке информирования гепатологов, гастроэнтерологов, инфекционистов, терапевтов, хирургов и врачей других специальностей показало достаточно низкий уровень осведомленности даже по базовым вопросам диагностики и лечения ХГС, не говоря уже о таких вопросах, как безинтерфероновая терапия, коррекция НЯ [4].
Итак, возвращаясь к идеальной схеме лечения ХГС, можно с уверенностью сказать, что прообразом такой схемы на данном этапе можно считать так называемую 3D-терапию. Возникает вопрос: является ли комбинация нескольких препаратов DAA c разным механизмом действия, как в случае 3D-терапии, новой парадигмой в лечении пациентов ХГС? Найден ли оптимальный рецепт лечения ХГС?
Общие положения
Что означает понятие 3D-терапии? Видимо, это пример удачного использования англицизма 3D (от англ. 3-dimensional – трехмерный), который применяется к пространству, звуку, используется в современных компьютерных технологиях и означает эффект стереоскопии. 3D-терапия предполагает одновременное применение трех препаратов прямого антивирусного действия (паритапревир, дасабувир, омбитасвир (фармацевтическая компания AbbVie)), которые в настоящее время уже прошли клинические исследования и находятся в стадии регистрации. На самом деле схема 3D-терапии включает не три, а пять препаратов. Кроме названных трех это еще ритонавир (известный ингибитор протеазы ВИЧ-1 и ВИЧ-2; в данном случае используется для фармакокинетического усиления эффекта паритапревира без увеличения дозы последнего) и хорошо известный по двойной терапии нуклеозидный аналог рибавирин.
Отметим, что это первая и пока единственная тройная комбинация, эффективность и безопасность которой подтверждена с позиции стандарта GCP (Good Clinical Practice – надлежащая клиническая практика) и которая успешно сочетает представителей всех классов существующих DAA c разным механизмом действия для получения максимального эффекта.
Эффективность и безопасность 3D-терапии: краткий обзор
Одним из первых в рамках программы клинических испытаний схемы 3D стало исследование фазы II AVIATOR (n = 571) с использованием 12- и 24-недельного режима различных комбинаций ABT-450 (паритапревир)/ритонавир, ABT-267 (омбитасвир), ABT-333 (дасабувир) в сочетании с рибавирином (или без него). В исследовании участвовали больные с генотипом 1 HCV, как не получавшие ранее лечения, так и с неудачным опытом предшествующей терапии (нон-респондеры). Целью работы было определение оптимальной комбинации и длительности терапии. Как показал анализ полученных данных, и у пациентов, ранее не получавших лечения, и у нон-респондеров оптимальной была 12-недельная комбинация ABT-450 (паритапревир)/ритонавир, ABT-267 (омбитасвир), ABT-333 (дасабувир) с рибавирином. Эффективность составила 98,7 и 93,3% соответственно. Важный момент: на эффективность лечения не влияли известные по опыту двойной и тройной терапии предикторы УВО. 3D-терапия была высокоэффективной независимо от предыдущего опыта лечения, пола, субтипа HCV, ИЛ-28В, вирусной нагрузки и стадии фиброза [5].
Не менее важным стало доказательство абсолютно благоприятного профиля безопасности: частота НЯ, из-за которых лечение было приостановлено, составила менее 2% (при этом у пациентов, прервавших терапию, был достигнут УВО).
На основании полученных результатов были предложены, а затем реализованы несколько исследований фазы III длительностью 12 недель (SAPPHIRE-I и II, PEARL-II, III и IV, TURQUOISE-I и II). В итоге было проведено семь клинических исследований в 25 странах с участием 2300 пациентов. У каждого исследования были свои задачи. Так, в SAPPHIRE-I были включены только пациенты, ранее не получавшие лечения [6], в SAPPHIRE-II – только нон-респондеры [7]. При этом в обоих исследованиях схема лечения была представлена комбинацией 3D-терапии и рибавирина, а критерием исключения стало наличие ЦП.
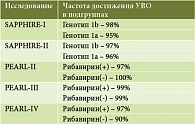
В ходе исследований PEARL сравнивали влияние рибавирина на эффективность 3D-терапии. В PEARL-II участвовали только нон-респондеры с генотипом 1b [8], в PEARL-III – только пациенты с генотипом 1b, ранее не получавшие лечения [9], в PEARL-IV – только пациенты с генотипом 1а, ранее не получавшие лечения [9]. В исследования не включались пациенты с ЦП. Результаты превзошли все ожидания [6–9] (табл. 2).
Таким образом, у пациентов с ХГС с вариантом подтипа, который в подавляющем большинстве встречается в России (генотип 1b), эффективность 12-недельного курса лечения достигла 97–100%.
Наконец, исследования TURQUOISE-I и TURQUOISE-II были посвящены особым категориям пациентов. Целью этих исследований стала оценка эффективности терапии у пациентов с ЦП (TURQUOISE-II) в зависимости от длительности лечения (12 или 24 недели) и опыта предшествующей терапии, а также при ко-инфекции ВИЧ (TURQUOISE-I).
Обратите внимание: TURQUOISE-II в настоящее время считается самым масштабным исследованием фазы III, посвященным оценке эффективности безинтерфероновой комбинации ПВТ у больных с ЦП (n = 380). Как показали результаты данного исследования, у больных с компенсированным ЦП независимо от длительности лечения, субтипа, опыта предшествующей терапии частота УВО превысила 90% (табл. 3) [10]. У более сложной категории пациентов с предшествующим опытом ПВТ – с «нулевым» ответом эффективность составила 100% (для субтипа 1b). Это указывает на возможности 3D-терапии у больных, у которых не было таких высоких результатов на фоне применения DAA.
Более подробный анализ в подгруппах позволяет сделать несколько выводов.
Во-первых, максимальной эффективности у пациентов с ЦП можно достичь при 24-недельном курсе 3D-терапии в комбинации с рибавирином. Это актуально прежде всего для пациентов с субтипом 1а ХГС. Для пациентов с субтипом 1b достаточно 12-недельного курса, эффективность которого составляет 98,5%.
Во-вторых, исходные уровни тромбоцитов менее 100 000/мкл и альбумина менее 35 г/л могут служить предикторами сниженного ответа на терапию. Но даже при таких показателях в группах частота УВО при 24-недельном курсе составила 97 и 88,9% соответственно [11].
В-третьих, анализ возникновения НЯ позволяет подтвердить ранее полученные данные о благоприятном профиле безопасности: частота НЯ, приведших к отмене лечения, составила 1,9 и 2,3% при 12- и 24-недельной длительности терапии. Декомпенсация отмечалась у четверых (1,1%) больных, что не было связано с лечением. Кроме того, развитие и спектр НЯ в большинстве случаев могут быть связаны с рибавирин-индуцированной анемией [7].
Наконец, еще одна группа, продемонстрировавшая высокую эффективность и безопасность лечения, – реципиенты трансплантата печени с рецидивом HCV генотипа 1. Анализ данных исследования M12-999 (CORAL I) эффективности лечения у данной категории больных показал, что в результате 24-недельного курса 3D-терапии частота УВО-12 составила 97%. Отмечалась хорошая переносимость терапии пациентами: зарегистрировано только два случая развития серьезных НЯ, терапия отменена в одном случае, не было ни одного случая отторжения трансплантата [12, 13].
Заключение
В течение ближайшего времени тройная терапия с применением ингибиторов протеазы останется актуальной у пациентов с генотипом 1 HCV. Однако уже сейчас понятно, что применение интерферонов у «трудных» пациентов (ЦП, «нулевой» ответ на предшествующую двойную терапию, пациенты с рецидивом после трансплантации и др.) сопряжено с риском декомпенсации, недостаточно высокой эффективностью. Проблему можно решить за счет применения безинтерфероновых схем, прежде всего 3D-терапии. Такие схемы отличаются почти 100%-ной эффективностью, хорошим профилем безопасности, отсутствием перекрестной резистентности, удобным режимом приема. Это и есть новая эра ПВТ, смена парадигмы лечения ХГС.
Все чаще лечащий врач будет откладывать терапию, содержащую интерфероны, не только из-за предполагаемой неэффективности или агрессивности. Скоро в клиническую практику будут внедрены схемы терапии, которые позволят добиться эрадикации HCV-инфекции у каждого пациента.
I.G. Bakulin
Moscow Clinical Research and Practical Center of the Moscow Healthcare Department
Moscow State University of Food Production
Contact person: Igor Gennadyevich Bakulin, igbakulin@yandex.ru
The article represents an overview of actual clinical trials of interferon-free 3D-regimen in patients with genotype 1 of chronic hepatitis C. The article contains analysis of 3D-regimen efficacy and safety with respect
to the baseline characteristics of studied patients population.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.