«Дорожная карта» препарата Диабетон МВ
- Аннотация
- Статья
- Ссылки
- English
В настоящее время установлено, что Диабетон МВ помимо сахароснижающего оказывает дозозависимое нейтрализующее воздействие на свободные радикалы. Нейтрализация свободных радикалов препятствует денатурации белков и липидов. Как следствие, предотвращается развитие сердечно-сосудистых осложнений сахарного диабета.
В настоящее время установлено, что Диабетон МВ помимо сахароснижающего оказывает дозозависимое нейтрализующее воздействие на свободные радикалы. Нейтрализация свободных радикалов препятствует денатурации белков и липидов. Как следствие, предотвращается развитие сердечно-сосудистых осложнений сахарного диабета.




Введение
Современные препараты из группы производных сульфонилмочевины (ПСМ) остаются актуальными фармакотерапевтическими опциями при разной степени декомпенсации углеводного обмена и могут быть рекомендованы как в виде монотерапии, так и в виде комбинации с метформином, инсулином и инкретинами [1].
Различия между ПСМ определяются фармакокинетическими и фармакодинамическими свойствами. В первом случае речь идет о скорости и полноте абсорбции, периоде полувыведения, метаболизме (печеночный и почечный) и способе выведения. Во втором – о характере взаимодействия (обратимость, селективность) с АТФ-зависимыми калиевыми (K+) каналами бета-клеток поджелудочной железы, наличии и спектре плейотропных эффектов [2, 3].
Спектр отличительных признаков препаратов позволяет реализовать персонифицированный подход к лечению пациентов с сахарным диабетом (СД) 2 типа.
В этой связи представляется целесообразным проанализировать препарат начиная с активной молекулы до оказываемого терапевтического эффекта. Данный анализ, так называемая дорожная карта, состоит из четырех последовательных этапов: фармацевтического, фармакокинетического, фармакодинамического и терапевтического.
«Дорожную карту» системного гликлазида рассмотрим на примере Диабетона МВ 60 мг.
Фармацевтический этап
Фармацевтический этап объединяет анализ процессов, связанных с модифицированным высвобождением (МВ) активного вещества из лекарственной формы.
Активное вещество Диабетона МВ находится в растворимом гидрофильном матриксе. Равномерное распределение гранул матриксного агента в таблетке обеспечивает управляемое растворение [4, 5]. Растворение таблетки монолитной матриксной системы представлено на рис. 1.
Постепенное пролонгированное (в течение 24 часов) контролируемое высвобождение гликлазида также достигается благодаря гипромеллозе, входящей в состав гидрофильного матрикса таблетки Диабетона МВ. В желудочно-кишечном тракте высокомолекулярные полимерные волокна гипромеллозы впитывают жидкость и трансформируются в гель, из которого затем высвобождается активное вещество.
Инновационным технологическим решением стала делимость таблетки Диабетона МВ 60 мг. Известно, что препараты модифицированного высвобождения, как правило, покрыты оболочкой, их нельзя разделить. Поэтому их принимают целиком, не разжевывая. Кинетика диспергирования и растворения матриксной таблетки без оболочки напрямую зависит от площади ее поверхности, которая изменяется при делении. Так, площадь поверхности таблетки (рис. 2) увеличивается при разделении ее на две части, еще более существенно – при добавлении площади на изломе каждой из половин (см. рис. 2).
Чтобы профиль растворения разломанной таблетки был аналогичен таковому целой таблетки, надо минимизировать площадь на изломе. Это обеспечивается за счет овальной/капсуловидной формы, нанесения риски с двух сторон. Кроме того, область разлома должна быть защищена от растворения. Сказанное выше стало основанием для разработки делимой таблетки.
Благодаря делимости таблетки Диабетона МВ у большинства пациентов можно повысить дозу до максимальной путем пошагового титрования (30 60 90 120 мг) [1].
Диабетон МВ принимают один раз в сутки во время завтрака вне зависимости от суммарной дозы (30–120 мг, или половина – две таблетки) в один прием.
Модифицированное высвобождение обеспечивает такие важные клинические преимущества, как эффективный контроль гликемии с низкой частотой гипогликемий и низким риском развития ночной гипогликемии.
Фармакокинетический этап
С появлением свободных/не связанных с лекарственной формой молекул гликлазида начинается второй, фармакокинетический этап.
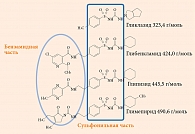
По химической структуре ПСМ представляют собой амфифильные молекулы (рис. 3). Поэтому они абсорбируются в тонкой кишке путем простой диффузии. Молекула гликлазида в отличие от молекул других ПСМ имеет самую низкую массу – 323,4 г/моль, что облегчает прохождение через энтероциты и, как следствие, всасывание. В частности, биодоступность препарата Диабетон МВ составляет 96,7%. Особенности химического строения ПСМ – размер и масса молекулы, полярность, липофильные качества, химически активные группировки обусловливают индивидуальный не только фармакокинетический, но и фармакодинамический профиль препаратов. В частности, у ПСМ есть общий домен (сульфонильная часть), определяющий их способность связывать рецептор сульфонилмочевины 1 (SUR-1) на мембране бета-клеток поджелудочной железы (см. рис. 3), а также бензамидная часть. За счет дополнительного гидрофобного взаимодействия с рецепторами время полудиссоциации глимепирида и глибенкламида в отличие от гликлазида увеличивается [6].
Обратимый характер связывания гликлазида с SUR-1 обеспечивает низкий риск гипогликемий. Напротив, низкая скорость диссоциации комплекса «ПСМ – рецептор» может определять высокий риск развития гипогликемий, увеличение массы тела, истощение и апоптоз бета-клеток [7].
После приема Диабетона МВ 60 мг концентрация в плазме крови увеличивается постепенно в течение шести часов, плато поддерживается от шести до 12 часов. Индивидуальная вариабельность низкая. Прием пищи на скорость или степень абсорбции гликлазида не влияет.
С белками плазмы связывается приблизительно 95% гликлазида.
Объем распределения – около 30 л.
Прием Диабетона МВ 60 мг один раз в сутки обеспечивает поддержание эффективной концентрации активного вещества в плазме крови более 24 часов.
Гликлазид метаболизируется преимущественно в печени. В отличие от глимепирида и глибенкламида не имеет циркулирующих активных метаболитов.
Гликлазид выводится преимущественно почками в виде метаболитов, менее 1% – в неизменном виде. Период полувыведения в среднем составляет от 12 до 20 часов.
Сказанное выше объясняет благоприятный фармакокинетический профиль Диабетона МВ: взаимосвязь между принятой дозой (до 120 мг) и площадью под фармакокинетической кривой «концентрация – время» является линейной [7].
Фармакодинамический этап
Фармакодинамический этап – распознавание и связывание активного вещества с мишенями, развитие фармакологического ответа.
Основная терапевтическая мишень ПСМ – SUR-1. Данный рецептор служит регуляторной субъединицей АТФ-зависимых К+-каналов на мембране бета-клеток поджелудочной железы. Образование комплекса «ПСМ – рецептор» приводит к закрытию каналов и снижению выхода ионов K+, что приводит к деполяризации мембраны и увеличению поступления ионов Ca2+ в клетку. Указанные процессы осуществляются с помощью потенциал-чувствительных механизмов. Это в свою очередь стимулирует экзоцитоз секреторных везикул инсулина [9].
Учитывая, что SUR представлены и в экстрапанкреатических тканях, в том числе кардиомиоцитах (SUR-2), селективность ПСМ к рецепторам очень важна (таблица). Для гликлазида характерна высокая селективность с SUR-l, соотношение «SUR-2/SUR-1» составляет практически 16 000 [8, 9]. Связывание ПСМ с SUR-2 клеток миокарда приводит к блокированию ишемического прекондиционирования, в условиях ишемии риск повреждения миокарда повышается, а также может увеличиться площадь инфаркта [10].
Молекулярные различия ПСМ также обусловливают различие механизмов стимуляции секреции инсулина. В отличие от гликлазида другие ПСМ способны находить и связывать в бета-клетках поджелудочной железы белок Epac2, митогенный фактор, стимулирующий экзоцитоз инсулина [11]. Следовательно, глибенкламид и глипизид наряду с электрогенным механизмом запускают Epac2-зависимый путь, что может приводить к истощению секреторной активности бета-клеток.
Обратимое связывание с SUR-1, высокий показатель селективности (SUR-1/SUR-2), электрогенный Epac2-независимый механизм регуляции секреции инсулина – все это в совокупности обеспечивает физиологическую секрецию инсулина на фоне применения гликлазида и снижение риска развития гипогликемий.
К фармакодинамическим преимуществам гликлазида МВ (Диабетона МВ) следует отнести непрямые, не связанные с воздействием на бета-клетки эффекты [12]. К таковым относятся эндотелий-протективное, антиоксидантное действие, повышение активности тканевого активатора плазминогена [10].
В настоящее время механизм антиоксидантного свойства гликлазида хорошо изучен. Кроме того, собрана доказательная база о его способности защищать сосудистый эндотелий от окислительного стресса [13–15].
Так, антиоксидантная активность гликлазида объясняется наличием N-содержащего гетероциклического кольца с эндоциклической связью. Данная структура захватывает активные формы кислорода (скавенджер-эффект) и определяет антиапоптотические свойства гликлазида, а также его способность уменьшать окисление липопротеинов низкой плотности [16, 17].
Терапевтический этап
Несмотря на появление инновационных классов сахароснижающих препаратов, производные сульфонилмочевины по-прежнему занимают лидирующие позиции, что обусловлено не только высокой эффективностью, но и низкой стоимостью. Однако безопасность такого лечения остается дискутабельной.
Необходимо отметить, что на данный момент времени под безопасностью антидиабетических препаратов подразумевается прежде всего низкий риск развития гипогликемий и сердечно-сосудистых осложнений. Требование к регистрации антидиабетических препаратов, согласно которому избыточный сердечно-сосудистый риск должен быть исключен, эксперты Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США и Европейского агентства лекарственных средств выдвинули в 2008 г. [18]. Производные сульфонилмочевины применяются более 60 лет, то есть до опубликования указанного требования. За эти годы было проведено немало рандомизированных контролируемых исследований сердечно-сосудистой безопасности данного класса препаратов у больных как с впервые выявленным СД 2 типа, так и с длительным течением патологии, с высоким и очень высоким сердечно-сосудистым риском. Одним из них было исследование UKPDS, длительность которого составила десять лет. В исследовании оценивалось влияние интенсивной терапии на развитие макро- и микрососудистых осложнений у лиц с впервые выявленным СД 2 типа [19, 20]. Пациенты были рандомизированы в группу обычного гликемического контроля с диетотерапией либо в группу интенсивного снижения гликемии с помощью ПСМ (хлорпропамид, глибенкламид, глипизид) или инсулина. Производные сульфонилмочевины и инсулин оказались сопоставимыми в отношении снижения риска микрососудистых осложнений. При этом ни бигуанид, ни сульфонилмочевина, ни инсулин не влияли на частоту развития макрососудистых заболеваний [19].
По завершении рандомизированной фазы исследования UKPDS наблюдение за пациентами продолжалось еще в течение десяти лет. Согласно полученным данным, в группе интенсивного контроля гликемии с помощью ПСМ или инсулина риск развития инфаркта миокарда был меньше на 15%, микрососудистого заболевания – на 24%, смерти от любой причины – на 13% [21].
В многоцентровом рандомизированном клиническом исследовании TOSCA.IT сравнивали эффективность двойной сахароснижающей терапии в отношении сердечно-сосудистых событий. Длительность исследования составила пять лет. В него были включены пациенты из 57 клиник Италии. Количество участников – 3028. Возраст больных – от 50 до 75 лет. Все они страдали СД 2 типа, который плохо контролировался на фоне метформина в дозе 2–3 г/сут. Пациенты случайным образом были распределены (1:1) и стратифицированы в зависимости от предшествующего сердечно-сосудистого события на две группы терапии. Одни получали дополнительно пиоглитазон 15–45 мг, другие – ПСМ (глибенкламид 5–15 мг, глимепирид 2–6 мг или гликлазид 30–120 мг (в соответствии с местной практикой)). В частности, глибенкламид применяли 2% пациентов, глимепирид – 48%, гликлазид – 50% больных. В качестве первичной конечной точки выбраны смерть от всех причин, нефатальный инфаркт миокарда, нефатальный инсульт или срочная реваскуляризация коронарной артерии [22]. Анализ результатов не показал достоверных различий между группами в достижении первичной конечной точки.
Особый интерес представляют результаты исследования ADVANCE [23]. Это крупномасштабное факториальное рандомизированное клиническое исследование, в котором изучались потенциальные преимущества более жесткого контроля глюкозы (с использованием гликлазида MB) перед обычным контролем, а также снижения артериального давления (с использованием фиксированной комбинации низких доз периндоприла и индапамида). Период наблюдения в среднем составил пять лет. В исследовании было предусмотрено два первичных исхода: составная макрососудистая конечная точка (нефатальный инсульт, нефатальный инфаркт миокарда, сердечно-сосудистая смерть) и составная микрососудистая конечная точка (развитие нефропатии или ухудшение ее течения, микрососудистое заболевание глаз). В гликемическую ветвь исследования ADVANCE в отличие от исследования UKPDS включали пациентов с СД 2 типа, длительность которого в среднем составляла восемь лет. 11 140 пациентов были рандомизированы на две группы сахароснижающей терапии. Группа жесткого контроля гликемии для достижения гликированного гемоглобина (HbA1c) ≤ 6,5% получала гликлазид МВ и любую другую дополнительную терапию. Группа обычного контроля применяла препараты в соответствии с местными рекомендациями. Если требовалось назначение ПСМ, использовали любой препарат данной группы, за исключением гликлазида. Результаты исследования ADVANCE продемонстрировали, что интенсивная стратегия лечения улучшала показатели микрососудистых исходов (особенно почечных). Кроме того, не отмечалось увеличения смертности.
Первичный исход наблюдался в 18,1% случаев в группе жесткого контроля, в 20,0% – в группе обычного контроля (p = 0,013). Однако интенсивная терапия не привела к достоверному снижению риска макрососудистых осложнений (относительный риск (ОР) 0,94, p = 0,32). Различие между группами по первичному исходу было связано главным образом с меньшим числом микрососудистых событий, в частности диабетической нефропатии. Частота последней снизилась приблизительно на 20%.
В исследовании ADVANCE был доказан благоприятный профиль безопасности Диабетона МВ у больных СД 2 типа с высоким и очень высоким риском развития сердечно-сосудистых заболеваний [16].
В продленной десятилетней фазе исследования ADVANCE – ADVANCE-ON была зафиксирована долгосрочная сердечно-сосудистая безопасность интенсивной терапии с применением Диабетона МВ. Кроме того, риск развития терминальной стадии хронической почечной недостаточности у получавших интенсивное лечение был на 46% меньше, чем в группе стандартного лечения (ОР 0,54, p < 0,01) [24, 25].
В датском исследовании Steno-2 пациенты с микроальбуминурией и высоким сердечно-сосудистым риском (n = 160) были рандомизированы на группы стандартного или интенсивного (поддержание уровня HbA1c < 6,5%) многофакторного вмешательства, включавшего метформин или гликлазид [26]. Частота событий сравнивалась с использованием регрессионной модели Кокса с поправкой на возраст и пол. За восемь лет наблюдения отмечено 118 сердечно-сосудистых событий: 85 – у 35 (44%) участников в группе стандартного лечения, 33 – у 19 (24%) в группе интенсивного лечения [27]. Кроме того, интенсивное многофакторное вмешательство у пациентов с СД 2 типа и микроальбуминурией способствовало снижению риска госпитализаций по поводу сердечной недостаточности на 70% в течение 21,2 года наблюдения.
Результаты исследований ADVANCE и Steno-2 также свидетельствовали о важности одномоментной интенсивной коррекции нескольких факторов риска – гипергликемии, артериальной гипертензии, микроальбуминурии. Однако компонент, который необходимо корректировать в первую очередь для снижения частоты возникновения диабетических осложнений, выявлен не был. Следует также учитывать, что в качестве пероральных сахароснижающих препаратов в исследовании Steno-2 использовали метформин и гликлазид [28].
В многочисленных обзорах и метаанализах контролируемых исследований также была доказана сердечно-сосудистая безопасность Диабетона МВ и глимепирида по сравнению с глибенкламидом [29, 30].
Следует подчеркнуть, что СД 2 типа относится к заболеваниям, время дебюта которых установить практически невозможно. Поэтому можно предположить, что гипергликемия оказывает влияние на организм в течение длительного периода – еще до установления диагноза, особенно у пациентов с исходно высоким уровнем HbA1c.
В двойном слепом рандомизированном контролируемом клиническом исследовании ADOPT у 4360 пациентов с недавно диагностированным СД 2 типа оценивали влияние росиглитазона, метформина и глибенкламида в виде монотерапии [31]. Через пять лет кумулятивная частота вторичной неэффективности терапии для метформина составила 21%, глибенкламида – 34%, росиглитазона – 15%. В то же время в исследовании ADVANCE получены данные о возможности контроля гликемии в течение пяти лет с достижением HbA1c ≤ 6,5% на фоне интенсивного лечения с использованием Диабетона МВ. Кроме того, четверо из пяти пациентов достигали уровня HbA1c ≤ 7% [23].
Одним из нежелательных явлений терапии ПСМ считается увеличение массы тела, что немаловажно для больных СД 2 типа. Большинство из них имеет избыточную массу тела или страдает ожирением. Последнее признано самым мощным модифицируемым фактором развития инсулинорезистентности. Действительно, в исследованиях, в которых в качестве монотерапии использовали ПСМ, наблюдалось повышение массы тела на 1,5–2,5 кг в год [32]. Так, в исследовании UKPDS у получавших монотерапию хлорпропамидом или глибенкламидом по сравнению с пациентами, находившимися на диетотерапии, масса тела увеличилась на 1,7–2,6 кг [19]. Однако через год применения препаратов сульфонилмочевины набор массы тела прекращался, через три-четыре года от начала терапии она стабилизировалась [33].
Согласно результатам исследования ADOPT, глибурид (глибенкламид) также приводил к увеличению веса в первый год лечения – плюс 1,6 кг [34]. В то же время в исследовании ADVANCE за период наблюдения в группе жесткого контроля гликемии по сравнению с группой обычного контроля масса тела увеличилась всего лишь на 0,7 кг (p < 0,001) [23]. Прибавка массы тела на фоне интенсивного лечения с применением гликлазида МВ была ничтожной – на 0,1 кг за пять лет [35]. В случае интенсификации терапии комбинацией ПСМ и метформина масса тела не увеличилась [36]. Кроме того, получены доказательства, что добавление к метформину препарата сульфонилмочевины не влияет на массу тела, добавление к сульфонилмочевине метформина способствует ее снижению на 1,5 кг. Аналогичная тенденция наблюдалась в исследовании TOSCA.IT, в котором использовали комбинацию метформина и сульфонилмочевины [22].
Другим нежелательным эффектом ПСМ считается гипогликемия. Однако в ряде многоцентровых сравнительных исследованиях показано, что в отношении риска развития гипогликемий между представителями данной группы препаратов существуют значимые различия. Как было отмечено ранее, они обусловлены избирательностью и обратимостью связывания с SUR-1 на бета-клетке [37–39].
Установлено, что длительно действующие препараты сульфонилмочевины, к которым относятся глибенкламид и глимепирид, к тому же образующие активные метаболиты, повышают риск пролонгированной и тяжелой гипогликемии, особенно у пожилых пациентов [40, 41]. Достоверно низкий риск гипогликемии продемонстрировали лишь глипизид и гликлазид. Данные препараты распадаются до неактивных метаболитов.
Так, гликлазид и глибенкламид оказались сопоставимыми в отношении снижения уровня HbA1c – от -0,66 до -0,84% при добавлении их к монотерапии метформином, однако первый вариант лечения ассоциировался с наименьшим риском гипогликемий любой степени (ОР 0,40 при 95%-ном доверительном интервале (ДИ) 0,13–1,27) [42]. Метаанализ частоты возникновения гипогликемий в рандомизированных клинических исследованиях с использованием ПСМ показал, что гипогликемия ≤ 3,1 ммоль/л развивалась у 10,1% (95% ДИ 7,3–13,8%) получавших любой препарат данной группы и лишь у 1,4% (95% ДИ 0,8–2,4%) принимавших гликлазид [39]. Согласно результатам данного метаанализа, тяжелая гипогликемия возникла у 0,8% (95% ДИ 0,5–1,3%) пациентов, применявших любой ПСМ, и лишь у 0,1% (95% ДИ 0,0–0,7%) – гликлазид. Данные других метаанализов рандомизированных клинических исследований подтвердили достоверно низкий риск гипогликемий у получавших гликлазид по сравнению с получавшими другие ПСМ (ОР 0,47 (95% ДИ 0,77–0,70), p = 0,004) [32].
В исследовании GUIDE также оценивали влияние глимепирида и гликлазида МВ на риск гипогликемий. Полученные результаты свидетельствуют о том, что на фоне приема гликлазида МВ частота эпизодов гипогликемий была примерно на 50% меньше, чем на фоне приема глимепирида [43].
Среди больных СД высока частота встречаемости почечной недостаточности, а также риск развития терминальной почечной недостаточности [44] и, следовательно, снижена скорость клубочковой фильтрации (СКФ). В связи с этим применение большинства антидиабетических препаратов лимитировано именно СКФ.
Возможность применения ПСМ также зависит от степени поражения почек [45]. Как было отмечено ранее, распад глибенкламида и глимепирида сопровождается образованием активных метаболитов, которые повышают риск гипогликемий по мере снижения СКФ. Поэтому использование глибенкламида должно быть ограничено пациентами с нормальной функцией почек или хронической почечной недостаточностью легкой степени (СКФ – 60–90 мл/мин/1,73 м2) [42]. Гликлазид и глипизид расщепляются до неактивных метаболитов, поэтому у пациентов с хронической почечной недостаточностью такая терапия ассоциируется с низким риском гипогликемий. Кроме того, описаны случаи применения этих препаратов при СКФ < 30 мл/мин/1,73 м2 при условии тщательного наблюдения за пациентами [46]. Прежде всего это относится к гликлазиду, который подобно ингибиторам дипептидилпептидазы 4-го типа можно использовать при хронической почечной недостаточности первой – третьей степени (СКФ > 30 мл/мин/1,73 м2) [42, 47].
В этой связи необходимо отметить, что в исследовании ADVANCE жесткий контроль гликемии с применением Диабетона МВ (титрация дозы до 120 мг) способствовал снижению риска развития микроальбуминурии на 9% (p = 0,01), макроальбуминурии на 30% (p < 0,001), возникновения или ухудшения нефропатии на 21% (p = 0,006), а также достижения терминальной стадии хронической почечной недостаточности на 65% (p = 0,02) [48]. Кроме того, эффективное снижение уровня глюкозы вследствие применения гликлазида МВ в 62% случаев привело к регрессу альбуминурии на одну стадию. У большинства пациентов была достигнута нормоальбуминурия. Преимущество интенсивной терапии с использованием гликлазида МВ в отношении снижения риска развития терминальной стадии хронической почечной недостаточности сохранялось как минимум десять лет [19].
Гликлазид МВ и его генерики
Несомненным преимуществом оригинальных препаратов является обширная доказательная база, полученная при проведении клинических исследований. В то же время использование качественных и более доступных, чем оригинальные препараты, генериков существенно сокращает расходы на лечение и одновременно способствует более широкому внедрению в клиническую практику современных алгоритмов лечения.
Согласно Федеральному закону от 22.12.2014 № 429-ФЗ «О внесении изменений в Федеральный закон „Об обращении лекарственных средств“», с 1 июля 2015 г. вместо термина «оригинальное лекарственное средство» следует использовать термин «референтный лекарственный препарат». Под таковым подразумевается лекарственный препарат, впервые зарегистрированный в Российской Федерации, качество, эффективность и безопасность которого доказаны на основании результатов доклинических и клинических исследований и который используется для оценки биоэквивалентности или терапевтической эквивалентности, качества, эффективности и безопасности воспроизведенного лекарственного препарата. Данным законом также введено понятие «взаимозаменяемый лекарственный препарат». Взаимозаменяемый лекарственный препарат – это препарат с доказанной терапевтической эквивалентностью или биоэквивалентностью референтному лекарственному препарату, имеющий эквивалентные ему качественный и количественный состав действующих веществ, состав вспомогательных веществ, лекарственную форму и способ введения.
Согласно данным Государственного реестра лекарственных средств, Диабетон МВ является референтным препаратом. Впервые на территории России он был зарегистрирован в 2009 г. (рис. 4) [49]. Его терапевтическая ценность определяется на основании доказанных в рандомизированных контролируемых клинических исследованиях эффективности и безопасности. Следует отметить, что при производстве препарата используется исходная фармацевтическая субстанция компании «Орил Индастри» [50], то есть именно то действующее вещество, в отношении которого были получены доказательства эффективности и безопасности.
Перед назначением воспроизведенного препарата необходимо получить информацию о его взаимозаменяемости. Согласно закону № 429-ФЗ, «информация о взаимозаменяемости лекарственного препарата подлежит включению в Государственный реестр лекарственных средств с 1 января 2018 г.». Исходя из данных регистрационного удостоверения, генерики гликлазида МВ не получили статуса «взаимозаменяемый препарат». В строке о взаимозаменяемости препаратов гликлазида МВ стоит отметка «Нет» (рис. 5).
Если, по данным Государственного реестра лекарственных средств, воспроизведенный препарат гликлазида МВ имеет статус взаимозаменяемого (рис. 6), следует обратить внимание на производителя фармацевтической субстанции (гликлазида). Таковыми являются три китайские компании. Определить конкретного производителя субстанции гликлазида в таблетке генерика на основании открытых доступных источников информации не представляется возможным.
Еще один фактор, который следует учитывать при сравнении референтного и воспроизведенных препаратов гликлазида МВ, – лекарственная форма.
Выше было отмечено преимущество лекарственной формы Диабетона МВ в виде делимой таблетки. Это двояковыпуклые, овальные таблетки с насечкой с двух сторон.
Информация о лекарственных формах разных препаратов гликлазида МВ представлена в инструкциях по их применению. Так, делимые таблетки генериков имеют либо круглую, плоскоцилиндрическую форму, либо круглую, двояковыпуклую и насечку с одной стороны.
Следовательно, при воспроизведении препаратов гликлазида МВ не учитывают особые требования, предъявляемые к делимой таблетке с модифицированным высвобождением на основе матриксной технологии.
Заключение
Медико-социальная значимость СД 2 типа обусловлена развитием хронических осложнений. В связи с этим остро стоит вопрос достижения целевых показателей гликемии. При выборе терапии следует учитывать не только индивидуальные особенности пациента, но и характеристики сахароснижающих препаратов. Поскольку СД 2 типа является эквивалентом сердечно-сосудистой патологии, у пациентов с сердечно-сосудистыми заболеваниями предпочтение следует отдавать препаратам с доказанным благоприятным влиянием на конечные сердечно-сосудистые точки.
В настоящее время в России для лечения СД применяют семь классов антидиабетических препаратов, как пероральных, так и инъекционных. Несмотря на внедрение в клиническую практику инновационных препаратов, производные сульфонилмочевины остаются препаратами второй и третьей линии. Это объясняется не только их эффективностью и безопасностью. К преимуществам препаратов данной группы также следует отнести простоту применения, возможность использования в комбинации с другими сахароснижающими средствами, низкую стоимость.
Группа ПСМ неоднородна, препараты различаются как по эффективности, так и по профилю безопасности.
«Дорожная карта» Диабетона МВ 60 мг свидетельствует о наличии важных отличительных свойств, включая матриксную систему модифицированного высвобождения активного вещества, делимость таблетки, обратимое и высоко избирательное связывание с SUR-1 клеток поджелудочной железы, выраженное антиоксидантное действие (скавенджер-эффект). Кроме того, во многих исследованиях доказаны сердечно-сосудистая безопасность, нефропротекция Диабетона МВ. Данный препарат ассоциируется с низким риском гипогликемий и нейтральным влиянием на массу тела.
A.M. Mkrtumyan, DM, PhD, Prof., A.S. Dukhanin, DM, PhD, Prof.
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
N.I. Pirogov Russian National Research Medical University
Contact person: Ashot Musaelovich Mkrtumyan, vagrashot@mail.ru
Discussed the features of Diabeton MR – from the active molecule to the therapeutic properties. Within the framework of pharmaceutical and pharmacokinetic analysis, the structure of the glyclazide molecule and the new form of the tablet – divisible, pharmacodynamical – the mechanism of insulin secretion regulation of by beta cells, pleiotropic effects are provided.
Nowadays it is established that Diabeton MR in addition to hypoglycemic therapy has dose-dependent neutralizing effect on free radicals. Neutralization of free radicals prevents denaturation of proteins and lipids. As a result, it prevents the development of cardiovascular complications in patients with diabetes mellitus type 2.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.