Достижения и перспективы применения малых молекул в терапии ревматоидного артрита
- Аннотация
- Статья
- Ссылки
- English
В статье рассмотрены перспективы применения ингибиторов янус-киназ при ревматоидном артрите.
В статье рассмотрены перспективы применения ингибиторов янус-киназ при ревматоидном артрите.


Введение
Ревматоидный артрит (РА) – воспалительное заболевание суставов, характеризующееся эрозивным симметричным полиартритом в сочетании с системным иммуновоспалительным поражением внутренних органов. Распространенность РА среди взрослого населения составляет 0,5–2,0%, у женщин 65 лет – около 5,0%. Соотношение женщин и мужчин с РА – 2–3:1.
Патологией страдают лица разных возрастных групп – от детей до пожилых. Однако пик заболеваемости приходится на возраст от 40 до 55 лет.
Установлено, что в 70% случаев эрозивно-деструктивные изменения в суставах появляются в течение первых трех – шести месяцев от дебюта ревматоидного артрита, что определяет неблагоприятный прогноз его течения [1].
Современная стратегия лечения РА базируется на ранней диагностике, в так называемое окно возможности. Это позволяет как можно раньше инициировать активную терапию, целью которой является максимально быстрое достижение ремиссии (концепция лечения до достижения цели). Данная концепция сформулирована экспертами Европейской антиревматической лиги (Еuropean League Against Rheumatism – EULAR) в 2010 г., в 2016 г. она была дополнена с учетом новых научных достижений и клинического опыта [2–4]. Для достижения целей лечения показаны традиционные базисные болезнь-модифицирующие препараты, генно-инженерные биологические препараты (ГИБП) и биосимиляры, а также таргетные синтетические препараты, такие как ингибиторы янус-киназ (Janus Kinases – JAKs).
К ГИБП, официально зарегистрированным в России для лечения РА, относятся ингибиторы фактора некроза опухоли α (ФНО-α) этанерцепт, инфликсимаб, адалимумаб, голимумаб и цертолизумаба пэгол, ингибитор рецепторов интерлейкина 6 (ИЛ-6) тоцилизумаб, анти-В-клеточный препарат ритуксимаб, а также блокатор активации Т-лимфоцитов абатацепт [3]. Показанием для назначения ГИБП является сохранение средней и высокой активности иммуновоспалительного процесса в течение шести месяцев, несмотря на терапию базисными противовоспалительными препаратами (БПВП). Биологические агенты предотвращают структурные повреждения суставов, значимо увеличивают трудоспособность и качество жизни пациентов с РА [5, 6].
Несмотря на значимый эффект ГИБП при РА, около 36% пациентов не отвечают на лечение или не достигают его целей. Феномен ускользания эффекта (в первую очередь моноклональных антител) [5] связан с развитием вторичной резистентности вследствие выработки антител против препарата [6, 7].
Кроме того, ГИБП вводятся парентерально (подкожно или внутривенно), что ассоциируется с риском развития постинфузионных реакций, а также удорожанием и усложнением лечения.
В связи со сказанным определенные надежды связаны с использованием химических молекул массой менее 1 кДа для перорального приема. Механизм их действия направлен на ингибирование внутриклеточных сигнальных путей [8]. Внутриклеточный сигнальный путь опосредует ответ клетки на стимулы окружающей среды за счет проведения и усиления сигналов, инициированных при связывании лигандов с рецепторами клеточной мембраны. Блокирование сигнальной сети может приводить к значимому снижению продукции цитокинов и других медиаторов воспаления.
Среди указанных терапевтических агентов особое место занимают ингибиторы JAKs. Cвое название киназы получили в честь римского бога Януса двуликого, так как содержат два киназных домена. Однако только С-терминальный проявляет тирозинкиназную активность.
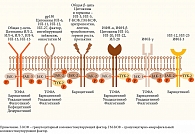
Кроме этого, янус-киназы ассоциированы с рецепторами таких цитокинов, как ИЛ-6 и ИЛ-12, интерферон 1 (ИФН-1). Ряд цитокинов воздействует на различные типы клеток, вовлеченных в патогенез РА: происходящих из моноцитов (макрофаги, дендритные клетки, остеокласты) и из мезенхимы (остеобласты, хондроциты, синовиоциты). В связи с этим одновременное ингибирование JAK-1 и JAK-3 (в меньшей степени JAK-2 и тирозинкиназы 2 (Tyrosine Kinase 2 – TYK-2)) при применении ингибиторов JAKs приводит к противовоспалительному и антидеструктивному эффектам [9]. Оказалось, что семейство янус-киназ (JAK-1, JAK-2, JAK-3 и TYK-2), а также семейство белков-преобразователей сигнала и активаторов транскрипции (Signal Transducer and Activator of Transcription – STAT) играют ключевую роль в цитокин-опосредованном преобразовании внутриклеточных сигналов (рисунок) [9].
Киназы JAK-1, JAK-2 и TYK-2 экспрессируются всеми клеточными структурами организма, в то время как JAK-3 – преимущественно гематопоэтическими клетками, и регулируют их развитие и активацию. Взаимодействие с определенными лигандами способствует аутофосфорилированию JAKs с активацией фосфорилирования каскада белков (семейство STAT, фосфатидилинозитол-3-киназа, митоген-активируемая протеинкиназа (Mitogen-Activated Protein Kinase – MAPK)), которые передают сигналы, направленные на активацию пролиферации и дифференцировки клеток-предшественников к ядру.
Функция JAKs заключается в передаче сигналов от ряда биологически активных молекул (интерферонов, эритропоэтинов и цитокинов, в частности ИЛ-6) и обеспечении ответа на эти сигналы клеток-мишеней [10–12]. Избирательное воздействие на внутриклеточные мишени сближает ингибиторы янус-киназ с ГИБП. Однако в отличие от последних ингибиторы янус-киназ не являются белками (моноклональными антителами или циркулирующими рецепторами). Как было отмечено ранее, они представляют собой низкомолекулярные вещества, так же как стандартные БПВП, например метотрексат (МТ) или лефлуномид, поэтому их относят к таргетным БПВП. Благодаря низкомолекулярному строению ингибиторы JAKs не обладают иммуногенностью, то есть не вызывают образование нейтрализующих антител, которые могут снижать их эффективность [13].
Ингибиторы янус-киназ
В настоящее время прошли регистрацию и используются в клинической практике четыре ингибитора JAKs [14]:
руксолитиниб (Джакави) – ингибитор JAK-1 и JAK-2 для лечения пациентов с первичным миелофиброзом, эссенциальной тромбоцитемией и истинной полицитемией;
тофацитиниб (ТОФА) (Яквинус) – ингибитор JAK-1 и JAK-3, в меньшей степени JAK-2, для лечения РА и псориатического артрита, а также язвенного колита;
барицитиниб – ингибитор JAK-1 и JAK-2 для терапии РА;
упадацитиниб – селективный ингибитор JAK-1 для лечения больных РА, псориатическим артритом, спондилоартритами и аксиальным спондилитом.
Тофацитиниб – низкомолекулярное соединение, обратимый конкурент аденозинтрифосфат-связывающего домена янус-киназы, структурный аналог аденозинтрифосфата. Как было отмечено ранее, ТОФА в большей степени ингибирует JAK-1, JAK-3 и в меньшей степени JAK-2, обладает ограниченной аффинностью с TYK-2 [5], что прерывает JAK-STAT-сигнальный путь и, следовательно, предотвращает реализацию биологических эффектов ряда цитокинов. Ингибирование JAK-1 и JAK-3 блокирует передачу сигнала посредством общих рецепторов, содержащих γ-цепи, в отношении цитокинов, участвующих в регуляции иммунного ответа. К таковым, в частности, относятся ИЛ-2, ИЛ-4, ИЛ-7, ИЛ-9, ИЛ-15 и ИЛ-21. Кроме того, ингибирование JAK-1 ослабляет передачу сигнала других провоспалительных цитокинов, таких как ИЛ-6 и ИФН-γ. Необходимо отметить, что ТОФА – первый ингибитор JAK, включенный в международные и российские клинические рекомендации по лечению РА. Его следует назначать при недостаточной эффективности терапии БПВП, в первую очередь МТ [15].
Барицитиниб преимущественно блокирует JAK-1 и JAK-2, а упадацитиниб – JAK-1. В отличие от ТОФА данные препараты метаболизируются в почках без участия цитохрома Р450 [16–18].
В настоящее время накоплен большой опыт лечения пациентов с РА ТОФА и барицитинибом. В отношении применения упадацитиниба в российской когорте больных РА сбор данных продолжается.
Изучение эффективности тофацитиниба и барицитиниба при ревматоидном артрите
Эффективность ТОФА и барицитиниба при РА оценена в длительных контролируемых исследованиях фаз III и IV при неадекватном ответе на терапию МТ и другими БПВП (ORAL Standart Tofacitinib 5 мг/сут, ORAL Standart Tofacitinib 10 мг/сут, RA-BEAM Baricitinib 4 мг/сут, ORAL Sync Tofacitinib 5 мг/сут, ORAL Sync Tofacitinib 10 мг/сут, RA-BUILD Baricitinib 2 мг/сут, RA-BUILD Baricitinib 4 мг/сут), при лечении метотрексатом наивных больных (ORAL Start Tofacitinib 5 мг/сут, ORAL Start Tofacitinib 10 мг/сут, RA-BEGIN Baricitinib 4 мг/сут + МТ), а также у пациентов с неадекватным ответом на ГИБП (ORAL Step Tofacitinib 5 мг/сут, ORAL Step Tofacitinib 10 мг/сут, RA-BEACON Baricitinib 2 мг/сут, RA-BEACON Baricitinib 4 мг/сут) и в виде монотерапии (ORAL Solo Tofacitinib 5 мг/сут, ORAL Solo Tofacitinib 10 мг/сут, RA-BEGIN Baricitinib 4 мг/сут) [19–21]. Следует отметить, что клиническое улучшение на фоне терапии ингибиторами янус-киназ развивалось уже через две недели от начала применения, а полный ответ – через три месяца [22].
Полученные данные свидетельствуют о том, что у больных РА при неадекватном ответе на терапию МТ лечение ТОФА в дозах 5 и 10 мг/сут (ORAL Standart) и барицитинибом в дозе 4 мг/сут (RA-BEAM) в комбинации с МТ оказалось одинаково эффективным по критериям Американской коллегии ревматологов (American College of Rheumatology – ACR) по сравнению с плацебо. Клиническая эффективность ТОФА при неадекватном ответе на МТ была сравнима с эффективностью адалимумаба по критериям ACR 20, в то время как эффект барицитиниба (RA-BEAM) был достоверно выше (70 и 61% соответственно). В отсутствие эффекта на фоне лечения ГИБП применение ТОФА в дозах 5 и 10 мг/сут (ORAL Step) и барицитиниба в дозах 2 и 4 мг/сут в комбинации с МТ оказалось эффективнее использования плацебо по критериям ACR [22].
Терапия ТОФА в дозе 10 мг/сут (ORAL Standart) и терапия барицитинибом в дозах 2 и 4 мг/сут (RA-BUILD) в комбинации с МТ у больных РА способствовала статистически значимому замедлению скорости рентгенологического прогрессирования суставной деструкции по сравнению с применением плацебо и МТ. В исследовании ORAL Start отмечено, что ТОФА и МТ сдерживали прогрессирование деструктивных изменений суставов. Однако доля таких больных (увеличение общего счета Шарпа ≤ 0,5) при лечении ТОФА была достоверно выше, чем при использовании МТ (79,9 против 64,9%) [19].
Монотерапия барицитинибом в дозе 4 мг/сут (RA-BEGIN) также способствовала замедлению рентгенологического прогрессирования, однако по сравнению с применением плацебо в сочетании с МТ статистически достоверной разницы не получено [20].
Монотерапия ТОФА в дозах 5 и 10 мг/сут (ORAL Solo и ORAL Start) и барицитинибом в дозе 4 мг/сут (RA-BEGIN) у пациентов с РА оказалась эффективнее монотерапии МТ [19].
В 24-месячном рандомизированном исследовании ORAL Start у 958 больных РА, не получавших ранее МТ или не принимавших его в терапевтических дозах, сравнивали эффективность МТ и ТОФА. Средняя частота ответа по ACR 70 через шесть месяцев в группах ТОФА в дозах 5 и 10 мг/сут была достоверно выше, чем в группе МТ, – 25,5 и 37,7 против 12,0%, p < 0,001 в обоих случаях. При этом достигнутое преимущество сохранялось в течение двух лет. Аналогичные различия выявлены при анализе частоты ремиссии и достижения низкой активности РА, которые оценивали с помощью DAS 28 [19].
Эффективность монотерапии ТОФА и комбинации с МТ оценена в 12-месячном двойном слепом рандомизированном контролируемом исследовании ORAL Strategy. Пациенты с недостаточным ответом на МТ получали монотерапию ТОФА в дозе 5 мг/сут, ТОФА в дозе 5 мг/сут в комбинации с МТ, адалимумаб в дозе 40 мг п/к в комбинации с МТ. В указанных группах 50%-ное улучшение по критериям ACR через шесть месяцев наблюдалось в 38, 46 и 44% случаев соответственно [22].
Важно отметить, что в этом исследовании монотерапия барицитинибом в дозе 4 мг/сут была столь же эффективна, что и комбинированная терапия с МТ. Однако результаты исследования ORAL Strategy из-за недостаточного количества клинических наблюдений нельзя считать убедительными. Установлена возможность снижения дозы барицитиниба в два раза с 4 до 2 мг/сут у больных РА после достижения ремиссии или низкой активности заболевания [21].
Таким образом, ТОФА и барицитиниб продемонстрировали эффективность у пациентов с тяжелым и среднетяжелым РА, не отвечавших на терапию МТ или другими стандартными БПВП, особенно при наличии неблагоприятных прогностических факторов, таких как высокая скорость оседания эритроцитов и концентрация С-реактивного белка, высокий счет припухших суставов, наличие ревматоидного фактора и/или антител к цитруллинированному пептиду, особенно в высоких титрах, ранние эрозии. По эффективности ТОФА не уступает ГИБП, а эффективность барицитиниба может превосходить эффективность адалимумаба.
Следовательно, применение ТОФА и барицитиниба у больных РА способствует совершенствованию стратегии лечения РА в отношении возможности выбора оптимального препарата и поддержания ремиссии [23].
Селективность разных ингибиторов янус-киназ и перспективы применения новых селективных препаратов
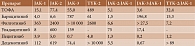
Степень селективности различных ингибиторов янус-киназ, установленная в условиях in vitro, представлена в табл. 1 [10]. Низкая концентрация ингибиторов, необходимая для 50%-ного снижения активации (IC50) различных изоформ JAK, оценивается как высокая селективность, однако она не абсолютна и носит дозозависимый характер [10].
В настоящее время зарегистрировано свыше 150 клинических исследований эффективности ингибиторов JAK более чем при 20 аутоиммунных заболеваниях [24].
Перспективы применения новых ингибиторов JAK при ревматоидном артрите и других ревматических и неревматических заболеваниях представлены в табл. 2 [25].
Исследование эффективности новых селективных ингибиторов янус-киназ при ревматоидном артрите
Согласно результатам рандомизированных контролируемых исследований селективных ингибиторов JAK-1 – упадацитиниба и филготиниба [26, 27], селективного ингибитора JAK-1 и JAK-2 – пефицитиниба [28] и селективного ингибитора JAK-3 – децернотиниба [29], их эффективность, оцениваемая по критериям ACR, при РА превосходила эффект плацебо. В фазе III контролируемых исследований подтверждена эффективность упадацитиниба у пациентов с неадекватным ответом на терапию БПВП (SELECT Next) [30] и ГИБП (SELECT Beyond) [31]. Установлено, что селективные ингибиторы JAK-1 могут вызывать более выраженную блокаду ИЛ-6, который является основным провоспалительным цитокином, инициирующим развитие и прогрессирование РА, и в то же время не вызывать гематологических нежелательных лекарственных реакций (цитопении), ассоциирующихся с ингибированием JAK-2 [32]. Отмечено, что соотношение пользы и риска от ингибирования JAK-2, JAK-3 и TYK-2 у больных РА требует дальнейших исследований [10]. Клинического преимущества в отношении эффективности и безопасности терапии этими препаратами по сравнению с применением неселективных ингибиторов JAK в настоящее время не доказано [31].
Оценка профиля безопасности
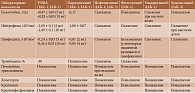
Побочные эффекты и изменение лабораторных показателей на фоне терапии ингибиторами янус-киназ представлены в табл. 3 и 4 [10]. Установлено, что частота серьезных инфекционных осложнений была сопоставима для ТОФА и барицитиниба – 2,7 и 2,9 случая на 100 пациенто-лет при 95%-ном доверительном интервале (ДИ) 2,5–3,9 и 2,5–3,4 соответственно [33, 34]. Лечение ТОФА, барицитинибом и упадацитинибом ассоциировалась с увеличением риска развития опоясывающего герпеса – три-четыре случая на 100 пациенто-лет (95% ДИ 3,6–4,2) по сравнению с плацебо, а также с ГИБП, особенно у лиц пожилого возраста и коренных жителей Кореи и Японии [35]. Применение глюкокортикостероидов у этой категории пациентов служило дополнительным фактором риска развития данного осложнения. Полагают, что реактивация герпесвирусной инфекции может быть класс-специфическим осложнением ингибиторов янус-киназ и связана со снижением антивирусных эффектов ИФН и ИЛ-15, активность которых регулируется JAK-1. Учитывая высокий риск герпесвирусной инфекции, пациентам старше 50 лет до назначения ингибиторов JAK рекомендована вакцинация против вируса герпеса [36].
Частота туберкулеза и других оппортунистических инфекций при лечении ТОФА, барицитинибом и упадацитинибом была одинаково низкой – 0,2 (95% ДИ 0,1–0,3), 0,3 (95% ДИ 0,2–0,4) и 0,3 (95% ДИ 0,1–0,4) на 100 пациенто-лет [10].
В ходе наблюдательных исследований на фоне терапии барицитинибом наблюдалось развитие венозных тромбозов и тромбоэмболических осложнений – 0,5 случая на 100 пациенто-лет (95% ДИ 0,3–0,7). Однако причины этих осложнений до конца не ясны. При применении ТОФА и упадацитиниба тромбозы и тромбоэмболические осложнения практически не регистрировались [37].
К другим побочным эффектам такой терапии относят гастроинтестинальные перфорации. В частности, при применении ТОФА их частота составила 0,11 случая на 100 пациенто-лет (95% ДИ 0,07–0,17), барицитиниба – 0,05 (95% ДИ 0,01–0,13). Указанная реакция связана с ингибированием ИЛ-6 за счет блокады активности регуляторных JAK-1, JAK-2 и TYK-2. Важно отметить, что частота данного осложнения при применении ингибиторов янус-киназ оказалась существенно ниже, чем при использовании ингибиторов ФНО-α [38].
Увеличения риска появления злокачественных опухолей при лечении ТОФА, барицитинибом и упадацитинибом выявлено не было [39].
Установлено, что на фоне терапии ТОФА, барицитинибом и упадацитинибом могут отмечаться следующие гематологические нарушения: анемия, нейтропения, лимфопения. При использовании барицитиниба также описано развитие тромбоцитоза. Необходимо подчеркнуть, что данные гематологические изменения в большей степени наблюдались на фоне терапии барицитинибом и были связаны с ингибированием активности JAK-2, которая регулирует активность гемопоэтических цитокинов (в частности, эритропоэтина), участвующих в пролиферации и выживаемости гемопоэтических клеток, а также активность тромбоцитов и, следовательно, приводит к снижению эритропоэза, миелопоэза и активации функции тромбоцитов [40, 41]. При оценке влияния селективных ингибиторов JAK на гематологические показатели у больных РА отмечено аналогичное неселективным ингибиторам снижение уровня нейтрофилов и лимфоцитов, что рассматривается в рамках класс-специфических эффектов всех ингибиторов JAK. Однако отмечены различия по влиянию селективных ингибиторов JAK на уровень гемоглобина и количество тромбоцитов. Так, филготиниб и децемотиниб аналогично ТОФА ассоциировались с повышением уровня гемоглобина и снижением уровня тромбоцитов, в то время как пефицитиниб и упадацитиниб, особенно в высоких дозах, аналогично барицитинибу снижали уровень гемоглобина и способствовали развитию гипертромбоцитоза. Влияние терапии упадацитинибом и децернотинибом на уровень тромбоцитов не описано. Подобные гематологические изменения объясняются разным профилем ингибирования JAK-2, которое наиболее значимо у барицитиниба и пефицитиниба [10].
Среди других нежелательных реакций указывают увеличение концентрации печеночных трансаминаз, повышение уровня креатинина, креатинфосфокиназы и липопротеинов высокой и низкой плотности без повышения уровня индекса атерогенности, что связывают с блокированием эффектов ИЛ-6 вследствие ингибирования JAK-1 [42–44].
Заключение
В рамках совершенствования стратегии лечения РА – до достижения цели появились новые возможности, связанные с применением таргетных БПВП – ингибиторов JAK (ТОФА, барицитиниба, упадацитиниба), которые, так же как ГИБП, избирательно воздействуют на терапевтические мишени. Поскольку данные препараты являются низкомолекулярными синтетическими средствами, они не обладают иммуногенностью. Важным преимуществом ингибиторов JAK также является способ их применения – перорально, что способствует лучшей приверженности пациентов лечению. Кроме того, существенно снижается стоимость последнего.
Согласно рекомендациям EULAR 2017 г., наравне с ГИБП ингибиторы JAK могут быть использованы у больных тяжелым и среднетяжелым РА, не отвечающих на терапию метотрексатом или другими БПВП.
В настоящее время продолжают активно разрабатываться селективные в отношении отдельных изоформ ингибиторы янус-киназ, применение которых потенциально может способствовать снижению риска нежелательных лекарственных реакций. Улучшению профиля безопасности ингибиторов янус-киназ может также способствовать использование биомаркеров для выявления лиц, у которых развитие тяжелых побочных реакций на фоне применения данных препаратов является генетически обусловленным.
Следует констатировать, что ингибиторы сигнальных молекул могут стать следующим краеугольным камнем в терапии ревматоидного артрита. Знания, полученные о данной группе препаратов, позволят исследовать их в лечении целого ряда аутоиммунных заболеваний: псориаза и псориатического артрита, неспецифического язвенного колита, болезни Крона, системной красной волчанки, ювенильного артрита, гигантоклеточного артериита, атопического дерматита, состояний после трансплантации и миелопролиферативных заболеваний.
V.I. Mazurov, Academician of RAS, MD, PhD, Prof., I.B. Belyayeva, MD, PhD, Prof.
North-Western State Medical University named after I.I. Mechnikov
Contact person: Irina B. Belyayeva, belib@mail.ru
Despite successes in the treatment of rheumatoid arthritis connected with the use of genetically engineered biological drugs, about 36% of patients do not respond to it or do not achieve the expected effect. A new direction in the treatment of rheumatoid arthritis is the use of chemical molecules weighing less than 1 kDa, known as small molecules, which inhibit the work of intracellular signaling systems. These include JAK inhibitors.
The article discusses the prospects for the use of JAK inhibitors in rheumatoid arthritis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.