Эндоскопическая диагностика, лечение и профилактика кровотечений портального генеза
- Аннотация
- Статья
- Ссылки
- English
Введение
По данным мировой статистики развитых стран, 90% случаев портальной гипертензии развивается на фоне цирроза печени (ЦП). Кровотечение из варикозно расширенных вен (ВРВ) пищевода – завершающее звено в последовательности осложнений ЦП, вызванных прогрессирующим фиброзом ткани печени, блоком тока крови через ее ткань, развитием синдрома портальной гипертензии, за которым следует сброс крови по путям коллатерального кровообращения, в том числе прогрессирующее расширение вен пищевода с их последующим разрывом. Сегодня усилия врачей направлены на предотвращение развития последовательных стадий портальной гипертензии и поиск терапевтических и хирургических методов, позволяющих радикально уменьшить давление в системе воротной вены и тем самым предупредить риск развития кровотечения из ВРВ пищевода. Другим подходом к предупреждению гастроэзофагеальных кровотечений портального генеза является использование местной эндоскопической терапии, направленной на эрадикацию ВРВ с целью профилактики их разрыва [1–4].
Угроза пищеводно-желудочного кровотечения считается основным, но, как правило, запоздалым показанием к хирургическому лечению синдрома портальной гипертензии у 25–35% больных ЦП. Летальность при первом эпизоде желудочно-кишечного кровотечения достигает 50%. У 60% пациентов, перенесших кровотечение из ВРВ пищевода и желудка в прошлом, в течение первого года возникает рецидив, вследствие которого умирают еще от 30 до 70% больных. Таким образом, именно гастроэзофагеальные кровотечения делают портальную гипертензию у больных ЦП хирургической проблемой. Неудовлетворительные результаты хирургического лечения больных с угрозой портального кровотечения послужили толчком к развитию малоинвазивных эндоскопических методик [3].
Эндоскопическая диагностика варикозного расширения вен пищевода и желудка
В настоящее время из всех доступных методов диагностики эзофагогастродуоденоскопия (ЭГДС) является золотым стандартом как в выявлении ВРВ пищевода и желудка, так и в выборе лечебной тактики. Эндоскопическое исследование позволяет определить не только наличие, но и локализацию варикозных вен, оценить степень их расширения, состояние стенки вен, слизистой оболочки пищевода и желудка, выявить сопутствующую патологию, а также стигматы угрозы кровотечения [2].
Независимо от степени выраженности ВРВ эндоскопическое исследование следует проводить очень аккуратно, принимая во внимание, что само исследование может спровоцировать манифест кровотечения. При этом следует обращать внимание на адекватность проведения местной анестезии, избегать форсированного проведения аппарата и быстрой инсуффляции воздуха в просвет желудка, предупреждая срыгивание воздуха и избыточные рвотные позывы. Приступая к исследованию, надо убедиться в готовности проведения эндоскопического гемостаза в случае кровотечения. Приоритетным считается использование ультратонких аппаратов и трансназального исследования.
Для оценки степени выраженности ВРВ пищевода применяют две равнозначные классификации. Более ранняя классификация K.J. Paquet (1983) предусматривала четыре степени заболевания:
-
1-я степень: единичные эктазии вен (верифицируются эндоскопически, но не определяются рентгенологически);
-
2-я степень: единичные хорошо отграниченные стволы вен, преимущественно в нижней трети пищевода, которые при инсуффляции воздуха отчетливо выражены. Просвет пищевода не сужен, слизистая оболочка пищевода над расширенными венами не истончена;
-
3-я степень: просвет пищевода сужен за счет выбухания ВРВ в нижней и средней третях пищевода, которые частично спадаются при инсуффляции воздуха. На верхушках ВРВ определяются единичные красные маркеры или ангиоэктазии;
-
4-я степень: в просвете пищевода множественные варикозные узлы, не спадающиеся при сильной инсуффляции воздуха. Слизистая оболочка над венами истончена. На верхушках вариксов определяются множественные эрозии и/или ангиоэктазии (супервариксы).
В 1997 г. N. Soehendra и K. Binmoeller предложили классификацию ВРВ отдельно для пищевода и желудка.
Варикозное расширение вен пищевода:
-
1-я степень: диаметр вен не превышает 5 мм, вытянутые, располагаются только в нижней трети пищевода;
-
2-я степень: диаметр вен от 5 до 10 мм, извитые, расположены в средней трети пищевода;
-
3-я степень: диаметр более 10 мм, напряженные, с тонкой стенкой, расположены вплотную друг к другу, на поверхности вен «красные маркеры».
Варикозное расширение вен желудка:
-
1-я степень: диаметр вен не превышает 5 мм, плохо различимы над слизистой оболочкой желудка;
-
2-я степень: диаметр от 5 до 10 мм, единичные, полипоидного вида;
-
3-я степень: диаметр более 10 мм, в виде обширных конгломератов узлов полипоидного вида с истончением слизистой оболочки.
При ВРВ желудка выделяют два основных типа поражения в зависимости от локализации вен и распространенности поражения с вовлечением пищевода. Сочетанные поражения пищевода и желудка (Gastroesophageal Varices – GOV):
-
тип I – гастроэзофагеальные ВРВ с распространением на кардиальный и субкардиальный отделы малой кривизны желудка (GOV 1);
-
тип II – гастроэзофагеальные ВРВ от эзофагокардиального перехода по большой кривизне по направлению к дну желудка (GOV 2).
Изолированный желудочный варикоз (Isolated Gastric Varices – IGV) подразделяется на изолированное поражение фундального отдела желудка (IGV 1) и форму с преимущественным поражением антрального отдела (IGV 2) [1].
Основными источниками кровотечения из верхних отделов пищеварительного тракта являются ВРВ пищевода, преимущественно его дистальных отделов. ВРВ желудка встречаются реже и обычно хуже диагностируются из-за особенностей строения слизистой оболочки, сложности осмотра кардии в положении ретрофлексии, особенно на фоне продолжающегося кровотечения. Расширение венул и капилляров слизистой оболочки и подслизистого слоя желудка приводит к портальной гипертензивной гастропатии, которая при эндоскопическом исследовании характеризуется наличием очагов красных пятен на слизистой оболочке, гиперемией, мозаичностью рисунка слизистой оболочки, а в более тяжелых случаях диффузными темно-красными пятнами или внутрислизистыми геморрагиями. Считается, что до 25% кровотечений может быть обусловлено гастропатией.
Стратегия комплексного лечения пациентов с портальным кровотечением на фоне цирроза печени
Лечение варикозного кровотечения включает три главных направления:
-
лечение активного кровотечения (состоявшегося кровотечения);
-
профилактику рецидива кровотечения;
-
профилактику первого кровотечения.
Безусловно, эндоскопическое лечение является лишь частью комплексного терапевтического и хирургического лечения и направлено на остановку кровотечения или эрадикацию ВРВ как потенциального источника кровотечения.
При выборе лечебной тактики у больных ЦП необходимо оценить ее функциональное состояние. Для этого применяется классификация Чайлда – Пью.
При циррозе печени функциональных классов А и В проведение хирургического вмешательства, направленного на снижение портальной гипертензии, считается возможным. При декомпенсированном ЦП (класс С) риск операции предельно высок, и при возникновении кровотечений из ВРВ пищевода и желудка приоритет следует отдавать консервативным или миниинвазивным методам лечения.
Основными причинами пищеводно-желудочных кровотечений при портальной гипертензии являются:
-
гипертонический криз в портальной системе (повышение портосистемного градиента > 12 мм рт. ст.);
-
трофические изменения слизистой оболочки пищевода и желудка вследствие нарушения гемоциркуляции и воздействия кислотно-пептического фактора;
-
нарушения свертывающей системы.
Единого мнения, какой из этих факторов основной, в настоящее время не существует [1, 5–7].
Главные задачи лечения – остановка кровотечения, возмещение кровопотери, лечение коагулопатии, предотвращение рецидивов кровотечения, ухудшения функции печени и осложнений, обусловленных кровотечениями (инфекции, печеночная энцефалопатия и т.д.) [1, 5–7].
Отметим, что за последние несколько лет стандарты претерпели изменения. Ряд положений получил подтверждение с позиции доказательной медицины. При наличии кровотечения первостепенными задачами лечения являются остановка кровотечения и стабилизация гемодинамики путем восполнения объема циркулирующей крови с использованием свежезамороженной плазмы.
Оказание помощи при остром кровотечении из ВРВ пищевода у больных ЦП следует начинать с применения вазоактивных препаратов. Препаратом выбора считается терлипрессин (Реместип, «Ферринг»). При остром кровотечении рекомендуется внутривенное струйное введение препарата в дозе 1,0 мг (10 мл) с интервалом 4–6 часов до остановки кровотечения. Введение препарата продолжается в течение последующих 3–5 дней с его отменой при условии отсутствия кровотечения в течение 24–48 часов. Важный момент: способ введения терлипрессина позволяет применять его на этапе догоспитальной медицинской помощи [8].
В настоящее время накоплена достаточная доказательная база применения терлипрессина при остром кровотечении из ВРВ пищевода у больного ЦП. Через пять минут после внутривенного струйного введения 2 мг терлипрессина достоверно (на 30%) снижается градиент венозного давления в печени и кровоток в воротной вене.
Кроме того, в плацебоконтролируемых исследованиях показано, что применение терлипрессина позволяет остановить кровотечение из ВРВ пищевода в течение 12 часов у 70% больных ЦП. Коэффициент выживаемости через месяц после острого кровотечения из ВРВ пищевода по сравнению с группой плацебо достоверно выше – 90 и 62% соответственно [9].
Обратите внимание: наряду с назначением вазоактивных препаратов с первых дней рекомендуется проводить антибактериальную терапию для профилактики портально-системной энцефалопатии. При снижении уровня гемоглобина крови < 80 г/л показана трансфузия эритромассы.
На фоне проводимой терапии сразу при поступлении в стационар проводится эндоскопическое исследование, целью которого является установление источника кровотечения и эндоскопический гемостаз. При неэффективности эндоскопического гемостаза или массивном кровотечении показано проведение баллонной тампонады как временного метода гемостаза. При неэффективности комплексной терапии и эндоскопического гемостаза, раннем рецидиве кровотечения рассматривается вопрос о наложении трансъюгулярного портосистемного шунта или оперативном вмешательстве.
Эндоскопическое лечение и профилактика кровотечений портального генеза
Методы гемостаза, применяемые при остановке кровотечений портального генеза, можно разделить на временные и постоянные. Временные направлены на остановку кровотечения высокой интенсивности для стабилизации состояния больного и последующего применения одного из методов окончательного гемостаза. Временный гемостаз достигается установкой зонда-обтуратора Сенгстакена – Блэкмора или стента Даниша.
После постановки диагноза «кровотечение из ВРВ пищевода или желудка» и извлечения эндоскопа незамедлительно вводят зонд-обтуратор Сенгстакена – Блэкмора и раздуваются манжетки, за счет чего достигается надежный гемостаз.
Больные тяжело переносят процедуру введения зонда в носоглотку (равно как и пребывание его в носоглотке в течение нескольких часов), поэтому перед его введением обязательно проводится премедикация (1,0 мл 2%-ного раствора промедола).
Зонд-обтуратор вводят через носовой ход, заводя желудочный баллон глубоко в желудок. Предварительное измерение расстояния от мочки уха до мечевидного отростка позволяет правильно расположить зонд-обтуратор в пищеводе и желудке. Затем при помощи градуированного шприца, присоединенного к катетеру желудочного баллона, в последний вводят воздух 150 см3 (но не воду!) и катетер перекрывают зажимом. Зонд подтягивают до ощущения упругого сопротивления, что обеспечивает сдавление вен в зоне кардии. После этого зонд фиксируют к верхней губе липким пластырем.
Пищеводный баллон раздувают редко, только если продолжается срыгивание кровью. В противном случае достаточно раздувания только желудочного баллона. Воздух в пищеводный баллон вводят небольшими порциями, первоначально 60 см3, впоследствии – по 10–15 см3 с интервалом 3–5 минут. Соблюдение этих условий необходимо для того, чтобы дать возможность органам средостения адаптироваться к их смещению раздутым баллоном. Общее количество нагнетаемого воздуха в пищеводном баллоне доводят обычно до 80–100 см3 в зависимости от выраженности дилатации пищевода и переносимости пациентом давления баллона на средостение.
После установки зонда аспирируют желудочное содержимое и промывают желудок холодной водой. Контроль за кровотечением осуществляется путем динамического наблюдения за желудочным содержимым, поступающим по зонду после тщательного промывания желудка. Во избежание пролежней на слизистой оболочке пищевода через четыре часа пищеводный баллон распускают и, если в этот момент в желудочном содержимом примесь крови не появляется, пищеводную манжетку оставляют спущенной. Желудочную манжетку распускают позже – через 1,5–2 часа. У больных с удовлетворительной функцией печени зонд должен находиться в желудке еще в течение 12 часов для контроля за желудочным содержимым. После удаления зонда-обтуратора необходимо сразу рассмотреть вопрос о выполнении одного из вариантов постоянного эндоскопического гемостаза. В случае рецидива кровотечения зонд-обтуратор должен быть введен вновь, баллоны раздуты, а больному ЦП (классы А и В) предложена операция или эндоскопический гемостаз, поскольку возможности консервативной терапии считаются исчерпанными [1].
При неэффективности временного гемостаза с использованием зонда Сенгстакена – Блэкмора в качестве альтернативной технологии можно применить установку стента Даниша. Это пластиковый самораскрывающийся покрытый стент, для имплантации которого не требуется проведения эндоскопического или рентгенологического контроля. Степень компрессии раскрытого стента позволяет достигать надежного гемостаза в срок от двух до 14 дней. Пероральное питание можно осуществлять непосредственно после установки стента. Впоследствии стент удаляют и решают вопрос о дальнейшем лечении и необходимости проведения окончательного гемостаза.
Постоянный эндоскопический гемостаз при кровотечении из ВРВ пищевода и желудка может быть осуществлен с использованием нескольких технологий – лигирования, склеротерапии, введения клеевых композиций. Помимо достижения окончательного гемостаза показаниями к вмешательствам подобного рода являются профилактика первого эпизода кровотечения (первичная профилактика) и профилактика рецидива кровотечения (вторичная профилактика) из ВРВ пищевода у больных с портальной гипертензией при невозможности хирургического лечения.
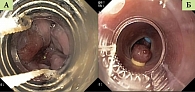
Для лигирования ВРВ используется специальное устройство – лигатор. Лигатор состоит из нескольких частей: дистального колпачка с лигатурами, винта-рукоятки, при помощи которого сбрасываются лигирующие кольца, и соединяющей их металлической или капроновой струны, которая проводится через инструментальный канал. Дистальный колпачок сделан из ригидного прозрачного пластика, надевается на дистальный конец эндоскопа. На наружной поверхности колпачка расположены растянутые латексные кольца-лигатуры. Процесс освобождения (сбрасывания) кольца-лигатуры осуществляется путем натягивания закрепленной на нем нити. Устройство собирается непосредственно перед использованием в единую конструкцию. В своей работе мы чаще используем лигирующую систему Speedband Superview Super7TM. Такой выбор обусловлен максимальным удобством и безопасностью данной системы благодаря ее конструктивным особенностям. У данной лигирующей системы натягивающаяся нить располагается в специальном канале колпачка, что исключает ее попадание в поле зрения и срабатывание автоматической светокоррекции эндоскопа. Это в свою очередь значительно улучшает визуализацию, а следовательно, и безопасность самой процедуры.
Операцию проводят под внутривенной анестезией. Спокойное состояние больного позволяет минимизировать технические трудности на этапе проведения дистального конца аппарата с лигирующим устройством в просвет пищевода, а также является важным моментом профилактики кровотечения и разрыва варикса при лигировании.
Проведение аппарата в пищевод может сопровождаться определенными трудностями. Колпачок с лигатурами на дистальном конце эндоскопа обладает ригидностью и встречает естественное сопротивление на уровне грушевидного синуса и нижнего глоточного сфинктера. Аппарат проводится до области пищеводно-желудочного перехода при минимальной инсуффляции воздуха во избежание срыгивания и разрыва вариксов. Детальный осмотр желудка с диагностической целью, особенно в инверсионном положении, нецелесообразен. Дистальный колпачок с предустановленными кольцами значительно сужает поле зрения и его освещенность. К моменту принятия решения о лигировании диагностические вопросы должны быть полностью решены. При необходимости контрольного диагностического исследования его лучше провести непосредственно перед лигированием.
После проведения эндоскопа с лигирующим устройством приступают к лигированию, при этом начинают с области эзофагокардиального перехода, чуть выше зубчатой линии.
Кольца накладываются по спирали. Необходимо избегать наложения лигатурных колец в одной плоскости по окружности для профилактики дисфагии в ближайшем и отдаленном периодах.
Выбранный варикозный узел на аспирации максимально втягивается в просвет лигирующего колпачка. После этого лигатуру сбрасывают на основание узла. Тогда становится видно, что лигированный узел меняет окраску на синюшную. Необходимо возобновить подачу воздуха и несколько извлечь эндоскоп: данные манипуляции позволяют удалить лигированный узел из цилиндра. В зависимости от степени выраженности ВРВ за сеанс накладывается до десяти лигатур
(см. рисунок).
Лигирование ВРВ при продолжающемся или состоявшемся кровотечении имеет некоторые технические особенности. Первую лигатуру необходимо накладывать на источник кровотечения. Затем лигируются остальные ВРВ.
В первые сутки после лигирования назначают только питье холодной воды, со вторых суток – определенное питание (стол № 1). Следует избегать больших глотков. Пища должна быть прохладной, жидкой или протертой. При болях целесообразно назначать Алмагель А с местным анестетиком. При интенсивных болях за грудиной рекомендуется применение анальгетиков группы нестероидных противовоспалительных препаратов. Болевой синдром обычно купируется к третьим суткам.
Со вторых по седьмые сутки после лигирования узлы некротизируются, уменьшаются в размерах, густо покрываются фибрином с последующим отторжением некротических тканей вместе с лигатурами и образованием поверхностных изъязвлений. Язвы заживают к 14–21-му дню, оставляя звездчатые рубчики без стеноза просвета пищевода. К концу второго месяца после лигирования подслизистый слой замещается рубцовой тканью, а мышечный остается интактным.
В отсутствие осложнений контрольная ЭГДС выполняется через месяц после операции. Дополнительные сеансы лигирования назначаются при недостаточности первого сеанса, а также при возникновении со временем новых стволов варикозных вен.
Эндоскопическое склерозирование ВРВ пищевода основано на облитерации варикозных вен после введения в просвет вены склерозанта через эндоскоп с помощью длинной иглы. Наряду с интравазальным способом склеротерапии существует метод паравазального введения склерозанта, в результате чего происходит сдавление варикозных узлов – первоначально за счет отека, а затем за счет образования соединительной ткани.
Для интравазального введения чаще используют натрия тетрадецилсульфат (Тромбовар) 5–10 мл на одну инъекцию. Применяется также 3%-ный раствор Этоксисклерола. После введения склерозанта необходимо сдавить вену в местах пункции. Это обеспечит образование тромба в результате отека эндотелия сосуда. За один сеанс тромбируют не более двух варикозных стволов вен во избежание усиления застоя в варикозных венах желудка. Для паравазального введения из склерозирующих агентов обычно используется Этоксисклерол, который содержит 5–20 мг полидоканола в 1 мл этилового спирта. Чаще применяется Этоксисклерол 0,5%. При каждой инъекции вводят не более 3–4 мл склерозанта. Обычно осуществляют от 15 до 20 инъекций. За один сеанс расходуется до 24–36 мл склерозанта. Вводимый по инъектору склерозант создает по обеим сторонам варикозной вены плотный отек, сдавливающий сосуд.
Процедура выполняется под внутривенной анестезией. Склеротерапия начинается от области эзофагокардиального перехода и продолжается в проксимальном направлении.
По окончании сеанса склеротерапии варикозные вены практически не определяются в отечной слизистой оболочке. Подтекание крови из мест проколов обычно незначительно и не требует принятия дополнительных мер.
Ближайший период после сеанса склеротерапии обычно не сопровождается болевыми ощущениями. Больному разрешают пить и принимать жидкую пищу через 6–8 часов после процедуры.
После первого сеанса склеротерапии через пять дней процедуру повторяют. При этом стараются охватить участки пищевода с ВРВ, которые оказались вне зоны действия первого сеанса склеротерапии. Третий сеанс склеротерапии проводят через 30 дней. При этом оценивают эффективность проводимого лечения, динамику уменьшения степени ВРВ и отсутствие угрозы кровотечения. Четвертый сеанс склеротерапии назначают через три месяца.
Глубокий рубцовый процесс в подслизистом слое пищевода и желудка при повторных сеансах склеротерапии предотвращает возможность развития предсуществующих венозных коллатералей и варикозной трансформации. Лечение продолжается до достижения эффекта эрадикации либо положительного результата. Для этого требуется в среднем четыре-пять сеансов склеротерапии в год. Динамический контроль осуществляется в последующем один раз в шесть месяцев. При необходимости лечение повторяется.
В настоящее время после внедрения в клиническую практику методики лигирования варикозных вен многоэтапная склеротерапия, сопровождающаяся большим числом осложнений, не является методом первой линии эндоскопического гемостаза и профилактики кровотечения и используется в комбинации с лигированием в качестве пособия, позволяющего добиться радикальности вмешательства
В случаях, когда склеротерапия не позволяет остановить кровотечение (при варикозном расширении вен желудка), применяют цианоакрилатные клеевые композиции. Используют два тканевых клея: N-бутил-2-цианоакрилат (гистоакрил) и изобутил-2-цианоакрилат (букрилат). При попадании в кровь цианоакрилат быстро полимеризуется (20 секунд), вызывая облитерацию сосуда, за счет чего достигается гемостаз. Через несколько недель после инъекции клеевая пробка отторгается в просвет желудка.
Время проведения инъекции ограничено 20 секундами из-за полимеризации гистоакрила. Несоблюдение данного условия приводит к преждевременному застыванию клея в инъекторе, что не позволяет широко применять данный метод в лечении и профилактике кровотечений из ВРВ пищевода и желудка.
Заключение
Решение клинической проблемы кровотечения из ВРВ пищевода требует слаженных действий специалистов различных специальностей: гепатологов, эндоскопистов, хирургов, а постоянное совершенствование профессиональных знаний и практических умений врачей позволят сохранить жизнь наших пациентов.
K.V. Shishin, I.Yu. Nedoluzhko
Moscow Clinical Research and Practical Center of the Moscow Healthcare Department
Contact person: Kirill Vyacheslavovich Shishin, k.shishin@mknc.ru
Bleedings from esophageal varices (EV) represent a final step in sequential complications of liver cirrhosis. After the first episode of gastro-intestinal bleeding, mortality rate reaches 50%. Among all available diagnostic methods, esophagogastroduodenoscopy is accepted as a golden standard both for detection of EV and gastric varices as well
as for choosing treatment policy. The main source of the bleeding in the upper digestive tract is EV, mainly located
at distal part of esophagus. Treatment of variceal bleeding includes three therapeutic approaches: treatment
of active bleeding (completed bleeding), prevention of bleeding relapse as well as prevention of the first bleeding. Endoscopic treatment is considered as a part of a combined therapeutic and surgical intervention and aimed
at arrest of bleeding or eradication of varicose veins as a potential source of bleedings. Temporary hemostasis
is aimed at arrest of high intensity bleeding to stabilize patient’s condition followed by applying one of approaches
for final hemostasis. Permanent endoscopic hemostasis applied in case of bleedings from EV and gastric varices
may be executed by using several techniques such as ligation, sclerotherapy, and injection of adhesive compositions.
Among them, endoscopic ligation is the most popular approach. Here, we discuss endoscopic approaches
for treatment and prevention of bleedings from EV according to the national clinical recommendations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.