Цирроз печени: что нового в лечении
- Аннотация
- Статья
- Ссылки
- English






Введение
Согласно данным Всемирной организации здравоохранения (ВОЗ), последние 20 лет в мире прослеживается четкая тенденция к росту числа хронических заболеваний печени различной этиологии (алкогольной, вирусной, обусловленной метаболическими нарушениями, приемом гепатотоксичных лекарственных препаратов). Как показывают результаты первого проведенного ВОЗ исследования причин смертности от заболеваний печени, показатель смертности от цирроза и рака печени увеличился на 50 млн за последние два десятилетия [1]. Цирроз печени (ЦП) является конечной гистологической стадией широкого спектра хронических заболеваний печени: следствием повреждения гепатоцитов и защитных механизмов в печени становится регенерация и фиброз.
Несмотря на стремительный прогресс в диагностических и терапевтических методах управления хроническими заболеваниями печени, лечение ЦП остается глобальной медико-социальной и экономической проблемой. Например, алкогольный ЦП занимает восьмое место среди наиболее распространенных причин смертности в США и второе место по смертности среди заболеваний органов пищеварения в мире [2].
Наиболее распространенной причиной развития ЦП в CША является вирус гепатита C (hepatitis C virus, HCV): 26% случаев приходится на ЦП в исходе хронического гепатита С (ХГС). Алкоголь – вторая по значимости причина ЦП, на долю которой приходится свыше 20% случаев ЦП. ЦП в сочетании с HCV-инфекцией и алкогольной болезнью печени (АБП) составляют около 15% ЦП, криптогенные циррозы – 18% ЦП. Однако по некоторым данным, криптогенные ЦП, как правило, представлены неалкогольной жировой болезнью печени (НАЖБП). Наконец, вирус гепатита В (HBV) и сочетание HBV- и HDV-инфекции приводят к ЦП в 15% случаев. На долю ЦП иной этиологии приходится около 5% всех встречающихся циррозов [3].
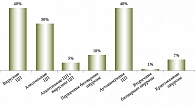
Согласно эпидемиологическим данным Европейского общества по изучению заболеваний печени (European Association for the Study of the Liver – EASL, 2013), среди всех первичных причин трансплантации печени в 1988–2009 гг. ЦП занимал лидирующую позицию – 59% всех хронических заболеваний печени (рис. 1) [4].
Несмотря на успехи противовирусной терапии (ПВТ), распространенность ЦП в исходе ХГС продолжает расти. При этом большинство пациентов, инфицированных HCV, не знают об инфекции, а для многих, у кого заболевание диагностировано, лечение остается недоступным. Не уменьшается распространенность ЦП вследствие АБП. По официальным данным, в России насчитывается свыше 10 млн больных алкоголизмом, от 500 тыс. до 1 млн страдают алкогольным ЦП, который развивается в среднем через 10–20 лет злоупотребления алкоголем [5]. Кроме того, показатели смертности у данной категории больных связывают с широким распространением HCV-инфекции, ускоряющей развитие ЦП [6]. Особое внимание гепатологов приковано к НАЖБП и неалкогольному стеатогепатиту, особенно ассоциированным с ожирением и метаболическим синдромом. Недооценивается роль вируса гепатита В. На долю циррозов печени, связанных с HBV, приходится 20–30% случаев HBV-инфекции. Причем только около 23% лиц, инфицированных HBV, знают о наличии вируса [1, 4, 7].
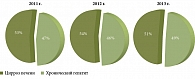
По нашим данным, среди всех больных, госпитализированных в гепатологическое отделение Центрального научно-исследовательского института гастроэнтерологии (ЦНИИГ) в 2011–2013 гг., пациенты с ЦП преобладали над больными хроническим гепатитом (рис. 2).
Таким образом, процент пациентов с ЦП, нуждающихся в терапевтической и хирургической помощи, высок. Несмотря на то что количество препаратов с показаниями «хронические гепатиты и циррозы печени» в инструкции по применению растет, лечение собственно фиброза и ЦП остается нерешенной задачей, а терапия ЦП обычно сводится к лечению его осложнений. Тем не менее в течение последних нескольких лет клиницисты все чаще становятся свидетелями серьезных успехов как в этиотропной, так и в патогенетической терапии больных ЦП. Это позволяет врачам не ставить знак равенства между диагнозом цирроза печени и приговором, а пациентам надеяться не только на увеличение продолжительности жизни и улучшение ее качества, но и на выздоровление.
Лечение цирроза печени HCV-этиологии
По последним оценкам, из более чем 185 млн пациентов, инфицированных HCV, ежегодно умирают 350 000. В 1/3 случаев хроническая инфекция приводит к ЦП, печеночной недостаточности или гепатоцеллюлярной карциноме (ГЦК) (около 2–4% в год) [8].
Есть ли у больных циррозом печени, связанным с HCV, шанс на выздоровление?
В настоящее время основной целью ПВТ считается достижение устойчивого вирусологического ответа (УВО), который определяется как отсутствие HCV РНК в сыворотке крови пациента через 12–24 недели по завершении ПВТ. Доказано, что УВО равнозначен полному пожизненному излечению и улучшает прогноз заболевания в целом: достижение УВО снижает риск смерти от любых других причин на 45%, а риск осложнений ЦП – на 27%. Отметим, что эффективность ПВТ даже с использованием современных препаратов прямого противовирусного действия (в зарубежной литературе используется термин DAA – direct antiviral agents) снижается прямо пропорционально тяжести фиброза. Для мониторинга эффективности ПВТ с применением прямых антивирусных препаратов при оценке уровня HCV РНК в режиме реального времени используют пороговое значение 15–25 МЕ/мл [9].
Исходя из собственного опыта, результатов клинических исследований и наблюдения за пациентами с ХГС, получающими ПВТ, можно сделать вывод, что современная идеальная схема противовирусного лечения должна отвечать ряду требований:
-
максимально высокая эффективность лечения (независимо от исходных характеристик, в первую очередь при ЦП);
-
максимально короткие сроки ПВТ (независимо от исходных характеристик, в том числе при ЦП);
-
отсутствие (минимум) межлекарственных взаимодействий;
-
отсутствие нежелательных явлений (НЯ) или их незначительное количество, не влияющее на переносимость ПВТ.
«Коктейли» прямых противовирусных агентов, разрабатываемые компаниями-производителями на основе комбинации препаратов с разным механизмом действия (рис. 3), открывают широкие перспективы для излечения пациентов с ХГС, прежде всего больных ЦП.
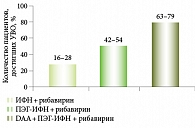
Появление первых DAA – ингибиторов протеазы первого поколения (телапревира и боцепревира) открыло новую эру в лечении пациентов с генотипом 1 вируса ХГС (рис. 4). Метаанализ данных пяти клинических исследований ПВТ (фаза III) с боцепревиром у пациентов с ЦП класса А по шкале Чайлда – Пью продемонстрировал достижение УВО в 55% случаев против 17% стандартной двойной ПВТ [10, 11].
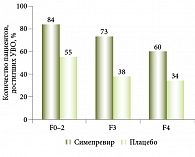
Неожиданным и интересным оказался опыт проведения программы раннего доступа с телапревиром у пациентов с выраженным фиброзом (F3) или циррозом (F4) в российской популяции: частота достижения УВО была более высокой, чем в европейской или американской когорте. Так, частота достижения УВО в российской популяции у пациентов, ранее не получавших лечения, составила 82%, у пациентов с рецидивом – 96%, пациентов с нулевым ответом – 67%. У пациентов из других регионов (1762 пациента из 16 стран) эти показатели составили 68, 72 и 34% соответственно (рис. 5).
Основная причина высокой эффективности в российской выборке пациентов, по мнению авторов, в том, что подавляющее большинство больных имели генотип 1b, при котором применение ингибиторов протеазы эффективнее, чем при генотипе 1а [12–13].
Очень важны, на наш взгляд, сравнительные данные применения телапревира и симепревира (ингибитора протеазы NS3/4A второго поколения), полученные в исследовании ATTAIN и позволяющие с большой долей вероятности перенести опыт применения телапревира в российской когорте больных на другие ингибиторы протеазы, прежде всего на симепревир.
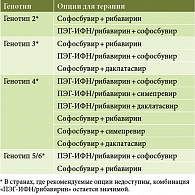
В рекомендациях (табл. 1 и 2) EASL и Американской ассоциации по изучению заболеваний печени (American Association for the Study of Liver Diseases – AASLD) в современные схемы ПВТ хронической HCV-инфекции включены новые прямые противовирусные препараты, зарегистрированные и одобренные к применению регулирующими органами в соответствующих странах (Food and Drug Administration (FDA) – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, European Medicines Agency (EMA) – Европейское медицинское агентство, 2014). К сожалению, из имеющихся схем для российской популяции пациентов пока доступна небольшая часть новых препаратов, позволяющих увеличивать частоту достижения УВО и снижать частоту развития НЯ.
В настоящее время в России пока не зарегистрированы препараты даклатасвир, софосбувир. В рекомендациях по лечению ХГС [14] предусмотрены варианты, когда софосбувир, даклатасвир и симепревир могут быть недоступны. В таком случае при генотипе 1 рассматривается применение ингибиторов протеазы первого поколения телапревира и боцепревира в схемах с ПЭГ-ИФН-альфа/рибавирином, опираясь на регистрационные данные препаратов (FDA Boceprevir, FDA Telaprevir; EMA Boceprevir, EMA Telaprevir), в том числе для пациентов с компенсированным ЦП. Однако следует напомнить, что и телапревир, и боцепревир у пациентов с ЦП имеют низкий профиль безопасности. В России зарегистрирован новый ингибитор протеазы второго поколения – симепревир. Соответственно, если исходить из критериев эффективности и безопасности, для российской популяции при генотипе 1 ХГС наиболее интересна комбинация ингибитора протеазы второго поколения симепревира + ПЭГ-ИФН-альфа и рибавирина, при генотипах 2 и 3 – обычная двойная стандартная терапия «ПЭГ-ИФН-альфа + рибавирин».
В отличие от ингибиторов протеазы первого поколения симепревир имеет ряд преимуществ:
-
принимается один раз в сутки;
-
не требует жирного рациона для лучшей биоусвояемости;
-
длительность терапии 24 недели даже у пациентов с ЦП (для нелеченых и пациентов с рецидивом);
-
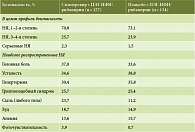
низкая частота НЯ по сравнению с телапревиром и боцепревиром, прежде всего развития анемии и таких кожных реакций, как зуд, сыпь (табл. 3) [14].
Как видно из табл. 3, симепревир имеет близкий к идеальному профиль безопасности (или сравнимый с плацебо). Это очень важно для сохранения качества жизни пациентов на фоне антивирусного лечения, особенно при ЦП, когда развитие побочных эффектов способно привести к декомпенсации заболевания, отмене ПВТ [15]. Как известно, преждевременное прекращение ПВТ вследствие НЯ может стать причиной развития резистентных штаммов вируса гепатита С из-за селекции более устойчивых, оставшихся в организме недолеченного пациента.
Не менее важный аспект: применение схемы «симепревир + ПЭГ-ИФН-альфа/рибавирин» повышает частоту достижения УВО. Она статистически значимо выше в группе симепревира (симепревир + ПЭГ-ИФН-альфа/рибавирин) по сравнению с плацебо независимо от стадии фиброза. Обратите внимание: даже при ЦП ПВТ с симепревиром приводит к достижению УВО в 60% случаев (рис. 6) [16].
По сравнению с ингибиторами протеаз первого поколения в схемах применения симепревира и правилах отмены имеется ряд отличий. Так, длительность терапии симепревиром у пациентов, ранее не получавших лечения, и пациентов с рецидивом независимо от стадии фиброза составляет 24 недели (в том числе для пациентов с F4). При проведении ПВТ по схеме «симепревир + ПЭГ-ИФН-альфа/рибавирин» также оценивается быстрый и продленный вирусологический ответ на 4-й и 12-й неделях соответственно. При обнаружении на 4-й неделе HCV РНК в количестве 25 МЕ/мл и выше следует прекратить ПВТ, как и в случае обнаружения HCV РНК после 12 недель ПВТ в указанной концентрации [17].
Частота достижения УВО у пациентов с выраженным фиброзом приводит к значительному снижению развития осложнений, декомпенсации и ГЦК. Особое внимание следует уделять мониторингу и коррекции побочных эффектов в группе пациентов с ЦП, которые, как правило, старше, имеют другие сопутствующие заболевания, а значит, применяют дополнительную терапию. Необходимо учитывать риск возможных лекарственных взаимодействий, поскольку переносимость ПВТ у данной категории больных может быть хуже.
Согласно рекомендациям EASL и AASLD (2014) приоритет в инициации ПВТ должен быть отдан пациентам с F3 и компенсированным ЦП для профилактики дальнейших осложнений хронической HCV-инфекции (уровень рекомендации А1, EASL, AASLD). Пациентам, ранее не получавшим лечения, с компенсированным ЦП, в том числе с ГЦК, должна быть назначена терапия, рекомендованная пациентам без ЦП (класс I, уровень А, EASL, AASLD) [18].
Схемы ПВТ, включающие ПЭГ-ИФН-альфа, могут использоваться у пациентов с компенсированным ЦП (класс А по шкале Чайлда – Пью) и сохранной функцией печени, различными генотипами (рекомендация В1, EASL). Следует очень строго отбирать таких пациентов, учитывая уровень альбумина и наличие цитопении. Имеющиеся данные подчеркивают значительное количество НЯ во время лечения пациентов с ЦП по схемам, содержащим ПЭГ-ИФН-альфа, особенно тех, у кого уровень тромбоцитов < 100 000/мм3 и уровень альбумина сыворотки < 35 г/л до начала лечения (табл. 4) [19]. Поэтому ПВТ у пациентов с ЦП следует проводить в специализированных центрах, обладающих достаточным опытом.
Кроме того, более половины пациентов с ЦП (классы В и С по шкале Чайлда – Пью) имеют противопоказания к использованию ПЭГ-ИФН-альфа и рибавирина, большинство из них нуждается в ПВТ (пятилетняя выживаемость в среднем 50%).
Проведение ПВТ часто лимитировано различными НЯ:
-
повышенный риск инфекционных осложнений и летальных исходов, связанных с инфекцией;
-
очень высокая частота НЯ у больных с классом C по шкале Чайлда – Пью и MELD > 18 [15, 18].
Для пациентов с ЦП класса В по шкале Чайлда – Пью предусмотрен индивидуальный подход в специализированных центрах (рекомендация С2, EASL). Пациентам с ЦП класса С современная тройная терапия с применением ПЭГ-ИФН-альфа не показана (рекомендация А1, EASL).
У пациентов с ЦП ввиду портальной гипертензии и гиперспленизма уровни лейкоцитов и тромбоцитов могут быть исходно низкими [20]. Гематологические НЯ у больных ЦП встречаются чаще, чем у больных без ЦП, и обычно служат противопоказанием к лечению. В этой группе могут применяться факторы роста (уровень рекомендации С2, EASL). Например, агонист рецепторов тромбопоэтина элтромбопаг используется для контроля за уровнем тромбоцитов у пациентов с ЦП, что позволяет проводить терапию ПЭГ-ИФН-альфа. Однако следует помнить, что на фоне приема элтромбопага у пациентов с ЦП повышается риск тромбоза воротной вены. Препарат надо использовать с осторожностью и только для повышения тромбоцитов до безопасного уровня [21].
Перечислим новые положения, касающиеся пациентов, ожидающих трансплантации печени.
1. Пациенты с декомпенсированным ЦП (класс C по шкале Чайлда – Пью) на фоне ПВТ должны находиться под контролем врача-специалиста (в центре трансплантации печени) (класс I, уровень C, AASLD). Пациенты с ЦП (классы В–С) с любым генотипом вируса являются кандидатами на трансплантацию печени (рекомендация A1, EASL) [18].
2. Пациентам, находящимся в листе ожидания, за 30 дней до трансплантации печени для предотвращения инфицирования показана ПВТ (рекомендация A1).
3. Пациентам с ГЦК, которым показана трансплантация печени, с сохраненной функцией печени (класс A по шкале Чайлда – Пью) назначается рибавирин (1000–1200 мг/сут в зависимости от веса) + софосбувир (400 мг/сут) (рекомендация А1).
Для пациентов с ГЦК и сохраненной функцией печени (класс A по шкале Чайлда – Пью), которым показана трансплантация печени, схемой выбора может быть ПЭГ-ИФН-альфа + рибавирин (1000–1200 мг/сут) + софосбувир (400 мг/сут) в течение 12 недель (рекомендация B1) [18].
4. Согласно рекомендациям AASLD перед трансплантацией печени пациентам назначают софосбувир (400 мг/сут) + рибавирин (с учетом клиренса креатинина и уровня гемоглобина) до 48 недель (класс IIb, уровень B).
Пациентам с ЦП (класс С по шкале Чайлда – Пью) не рекомендуется:
-
ПВТ, содержащая ПЭГ-ИФН-альфа (класс III, уровень А, AASLD);
-
монотерапия ПЭГ-ИФН-альфа, рибавирином или DAA (класс III, уровень А, AASLD);
-
схемы, содержащие телапревир, боцепревир, симепревир (класс III, уровень А, AASLD).
Пациенты из группы высокого риска должны быть ориентированы на схемы, не содержащие ИФН, в том числе через программы расширенного доступа [15, 18].
Все пациенты с ЦП в исходе HCV-инфекции, в том числе достигшие УВО, должны регулярно обследоваться на наличие ГЦК (рекомендация A1) [18].
Лечение цирроза печени HBV-этиологии
Основная цель современной ПВТ у больных с хроническим гепатитом В (ХГВ) – предотвратить прогрессирование заболевания, то есть развитие ЦП.
В ЦНИИГ в 2012 г. было обследовано 9617 пациентов, из них HBV-инфекция выявлена у 128 (1,3%). При этом практически у 30% больных вирусная нагрузка превысила 2000 МЕ/мл. ЦП в исходе ХГВ диагностирован у 19 (14,8%) больных [22].
В мировой клинической практике применяется семь препаратов для противовирусного лечения ХГВ. Однако существуют правила выбора и применения указанных препаратов при ЦП (табл. 5).
Доказано, что ПВТ эффективна в подавлении репликации HBV-инфекции, в регрессе процессов воспаления и фиброза, предотвращении прогрессирования заболевания. Однако современные препараты не способны привести к полной эрадикации вируса. При этом HBV-инфекцию необходимо контролировать.
Какие пациенты и когда должны начать терапию?
Для больных с ЦП HBV-этиологии тактика «наблюдать и ждать» не подходит. EASL и AASLD рекомендуют начинать лечение всех пациентов с ЦП, в том числе декомпенсированным, независимо от уровня вирусной нагрузки и активности аланинаминотрансферазы. Кроме того, всем пациентам перед трансплантацией печени назначают ПВТ, что снижает риск рецидива HBV-инфекции после операции.
Итак, что нового в лечении ЦП HBV-этиологии?
Появляется все больше доказательств, что длительное лечение аналогами нуклеозидов (АН) не только предотвращает прогрессирование заболевания, но и изменяет стадию фиброза [22, 23]. Данные клинических исследований фазы III по применению тенофовира (участвовало 348 пациентов, изучали биопсийный материал ПВТ через пять лет) показали, что в 51% случаев фиброз снижался на одну стадию или более, в 74% случаев наблюдался регресс ЦП [24].
Кроме того, имеются данные об эффективности применения АН при декомпенсированном ЦП. Так, продемонстрирована эффективность и безопасность двухлетнего применения комбинации тенофовира и энтекавира у больных с декомпенсированным ЦП. Однако аналогичная эффективность показана в другом исследовании, в ходе которого сравнивали энтекавир и тенофовир. При этом указанные препараты были сопоставимы по эффективности [25, 26].
Все рекомендации указывают на необходимость длительной, часто пожизненной ПВТ с помощью АН в группе пациентов с ЦП HBV-этиологии. Прекращение терапии может рассматриваться у больных с компенсированным ЦП только в случае достижения элиминации HВsAg. После отмены ПВТ все пациенты должны находиться под тщательным наблюдением для исключения рецидива вирусной инфекции и риска развития ГЦК [18, 26].
Лечение осложнений цирроза печени
Лечение осложнений ЦП предполагает терапию:
-
острой печеночной недостаточности;
-
портосистемной энцефалопатии;
-
спонтанного бактериального перитонита;
-
портальной гипертензии (профилактика и лечение кровотечений из варикозно расширенных вен пищевода);
-
асцита;
-
гепаторенального синдрома (ГРС).
Современные достижения в лечении осложнений ЦП во многом представлены в рекомендациях EASL 2010 г. [27].
Асцит – наиболее частое осложнение ЦП. При этом в 50% случаев у пациентов с компенсированным ЦП в течение десяти лет развивается асцит. Отметим, что асцит – главная причина госпитализации больных ЦП [28, 29].
Основным патогенетическим лечением асцитического синдрома является адекватное восполнение альбумина, что на практике не всегда реализуется и имеет неблагоприятные последствия. Крайне важно соблюдать режимы введения и дозирования альбумина в зависимости от сопутствующих факторов и состояний (табл. 6) [27].
Еще один относительно новый момент – ведение пациентов при развитии ГРС. В настоящее время доказано, что стандартом терапии ГРС 1-го типа является медикаментозная терапия с применением терлипрессина и альбумина, что улучшает функцию почек и достоверно повышает выживаемость пациентов. Кроме того, такую терапию можно считать обязательной для пациентов с ГРС, ожидающих трансплантации печени, поскольку после проведения последней у таких пациентов улучшается прогноз [30, 31]. Показано, что у пациентов, получавших терлипрессин, в 50–78% случаев повышалась скорость клубочковой фильтрации > 40 мл/мин. Рекомендуемый режим применения терлипрессина (1–2 мг каждые 4–6 часа внутривенно болюсно) и альбумина (1 г/кг с последующим переходом на 40 г/сут внутривенно капельно) продемонстрировал значительное улучшение микроциркуляции и функции почек. Длительность терапии терлипрессином – максимально до 14 суток. Ишемические побочные эффекты более редкие (5–10%) и мягкие по сравнению с орлипрессином. Кроме того, терлипрессин эффективен в профилактике сосудистой дисфункции после удаления большого объема асцитической жидкости. Противопоказаниями к назначению терлипрессина являются ишемические сердечно-сосудистые заболевания. Поэтому в отношении больных необходим тщательный контроль на предмет развития сердечных аритмий, признаков висцеральной и сердечной ишемии. Любопытно, что рецидивы ГРС 1-го типа после прекращения применения терлипрессина сравнительно редки (уровень A1) [32].
Таким образом, современные мероприятия при развитии ГРС предполагают:
-
отмену диуретиков;
-
антибактериальную терапию в целях профилактики спонтанного бактериального перитонита;
-
инфузии альбумина: 1 г/кг/день в течение 1–3 суток (далее 40 г/сут);
-
инфузии терлипрессина: 1 мг/4–6 ч (одни-двое суток), в отсутствие положительной динамики к третьим суткам (при снижении уровня креатинина менее чем на 25%) – переход на дозу 2 мг/4–6 ч.
В качестве альтернативного способа коррекции ГРС рекомендован октреотид 100 мкг (подкожно) три раза в сутки в сочетании с мидодрином 2,5 мг или норадреналином 0,5–3 мг/ч (внутривенно).
При неэффективности указанных мероприятий рекомендованы трансъюгулярное портосистемное шунтирование (ТИПС), гемодиализ, трансплантация печени [33, 34]. ТИПС – методика, позволяющая выполнить эффективную декомпрессию портальной системы за счет соединения между воротной веной и системной циркуляцией и в конечном итоге устраняющая проявления портальной гипертензии (профилактика и лечение кровотечений из варикозно расширенных вен пищевода и желудка, рефрактерного асцита).
Следует также отметить новые рекомендации AASLD (2014) по лечению печеночной энцефалопатии (ПЭ), а также новые аспекты, касающиеся ведения пациентов данной категории [34].
-
Наличие эпизодов ПЭ (спонтанной или рецидивирующей) требует активного лечения (уровень II-2, А1).
-
Вторичная профилактика ПЭ рекомендуется после первых эпизодов (уровень I, A1).
-
Первичная профилактика для предотвращения эпизодов ПЭ обязательна у больных ЦП (уровень II-3, C2).
-
Рецидивирующая некурабельная ПЭ вместе с печеночной недостаточностью является показанием для трансплантации печени (уровень I).
Рекомендации содержат обязательное требование постоянного мониторинга и исключения провоцирующих факторов ПЭ для пациентов с хроническими заболеваниями печени (уровень II-2, А1).
В плане медикаментозной терапии ПЭ следует учитывать следующие положения [34].
Лактулоза является препаратом первой линии терапии эпизодической и реккурентной ПЭ (уровень II-1, B1). Рекомендуется применение лактулозы (перорально) в небольших количествах, рассчитанных индивидуально (в среднем по 25 мл 2–3 р/сут) до достижения мягкого стула 2–3 р/сут.
Рифаксимин – эффективное средство дополнительной терапии к лактулозе для профилактики рецидива (уровень I, В1).
Аминокислоты с разветвленной цепью могут использоваться в качестве альтернативного или дополнительного способа терапии у пациентов, не отвечающих на традиционную терапию (уровень I, B2).
Л-орнитин-Л-аспартат (внутривенно) можно применять в качестве альтернативного или дополнительного способа терапии пациентов, не отвечающих на традиционную терапию (уровень I, B2). Указано, что пероральный прием Л-орнитина-Л-аспартата недостаточно эффективен.
Неомицин используется в качестве альтернативной терапии ПЭ (уровень II-1, B2).
Метронидазол можно применять как альтернативную терапию ПЭ (уровень II-3, B2).
Заключение
Еще раз отметим новые и эффективные с позиции доказательной медицины положения, которые необходимо применять в лечении пациентов с ЦП.
Использование современных высокоэффективных противовирусных препаратов при ЦП HCV-этиологии в качестве этиотропной терапии в большинстве случаев приводит к элиминации вируса гепатита С и позволяет добиться регресса фиброза и цирроза, достоверно снизить летальность и риск развития ГЦК.
Применение аналогов нуклеозидов с высоким генетическим барьером и высокой антивирусной активностью при ЦП HBV-этиологии обеспечивает длительную супрессию вируса гепатита В, регресс фиброза и цирроза, снижает потребность в трансплантации печени, улучшает качество жизни пациентов.
Подходы к ведению пациентов с осложнениями ЦП постоянно совершенствуются. Новые фармакоагенты для лечения осложнений ЦП появляются нечасто, поэтому необходимо постоянно изучать подходы, получившие подтверждение с позиции доказательной медицины, совершенствовать отечественные и внедрять в клиническую практику международные рекомендации. Это позволит сделать медицинскую помощь пациентам более эффективной.
I.G. Bakulin, Yu.G. Sandler
Moscow Clinical Research and Practical Center of the Moscow Healthcare Department
Moscow State University of Food Production
Contact person: Igor Gennadyevich Bakulin, igbakulin@yandex.ru
It is known that in most cases of HCV-induced liver cirrhosis use of modern highly effective antiviral drugs
as etiotropic therapy results in elimination of hepatitis C virus and lets to reach regression of liver fibrosis
and cirrhosis as well as significantly reduces mortality rate and development of hepatocellular carcinoma.
Here, we present contemporary approaches to treatment of liver cirrhosis of different etiology as well as its complications with regard to evidence-based medicine.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.