Иммуноонкология – новые возможности терапии меланомы кожи
- Аннотация
- Статья
- Ссылки
- English
Меланома кожи является иммуногенной опухолью, то есть способна индуцировать противоопухолевый иммунный ответ. Известны случаи спонтанной регрессии меланомы, когда инфильтрация опухоли цитотоксическими лимфоцитами коррелирует с благоприятным течением заболевания [1]. Эффективность иммунотерапии интерлейкином 2 в высоких дозах вызывает длительные ремиссии у 6% больных [2]. Эффективность терапии интерфероном (ИФН) альфа в ряде случаев [3] свидетельствует о скрытом потенциале данного метода. Однако результаты исследований различных иммунологических подходов, включавших, в частности, цитокины, ЛАК-клетки, вакцины, весьма скромные [4].
Опухоль может ускользать от иммунологического надзора, поэтому развитие методов, позволяющих блокировать это свойство опухоли, остается перспективным направлением противоопухолевой терапии.
Настоящий прорыв в иммунотерапии последних лет связан с изучением регуляторных молекул CTLA-4 (цитотоксический Т-лимфоцитарный антиген 4), а также PD-1 (рецептор программируемой гибели-1), экспрессируемых главным образом на поверхности иммунных клеток [5]. Но эти молекулы могут обнаруживаться и на опухолевых клетках [6, 7].
CTLA-4 блокирует инициацию иммунного ответа на этапе активации наивных Т-лимфоцитов в лимфатическом узле, а PD-1 – реализацию иммунного ответа активированными Т-лимфоцитами в опухоли. Таким образом, эти молекулы играют ключевую роль в регуляции противоопухолевого иммунного ответа [8].
Анти-CTLA-4-терапия
На основании данных доклинических исследований были разработаны моноклональные антитела, блокирующие ингибиторную молекулу CTLA-4 на лимфоцитах. Для клинического применения были синтезированы полностью человеческие моноклональные антитела ипилимумаб и тремелимумаб, блокирующие человеческий CTLA-4.
Ипилимумаб – IgG1-антитело с периодом полувыведения 12–14 дней. Тремелимумаб – IgG2-антитело с периодом полувыведения около 22 дней. Оба препарата широко исследовались у больных диссеминированной меланомой. При этом длительные ремиссии были зарегистрированы при использовании обоих антител.
На основании данных клинического исследования III фазы, продемонстрировавших увеличение общей выживаемости, ипилимумаб был одобрен для лечения больных неоперабельной или метастатической меланомой [9]. При этом клиническое исследование III фазы тремелимумаба было остановлено, поскольку промежуточный анализ не показал улучшения общей выживаемости (ОВ) больных по сравнению с химиотерапией [10]. Тем не менее отрицательные результаты при меланоме не стали препятствием для изучения эффективности тремелимумаба в лечении других опухолей.
Клиническая эффективность ипилимумаба показана в рандомизированном двойном слепом клиническом исследовании III фазы с участием 676 больных диссеминированной меланомой кожи. Все пациенты ранее получали лечение (до семи линий терапии) [9]. Терапия проводилась в трех группах. Пациенты первой группы получали ипилимумаб в дозе 3 мг/кг внутривенно каждые три недели до четырех введений, пациенты второй – вакцину gp100 в монотерапии, пациенты третьей – ипилимумаб в комбинации с вакциной. Терапия ипилимумабом увеличивала медиану ОВ в отличие от применения вакцины (10,1 против 6,4 месяца; р = 0,003). Годичная ОВ в группе ипилимумаба составила 45,6%, двухлетняя – 23,5%. Больным, достигшим объективного ответа на лечение или длительной стабилизации заболевания (≥ 24 недель), на фоне прогрессирования заболевания проводили реиндукцию – повторное лечение в том же режиме. Его получили 40 пациентов: 29 из группы ипилимумаба + gp100, девять из группы монотерапии ипилимумабом, двое из группы вакцины gp100 [9].
В 2011 г. ипилимумаб был одобрен FDA (Food and Drug Administration – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) и EMEA (European Medicines Agency – Европейское агентство лекарственных средств) для лечения больных метастатической меланомой в дозе 3 мг/кг внутривенно, четыре введения с интервалом три недели.
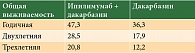
Во втором рандомизированном клиническом исследовании III фазы, в котором сравнивали эффективность комбинации ипилимумаба и дакарбазина с монотерапией дакарбазином, участвовали 502 пациента с диссеминированной меланомой кожи, не получавших ранее лечения. Ипилимумаб вводили в дозе 10 мг/кг внутривенно каждые три недели до четырех введений. Далее лечение проводили каждые три месяца. Терапия комбинацией ипилимумаба и дакарбазина увеличивала медиану ОВ больных по сравнению с химиотерапией (11,2 против 9,1 месяца), а также годичную, двух- и трехлетнюю ОВ (табл. 1) [11].
Ипилимумаб также активен при метастатическом поражении головного мозга, когда прогноз заболевания особенно неблагоприятен. В клиническом исследовании II фазы лечение ипилимумабом проводили 51 пациенту с метастазами меланомы в головной мозг. При этом в четырех случаях зарегистрирован частичный ответ, в пяти − стабилизация заболевания. Суммарный контроль над заболеванием составил 18% (у девяти из 51 больного) [12].
Отличительной особенностью ипилимумаба является медленное развитие ответа на лечение (в течение нескольких месяцев), что ограничивает его применение в случае стремительного прогрессирования заболевания. В то же время достигнутая ремиссия может сохраняться длительно (несколько лет). Пациентам со стабилизацией заболевания не требуется дополнительное лечение на протяжении долгого периода времени. При этом эффективность препарата не зависит от статуса мутации BRAFV600 [13].
На сегодняшний день накоплен большой опыт применения ипилимумаба у больных метастатической меланомой. Cвыше 4800 пациентов принимали участие в клинических исследованиях, программах расширенного доступа, а также получали лечение в рамках клинической практики [14]. Согласно имеющимся данным, трехлетняя ОВ больных, получавших ипилимумаб, достигает 20%, семь лет переживают 17% пациентов. Таким образом, после трех лет наблюдения кривая ОВ выходит на плато. При этом наиболее длительный период наблюдения за пациентами с момента начала терапии ипилимумабом составил 9,9 года [14].
В рандомизированном плацебоконтролируемом исследовании III фазы ипилимумаб продемонстрировал эффективность в адъювантном режиме у больных меланомой кожи с метастазами в лимфатические узлы после радикального хирургического лечения и получил одобрение FDA по этому показанию в 2015 г. [15]. Доза ипилимумаба в адъювантном режиме была значительно выше, чем в терапевтическом, одобренном для лечения метастатической меланомы. Ипилимумаб вводили в дозе 10 мг/кг внутривенно каждые три недели до четырех введений, а далее каждые три месяца до трех лет. В настоящее время изучается (исследование NCT01274338) сравнительная эффективность ипилимумаба в адъювантном режиме в дозах 10 и 3 мг/кг и ИФН-альфа в высоких дозах.
Проводится поиск предсказательных маркеров клинической эффективности ипилимумаба.
Нежелательные явления (НЯ), развивающиеся на фоне применения ипилимумаба, в основном обусловлены его механизмом действия и считаются иммуноопосредованными. Неспецифическая активация иммунной системы ипилимумабом способна приводить к развитию широкого спектра аутоиммунных НЯ, в частности кожной сыпи, колита, гепатита, гипофизита, тиреоидита, панкреатита, увеита, миопатии, нейропатии. В целом, перечисленные НЯ контролируемы и в большинстве случаев обратимы. В зависимости от тяжести НЯ лечебные мероприятия могут включать использование местных и системных глюкокортикостероидов (ГКС), не влияющих на эффективность противоопухолевого лечения, а также более сильных иммуносупрессивных препаратов из группы ингибиторов фактора некроза опухоли альфа. В настоящее время разработаны алгоритмы выявления и лечения НЯ, обусловленных приемом ипилимумаба [16].
Анти-PD-1-терапия
Ингибирование рецептора PD-1 на поверхности цитотоксических Т-лимфоцитов или их лигандов PD-L1 и PD-L2 на опухолевых клетках и регуляторных лимфоцитах помогает активированным противоопухолевым лимфоцитам преодолевать защиту опухолевых клеток и уничтожать их.
На текущий момент несколько моноклональных антител против PD-1/PD-L1 проходят клинические испытания при широком спектре опухолей. Некоторые из них уже одобрены FDA и применяются не только при меланоме, но и немелкоклеточном раке легкого, раке почки, плоскоклеточном раке головы и шеи, лимфоме Ходжкина.
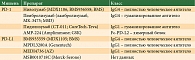
Первые доказательства эффективности данного направления получены в двух исследованиях I фазы ниволумаба и пембролизумаба, в которых участвовали соответственно 296 и 135 больных метастатической меланомой, ранее получавших системное лечение, в том числе ингибиторами BRAF (табл. 2) [17, 18]. Результаты обнадеживающие: частота объективных ответов для ниволумаба составила 41%, для пембролизумаба – 52%. Среди НЯ отмечались лимфоцитопения, слабость, увеличение уровня липазы в сыворотке крови, диарея, эндокринные нарушения, гепатит.
Ниволумаб – полностью человеческое моноклональное антитело IgG4, которое блокирует PD-1 – ключевой ингибирующий рецептор, экспрессируемый на активированных Т-клетках.
CheckMate-037. В рандомизированном исследовании III фазы CheckMate-037 сравнивали эффективность ниволумаба с таковой стандартной химиотерапии у 405 больных метастатической меланомой, резистентной к ипилимумабу и ингибиторам BRAF [19]. Частота объективных ответов при лечении ниволумабом составила 38%, на фоне стандартной химиотерапии – 5%. При промежуточном анализе данных медиана продолжительности ответа на ниволумаб не была достигнута, тогда как при проведении химиотерапии она составила только 3,6 месяца. Результаты также подтвердили хорошую переносимость ниволумаба. НЯ 3–4-й степени, зафиксированные лишь у 5% больных, были связаны с повышением уровня липазы и печеночных ферментов, анемией и слабостью. В группе химиотерапии НЯ зарегистрированы в 9% случаев [20].
На основании результатов этого исследования ниволумаб в 2014 г. получил ускоренное одобрение FDA для лечения метастатической меланомы кожи. В 2015 г. препарат был одобрен EMEA.
CheckMate-066. В рандомизированном исследовании III фазы CheckMate-066 сравнивали эффективность ниволумаба с таковой дакарбазина у больных метастатической меланомой (n = 418, соотношение 1:1) без мутации BRAF в опухоли, ранее не получавших лечение. Годичная ОВ в группе ниволумаба составила 72,9%, в группе дакарбазина – 42,1% (относительный риск (ОР) 0,42; 99,79%-ный доверительный интервал (ДИ) 0,25–0,73; р < 0,001). Частота объективных ответов достигла 40% на фоне применения ниволумаба и 13,9% – при использовании дакарбазина (ОР 4,06; р < 0,001). Ниволумаб также продемонстрировал преимущество в выживаемости без прогрессирования (ВБП). ВБП в группе ниволумаба составила 5,1 месяца, в группе дакарбазина – 2,2 месяца (ОР 0,43; 95% ДИ 0,34–0,56; р < 0,001) [21].
Преимущество в ОВ наблюдалось во всех подгруппах пациентов независимо от уровня экспрессии PD-L1-лиганда на опухолевых клетках. Показатель профиля безопасности не отличался от такового в клинических исследованиях ранних фаз, новых осложнений не зарегистрировано. НЯ 3–4-й степени при использовании ниволумаба и дакарбазина имели место в 12 и 18% случаев соответственно. НЯ на фоне применения ниволумаба были хорошо управляемы и обратимы при использовании ГКС.
Ниволумаб продемонстрировал преимущество в общей и безрецидивной выживаемости как у пациентов после предшествующей терапии, так и у пациентов, ранее не получавших лечения.
Другим блокатором рецептора PD-1, который сегодня находится в центре внимания исследователей, является пембролизумаб – высоко селективное гуманизированное моноклональное антитело к PD-1. В 2014 г. препарат был ускоренно одобрен FDA, а в 2015 г. – EMEA для лечения больных метастатической меланомой кожи.
KEYNOTE-001. Одобрение пембролизумаба было основано на результатах расширенного клинического исследования I фазы KEYNOTE-001, которое началось еще в 2011 г. В исследовании оценивали эффективность и безопасность пембролизумаба в дозе 2 или 10 мг/кг и разных режимах (каждые две или три недели) у больных диссеминированной меланомой кожи при неэффективности предшествующей терапии. Обобщенный анализ KEYNOTE-001 включал данные о 655 пациентах [22]. Частота объективных ответов у всей популяции больных составила 33%, полные ответы зарегистрированы в 8% случаев. Факторами, которые неблагоприятно сказывались на эффективности лечения, оказались повышенный уровень лактатдегидрогеназы и большой объем опухолевой массы. Доза пембролизумаба и режим введения существенно не влияли на эффективность терапии. Медиана ОВ и ВБП на фоне пембролизумаба составила 23,8 и 4,4 месяца, годичная, двух- и трехлетняя ОВ – 66, 49 и 40% соответственно. Большинство ответов на лечение были длительными, медиана продолжительности ответа не достигнута. В первой линии терапии пембролизумаб продемонстрировал более высокие показатели эффективности (частота объективных ответов – 45,1%, из них полных − 13,5%).
Отмечался благоприятный профиль токсичности пембролизумаба. Наиболее частыми НЯ были слабость, кожный зуд и сыпь. НЯ 3–4-й степени наблюдались у 14% больных [22, 23].
KEYNOTE-002. В рандомизированном исследовании II фазы KEYNOTE-002 оценивали эффективность и безопасность пембролизумаба у больных метастатической меланомой, резистентной к ипилимумабу и ингибиторам BRAF/MEK. 540 пациентов в соотношении 1:1:1 были рандомизированы на три группы. 180 пациентов первой группы получали пембролизумаб в дозе 2 мг/кг каждые три недели, 181 больной второй группы – пембролизумаб в дозе 10 мг/кг каждые три недели. В третьей группе (n = 179) проводилась химиотерапия по выбору исследователя. В дальнейшем 98 (55%) из 179 больных были переведены на лечение пембролизумабом. Исследование было открытым по типу лечения.
Пембролизумаб показал достоверное улучшение ВБП по сравнению с химиотерапией: ОР 0,57; 95% ДИ 0,45–0,73; p < 0,0001 – для пембролизумаба в дозе 2 мг/кг и ОР 0,50; 95% ДИ 0,39–0,64; p < 0,0001 – для пембролизумаба в дозе 10 мг/кг. Медиана ОВ для пембролизумаба в дозах 2 и 10 мг/кг, а также для химиотерапии составила 13,4, 14,7 и 11,0 месяца, двухлетняя ОВ – 36, 38 и 30% соответственно. При этом достоверного различия в ОВ не получено: ОР 0,86; 95% ДИ 0,67–1,10; p = 0,1173 – для пембролизумаба в дозе 2 мг/кг и ОР 0,74; 95% ДИ 0,57–0,96; p = 0,0106 – для пембролизумаба в дозе 10 мг/кг по сравнению с химиотерапией. Скорее всего это обусловлено переводом 55% больных из группы химиотерапии на лечение пембролизумабом. Частота объективных ответов на фоне приема пембролизумаба в дозах 2 и 10 мг/кг, а также при использовании химиотерапии составила 22, 28 и 4% соответственно. НЯ 3–5-й степени отмечались у 13, 17 и 26% больных соответственно [24].
KEYNOTE-006. В крупном рандомизированном клиническом исследовании III фазы KEYNOTE-006 сравнивали эффективность пембролизумаба и ипилимумаба у больных метастатической меланомой кожи. 834 пациента были рандомизированы в группы терапии пембролизумабом в дозе 10 мг/кг каждые две недели (n = 279) или каждые три недели (n = 277) и группу ипилимумаба до четырех введений в стандартной дозе 3 мг/кг каждые три недели (n = 278) [25].
Первый промежуточный анализ показал достоверное улучшение ВБП при терапии пембролизумабом по сравнению с ипилимумабом: ОР 0,58; 95% ДИ 0,46–0,72; p < 0,001 – для режима введения каждые две недели и ОР 0,58; 95% ДИ 0,47–0,72; p < 0,001 – для режима введения каждые три недели. Показатели шестимесячной ВБП для групп пембролизумаба, а также ипилимумаба составили 47,3, 46,4 и 26,5%, медиана ВБП – 5,5, 4,1 и 2,8 месяца соответственно. Достоверное преимущество ВБП после терапии пембролизумабом по сравнению с ипилимумабом отмечалось во всех группах пациентов (по статусу ECOG, линии терапии, мутации BRAF). Пембролизумаб был эффективнее ипилимумаба независимо от экспрессии PD-L1 [25]. 24-месячная ВБП в двух группах пембролизумаба в среднем в два раза превышала таковую в группе ипилимумаба: 31 и 28% – для пембролизумаба, 14% – для ипилимумаба [26].
Годичная ОВ в группах терапии пембролизумабом каждые две или три недели, а также в группе ипилимумаба составила 74,1% (ОР 0,63; 95% ДИ 0,47–0,83; p < 0,0005), 68,4% (ОР 0,69; 95% ДИ 0,52–0,90; p < 0,0036) и 58,2% соответственно. В связи с полученными данными об эффективности пембролизумаба пациентам, у которых отмечалось прогрессирование заболевания после применения ипилимумаба, был разрешен перевод в группу терапии пембролизумабом.
На ASCO-2016 были представлены данные о 24-месячной ОВ. Два года прожили 55% пациентов из группы пембролизумаба (независимо от режима дозирования) и 43% пациентов из группы ипилимумаба. Медиана ОВ была достигнута только в группе ипилимумаба и составила 16 месяцев (95% ДИ 13,5–22,0). В группах терапии пембролизумабом медиана ОВ не достигнута [26].
Частота ответов составила 37 и 36% в двух группах пембролизумаба и 13% – в группе ипилимумаба. При этом частота полных ответов на фоне применения пембролизумаба в среднем в 2,5 раза превышала таковую на фоне приема ипилимумаба (пембролизумаб – 12 и 13%, ипилимумаб – 5%). Ответы на лечение во всех группах были длительными [26].
НЯ 3–5-й степени, обусловленные терапией, в группах пембролизумаба каждые две или три недели и ипилимумаба составили 13,3, 10,1 и 19,9% соответственно. Самыми частыми НЯ для пембролизумаба были слабость, диарея, сыпь, зуд, а для ипилимумаба – зуд, диарея, слабость, сыпь [25].
В настоящее время другие препараты, ингибирующие рецепторы PD-1 (например, пидилизумаб), проходят клинические исследования и уже показали значимую клиническую активность.
Комбинированная терапия анти-CTLA-4- и анти-PD-1-антителами
Получены клинические результаты комбинированного применения анти-PD-1- и анти-CTLA-4-антител [27]. При одновременном назначении ипилимумаба в дозе 3 мг/кг и ниволумаба в дозе 1 мг/кг у пациентов с метастатической меланомой, ранее получавших лечение, частота объективных ответов достигла 53%. Причем у большинства больных уменьшение размеров опухолевой массы превысило 80%. Очевидно, что комбинация более эффективна, чем каждый препарат в отдельности. Эти результаты были подтверждены данными рандомизированного исследования, в котором эффективность комбинации ипилимумаба и ниволумаба сравнивали с таковой монотерапии каждым препаратом у пациентов с метастатической меланомой в первой линии лечения [28]. Частота объективных ответов и медиана ВБП в группе комбинированной терапии составили 57,6 и 11,5 месяца соответственно. Причем у 11,5% больных зафиксирован полный ответ.
Следует отметить, что одновременное назначение ипилимумаба и ниволумаба сопровождалось более высокой токсичностью. НЯ 3–4-й степени зарегистрированы более чем у половины пациентов (53–55%). Наиболее частыми из них были диарея, колит и подъем уровня печеночных трансаминаз (аланинаминотрансферазы). Назначение иммуносупрессивной терапии, включая топические ГКС, потребовалось 83,4% пациентов. Частота разрешения НЯ 3–4-й степени в зависимости от локализации варьировалась от 85 до 100%. Как и ожидалось, большинство эндокринопатий требовали постоянной гормонозаместительной терапии. В 2016 г. комбинация ипилимумаба и ниволумаба для лечения метастатической меланомы кожи была одобрена как FDA, так и EMEA.
Анти-PD-L1-терапия
Получены предварительные данные, подтверждающие эффективность препаратов, относящихся к группе ингибиторов PD-L1, хотя и с менее высокой частотой объективных ответов.
Атезолизумаб (MPDL3280A) – человеческое моноклональное антитело с синтезированным Fc-доменом для оптимизации эффективности и безопасности. Мишенью препарата является PD-L1, действие опосредовано блокированием связывания PD-L1 с рецепторами, включая PD-1 и B7.1.
В исследовании клинической эффективности и безопасности препарата MPDL3280A его вводили больным метастатической меланомой в нескольких дозовых режимах (от 1 до 20 мг/кг) внутривенно каждые три недели до года. Более половины пациентов ранее получали системную терапию. Медиана продолжительности лечения MPDL3280A составила 127 дней. Показатели эффективности оценены у 35 пациентов, получавших препарат в дозах 1–20 мг/кг. Частота ответа на лечение составила 26% (9 из 35 пациентов). Кроме того, у ряда больных уменьшение размеров опухоли отмечалось уже через несколько дней после начала терапии. 24-недельная ВБП достигла 35%. У некоторых пациентов наблюдалась отсроченная противоопухолевая активность после прогрессирования заболевания. Анализ опухолевых образцов показал корреляцию между экспрессией PD-L1 и эффективностью проводимой терапии. НЯ выражались гипергликемией, повышением уровня печеночных ферментов в сыворотке крови [29].
Проводятся дальнейшие клинические исследования MPDL3280A при меланоме и других опухолях, в монотерапии и комбинациях (исследования NCT01656642, NCT01633970 и др.). Недавно атезолизумаб был одобрен FDA для лечения уротелиального рака.
Заключение
Достижения в области молекулярной биологии и иммуноонкологии открыли новую страницу в лечении меланомы. Препараты, устраняющие негативную регуляцию иммунного ответа, позволяют достигать длительной ремиссии у значительной части больных метастатической меланомой. Новые иммуноонкологические препараты коренным образом изменили стратегию лечения меланомы кожи и ее прогноз, а также установили новый лечебный стандарт для диссеминированной меланомы.
В настоящее время в мире зарегистрированы три иммуноонкологических препарата (ипилимумаб, ниволумаб, пембролизумаб) и комбинация «ипилимумаб + ниволумаб» для лечения нерезектабельной меланомы III стадии и метастатической меланомы IV стадии независимо от наличия BRAF-мутации. В России первым зарегистрированным препаратом этого класса стал ипилимумаб, одобренный в мае 2016 г. для применения у пациентов с метастатической меланомой после прогрессирования заболевания на фоне стандартной терапии.
Внедрение новых препаратов в клиническую практику позволяет добиваться длительного контроля над заболеванием у значительной части онкологических больных.
N.N. Petenko, G.Yu. Kharkevich, I.V. Samoylenko, L.V. Demidov
N.N. Blokhin Russian Cancer Research Center
Contact person: Nataliya Nikolayevna Petenko, n.petenko@gmail.com
Treatment of metastatic skin melanoma is a serious problem, as standard drug therapy does not influence total patient survival. Despite a great number of studies on immunotherapy in melanoma, first noticable success was experienced after emergence of the next-generation immunotherapeutic drugs inhibiting regulatory molecules in immune surveillance. The major immuno-oncology drugs as well as results from valuable clinical studies in disseminated melanoma are reviewed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.