Хумалог – эффективный и безопасный регулятор прандиальной гликемии у разных популяций больных сахарным диабетом
- Аннотация
- Статья
- Ссылки
К 2025 году прогнозируется рост числа больных до 380 млн человек, а это каждый 14-й взрослый человек. Смерть по причине СД и его осложнений происходит каждые 10 секунд. Диабет уносит около 4 млн жизней в год и считается четвертой из наиболее частых причин смерти в индустриально развитых странах. Около 6 млн человек в мире болеют СД 1 типа. Значительная часть больных СД 2 типа не знают о том, что они больны; диагноз обычно ставится тогда, когда в организме больного уже развились необратимые изменения.
В России СД и его осложнения занимают третье место по уровню смертности после сердечно-сосудистых и онкологических заболеваний. Россия, наряду с Индией, Китаем, США и Германией, входит в пятерку стран с наибольшей заболеваемостью СД. Диагностика СД 2 типа в России – одна из самых низких в мире: 3/4 людей с СД (более 8 млн человек) не подозревают о наличии у них данного заболевания.
СД болеют люди трудоспособного возраста. При этом рост заболеваемости связан с избыточной массой тела. Стремительно увеличивается доля населения с метаболическим синдромом, который предшествует развитию диабета и возникает на фоне ожирения, неумеренного употребления высококалорийной пищи и малоподвижного образа жизни. Более того, в конце XX в. выявились процессы, которые не наблюдались в течение всей истории медицины – СД 2 типа стали заболевать дети. По данным Международной диабетической федерации, ежедневно им заболевают около 200 детей, что связано с ожирением, перееданием и гиподинамией, при этом средняя продолжительность жизни детей, страдающих СД, не превышает 28,3 года от начала заболевания.
В настоящее время во всем мире накоплены доказательства того, что эффективный контроль СД может свести до минимума или предотвратить многие из связанных с ним осложнений. В отношении эффективного управления СД существуют убедительные доказательства, свидетельствующие, что снижение веса, улучшение гликемического контроля может значительно уменьшить частоту встречаемости макроангиопатических осложнений у пациентов с СД 1 или 2 типа.
До недавнего времени доминирующий фокус терапии заключался в снижении уровней гликированного гемоглобина (HbA1c) с особым акцентом на показатели гликемии натощак. Однако несмотря на то, что контроль гликемии натощак необходим, обычно его недостаточно. В настоящее время получено достаточное количество данных, которые показывают, что снижение показателей постпрандиальной (после еды) глюкозы плазмы не менее важно для достижения целевых показателей HbA1c (1, 2).
На сегодня вылечить СД невозможно, но им можно хорошо управлять и позволить пациентам жить полноценной жизнью. Принципиально важным моментом являются объективные цифровые критерии компенсации СД – значения «гликемической триады» (HbA1c, глюкоза плазмы натощак и постпрандиальная гликемия), которые напрямую зависят от выбора медикаментозной терапии и образа жизни.
Уровень ГПН (глюкоза плазмы натощак) может колебаться при погрешностях терапии – таких, как повышенная вариабельность действия базальных препаратов инсулина. В нормальных физиологических условиях уровень ГПН определяется продукцией глюкозы клетками печени и контролируется эндогенной выработкой инсулина. Пациентам с СД, когда секреция инсулина снижена относительно имеющегося уровня гликемии в организме, необходима соответствующая терапия, которая должна интенсифицироваться по мере прогрессирования заболевания.
Данные исследования UKPDS показали, что поддержание целевого уровня ГПН может снизить уровень HbA1с и риск развития осложнений диабета, таких как ретинопатия и нефропатия. При неудовлетворительном контроле СД снижение уровня ГПН обеспечит максимально быстрое улучшение, так как этот параметр вносит наибольший вклад в формирование уровня HbA1с.
Можно ли целенаправленно контролировать уровень ГПН? Исследования с участием пациентов с СД 2 типа показали, что титрация доз базального инсулина или двухфазного инсулинового аналога (в комбинации с ПССП) с учетом рекомендованных целевых значений ГПН (например, < 6,0 ммоль/л) может обеспечить снижение уровня ГПН до < 7 ммоль/л и HbA1с < 7% в течение 6 месяцев. Уровень ГПН можно эффективно контролировать, применяя новые базальные и двухфазные инсулиновые аналоги.
В исследовании Kumamoto использовался режим многократных инъекций инсулина для контроля как гликемии натощак, так и постпрандиального уровня гликемии у пациентов с СД 2 типа. В результате было выявлено, что при уровне гликемии натощак < 6,1 ммоль/л и уровне гликемии через 2 часа после приема пищи < 10 ммоль/л снижается развитие осложнений СД (ретинопатии и нефропатии). Таким образом, предполагается, что необходим контроль двух параметров: снижение постпрандиальной гликемии и снижение гликемии натощак для предупреждения развития осложнений.
В последние годы ряд исследований продемонстрировал роль постпрандиальной гипергликемии в развитии и прогрессировании сосудистой патологии. Было показано, что постпрандиальное повышение гликемии так же, а может быть, и более серьезно влияет на риск развития осложнений СД, чем гипергликемия натощак. Не секрет, что как среди пациентов, так и среди врачей существует определенный стереотип в отношении контроля только гликемии натощак, в то время как длительность постпрандиального состояния по времени значительно превышает длительность состояния натощак.
Реально состояние натощак наступает после периода завершившегося всасывания или постабсорбционного цикла, длительность которого составляет около 6 ч от момента последнего приема пищи. С учетом как минимум трехразового питания у лиц без нарушения углеводного обмена при 4-часовой длительности каждого постпрандиального периода общая продолжительность постпрандиальной фазы составляет по меньшей мере 12 ч. Оставшиеся 12 ч распределяются между постабсорбционным периодом и фазой натощак. Принимая во внимание, что продолжительность каждого постабсорбционного периода составляет 6 ч, имеет место перекрывание постпрандиального и постабсорбционого периодов в дневное время суток, а на фазу натощак с учетом последнего приема пищи в 19:00 остается около 4 ч. У больного СД 2 типа постпрандиальное повышение гликемии значительно более выражено, больше по продолжительности и отличается большей вариабельностью по сравнению со здоровыми лицами. Таким образом, для контроля диабета определение и нормализация показателей гликемии после еды имеет такое же большое значение, как измерение сахара крови натощак.
Постпрандиальная гликемия означает уровень глюкозы крови через 2 ч после начала приема пищи.
Доказано, что постпрандиальная гипергликемия (ППГ), а не гликемия натощак непосредственно влияет на развитие атеросклероза, инфаркта миокарда и смертность (3, 4). В связи с этим постпрандиальный уровень глюкозы, отражающий состояние метаболического контроля, включен в качестве важного показателя в международные рекомендации по лечению диабета.
Столь серьезное внимание, уделяемое этому вопросу, не случайно и продиктовано тем, что человек не в состоянии натощак, а после приема пищи проводит большую часть своей активной жизни. У здоровых людей уровень гликемии ограничивается пиковым значением < 7,7 ммоль/л через 1-1,5 ч после приема пищи, однако средняя концентрация глюкозы редко превышает 5,5 ммоль/л на период более 30 мин. после еды. Уже через 3 ч после еды гликемия достигает препрандиального уровня, несмотря на процессы абсорбции, продолжающиеся еще в течение 5-6 ч после приема пищи.
Очевидна важность ограничения резких колебаний концентрации глюкозы для предотвращения нефизиологических гипергликемических пиков после еды у больных СД. Кроме того, между ППГ и концентрацией глюкозы натощак и до приема пищи существует четкая связь: невозможность справиться с ППГ-пиками приводит к повышению уровня гликемии в течение дня (5).
У лиц с нормальной толерантностью к глюкозе уровень глюкозы в плазме обычно не превышает 7,8 ммоль/л (140 мг%) в качестве ответной реакции на прием пищи и обычно возвращается к показателям, имевшимся до приема пищи, в течение 2-3 ч. По определению ВОЗ, нормальной считается толерантность к глюкозе при уровне глюкозы плазмы < 7,8 ммоль/л (140 мг%) через 2 ч после нагрузки 75 г глюкозы в рамках проведения перорального теста толерантности к глюкозе. Постпрандиальной гипергликемией считается показатель глюкозы в плазме > 7,8 ммоль/л (140 мг%) через 2 ч после начала приема пищи.
ППГ является независимым фактором риска развития макроангиопатических осложнений. Также с высокой степенью доказательности можно утверждать, что ППГ ассоциируется с повышенным риском ретинопатии, с утолщением intima-media сонных артерий, со снижением миокардиального кровотока, с увеличением риска развития рака, с нарушением когнитивной функции у лиц пожилого возраста, а также приводит к развитию оксидативного стресса, воспаления и эндотелиальной дисфункции (6).
Таким образом, постпрандиальная гликемия вызывает серьезные осложнения и ее необходимо контролировать. Многочисленные исследования доказали, что применение препаратов, снижающих постпрандиальный уровень глюкозы плазмы, способствует и снижению частоты развития сосудистых осложнений. Терапия, направленная на снижение показателей как гликемии натощак (ГКН), так и постпрандиальной гликемии, является стратегически важной для достижения оптимального гликемического контроля через призму профилактики диабетических осложнений. Становится ясно, что внедрение в практику стратегии, направленной на нормализацию показателей постпрандиальной гликемии, абсолютно необходимо.
ППГ является широко распространенным явлением среди лиц с СД 1 и 2 типа и может отмечаться, даже если средние показатели метаболического контроля представляются адекватными при оценке по уровню HbA1c.
Накапливается все больше научных данных о патофизиологических последствиях ППГ, вносящих серьезный вклад в риск развития и прогрессирования атеросклероза. Острая ППГ вызывает активацию свертывающей системы крови, функции тромбоцитов, повышает активность ренин-ангиотензин-альдостероновой системы (8, 9). В условиях персистирующей гипергликемии формируются количественные и качественные изменения липидного профиля атерогенного характера. Другие последствия ППГ – увеличение образования протеинкиназы С, активирующей выработку сосудосуживающих факторов, снижение биологической активности NO, клеточный оксидативный стресс, активация NF-kВ рецепторов и как следствие – развитие эндотелиальной дисфункции и атерогенеза (1). Более того, гипергликемия нарушает продукцию матрикса эндотелиоцитами, что ведет к утолщению основной мембраны, увеличивает синтез эндотелиальными клетками коллагена IV типа и фибронектина с увеличением активности ферментов, вовлеченных в синтез коллагена (2).
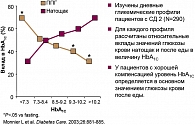
В исследовании, проведенном в 2003 г. Monnier с коллегами (10), проанализировали дневной гликемический профиль 290 пациентов с СД 2 типа, не принимающих инсулин и акарбозу, посредством вычисления площади под кривой (AUC). Предметом исследования являлись образцы венозной крови, полученные в 8:00 перед завтраком (глюкоза крови натощак), 11:00, 14:00 (через 2 ч после ланча) и в 17:00.
С использованием полученных 4 значений был построен график зависимости концентрации глюкозы крови от времени (профиль гликемический), при этом за нулевой (базовый) уровень принималось значение глюкозы крови 6,1 ммоль/л (110 мг/дл). Площадь под полученной кривой и над базовой линией (AUC2) отражает суммарный вклад от уровня глюкозы крови натощак и после еды в течение дня. Используя построенный график, были рассчитаны еще две площади: площадь под кривой, ограниченная снизу уровнем глюкозы крови натощак (AUC1), определяет вклад концентрации глюкозы после еды, оставшаяся часть общей площади (AUC2 – AUC1) рассматривается как вклад, определяемый концентрацией глюкозы крови натощак.
Полученные данные были разбиты на 5 групп (в зависимости от исходного значения HbА1с). Линии на графике показывают относительные вклады значений глюкозы крови натощак и после еды в величину HbА1с. Относительный вклад уровня глюкозы крови после еды в величину HbА1с уменьшается с ростом значения HbА1с. И наоборот, вклад концентрации глюкозы крови натощак в общую величину HbА1с увеличивается с ростом значения HbА1с (рисунок 1).
Авторы пришли к выводу, что уровень глюкозы крови после еды играет основную роль у пациентов с малой или средней гипергликемией. Даже для самых высоких из изученных величин HbА1с уровень глюкозы после еды составляет 1/4 часть от полной дневной гипергликемии.
Доказано, что относительный вклад уровня глюкозы плазмы после еды в средние показатели гликемии увеличивается по мере снижения уровня HbA1c. Monnier и коллеги показали, что у пациентов с уровнями HbA1c < 7,3% вклад постпрандиальной гликемии в уровень HbA1c составлял около 70%, когда же уровни HbA1c были выше 9,3%, вклад постпрандиальной гликемии составлял около 40%.
Ниже представлены основания выбора целевых значений 2-часовой ППГ на уровне 7,8 ммоль/л:
- лица без СД редко характеризуются повышением глюкозы крови через 1 ч после еды до 7,8 ммоль/л (140 мг/дл);
- доказано, что у лиц без СД уровень глюкозы крови поддерживается в очень строгом диапазоне, что доказывает важность постпрандиальных уровней гликемии;
- АДА расценивает уровень 2-часовой постпрандиальной гликемии выше 7,8 ммоль/л (140 мг/дл) как нарушенный (НТГ);
- АДА расценивает НТГ и повышение уровней гликемии в состоянии не натощак как фактор повышения риска развития осложнений;
- ППГ имеет мощную корреляцию с сердечно-сосудистыми заболеваниями и может быть независимым фактором риска развития макроваскулярных заболеваний.
В исследовании DECODE (одном из самых крупных и продолжительных наблюдений) были использованы данные анализа 10 проспективных когортных исследований из различных стран Европы, включивших 15388 мужчин и 7126 женщин в возрасте от 30 до 89 лет. Сравнивались роль показателей гликемии натощак и 2-часовой постпрандиальной гликемии в качестве предикторов смертности. В результате были получены уникальные данные: независимо от уровня гликемии натощак (норма, нарушение уровня глюкозы натощак или выявление показателя, диагностического для СД) риск смертности был в среднем в 2 раза выше при постпрандиальной гипергликемии в рамках НТГ или СД. Итак, высокий уровень постпрандиальной гликемии является также важным предиктором сердечно-сосудистой и общей смертности (11).
Повышенный в 2 раза риск смертности при постпрандиальной гипергликемии – неоспоримый критерий важности контроля ППГ. В связи с этим особое значение приобретают сахароснижающие препараты, устраняющие постпрандиальную гипергликемию и восстанавливающие первую фазу секреции инсулина.
Механизм действия акарбозы основан на ингибировании альфа-глюкозидаз, ферментов, расщепляющих полисахариды. Препарат оказывает свое действие только в кишечнике и препятствует повышению гликемии.
Производные D-фенилаланина взаимодействуют с рецепторами на b-клетках и стимулируют выброс инсулина для нормализации постпрандиальной гликемии. Восстановление первой фазы секреции b-клетками возлагается и на препараты – производные сульфонилмочевины, которые, также влияя на рецепторы на поверхности b-клеток, стимулируют выброс инсулина в условиях гипергликемии.
Инкретиномиметики и блокаторы ДПП-4 – современные лекарственные средства, влияющие на постпрандиальную гликемию через инкретиновый механизм. При безуспешности достижения удовлетворительных показателей гликемии и целевого уровня HbA1c, не превышающего 7,0%, рекомендована ранняя инсулинотерапия. А так как лечение СД должно включать воздействия, благоприятно влияющие на гипергликемию в постпрандиальном состоянии, то возникает необходимость назначения инсулинов короткого действия перед основными приемами пищи.
Инсулинотерапия сахарного диабета
Эра инсулинотерапии началась с прошлого столетия. Инсулин был открыт в начале 1920-х годов в Университете Торонто (Онтарио, Канада). За этот, можно сказать, небольшой срок был достигнут значительный прогресс в разработке препаратов инсулина. Основные направления этих разработок – получение препаратов с различным профилем действия, получение высокоочищенных инсулинов, применение рекомбинантной ДНК-технологии для производства препаратов инсулина и, наконец, появление инсулинов-аналогов, позволяющих более «похоже» имитировать физиологическую секрецию инсулина.
У людей, не страдающих СД, прием пищи приводит к быстрому повышению секреции эндогенного инсулина, которая достигает пика через 1 ч после еды (12, 13). Уровни инсулина и глюкозы в плазме возвращаются к исходным значениям через 2 ч. Препараты инсулинов животного происхождения и рекомбинантные инсулины не позволяют воспроизвести аналогичные уровни инсулина в плазме крови, наблюдающиеся при нормальной физиологической реакции.
Целями лечения СД как 1 типа, так и 2 типа является отсутствие симптомов, хорошее качество жизни больных и минимальный риск развития осложнений за счет оптимального контроля СД. У большинства больных, которым необходима терапия инсулином, применяют комбинацию инсулина короткого действия (простого) и базального инсулина (промежуточного и длительного действия). Инсулин короткого действия обычно вводят до еды, чтобы обеспечить сывороточный уровень инсулина, достаточный для предупреждения выраженного подъема постпрандиальной гликемии. Однако при подкожной инъекции простого инсулина его концентрация в сыворотке достигает пика позднее (3-4 ч после инъекции) и остается повышенной дольше (длительность действия 7-8 ч), чем при нормальной секреции инсулина поджелудочной железой у людей, не болеющих СД (14). В связи с этим может наблюдаться относительная гиперинсулинемия, которая сохраняется в течение нескольких часов после еды и создает риск гипогликемических состояний, что заставляет больных есть в интервалах между основными приемами пищи. Одной из проблем, с которой сталкиваются больные и врачи, является повышенный риск гипогликемических состояний на фоне интенсифицированной инсулинотерапии.
Чтобы свести до минимума этот недостаток лечения, подкожные инъекции простого человеческого инсулина рекомендуется производить за 20-30 мин. до еды (15). Это создает определенные неудобства для некоторой группы больных, которые ведут активный образ жизни. Многие больные не соблюдают рекомендации и делают инъекции значительно ближе к приему пищи, что может усилить эффект неидеального профиля действия простого инсулина.
Производителями инсулинов была поставлена задача создания препарата инсулина, который бы позволил как можно лучше имитировать физиологическую постпрандиальную секрецию инсулина и, следовательно, оказывал бы потенциально благоприятное влияние на контроль гликемии, частоту эпизодов гипогликемии, чувство удовлетворенности лечением и давал бы возможность быстрого снижения случайной гипергликемии. Для этого требовался инсулин, действие которого было бы быстрее и короче эффекта простого человеческого инсулина.
В человеческом инсулине аминокислоты пролин и лизин занимают положения 28 и 29 В-цепи соответственно. Путем замены их друг другом был получен инсулин с качественно новыми свойствами – инсулин лизпро (Хумалог), молекулы которого имеют меньшую способность к ассоциации, чем молекулы человеческого инсулина.
После подкожной инъекции Хумалога быстрее идет абсорбция инсулина из подкожно-жировой клетчатки, быстрее достигается максимальная концентрация инсулина в крови и он имеет более короткую продолжительность действия по сравнению с человеческим инсулином (16). Инсулин лизпро имеет более физиологический временной профиль действия, чем применяемый в настоящее время человеческий инсулин короткого действия, и является новым шагом к достижению совершенных форм лечения больных СД.
Доклинические исследования Хумалога показали, что он аналогичен человеческому инсулину в отношении связывания с инсулиновыми рецепторами и эта его способность превосходит человеческий инсулин примерно в 1,6 раза (17). Сравнительное исследование фармакокинетики и глюкодинамики инсулина лизпро и простого инсулина (в равных дозах) на здоровых добровольцах с использованием «клэмп»-метода показало, что пик концентрации инсулина лизпро был выше и наблюдался по времени на 50% раньше, чем пик простого инсулина. Результаты 8 международных клинических исследований у больных с ИЗСД и ИНСД показали, что инсулин лизпро по сравнению с простым человеческим инсулином улучшает контроль постпрандиальной гликемии (18). В этих исследованиях было выявлено значительное снижение общего числа эпизодов гипогликемий у больных с ИЗСД, получавших инсулин лизпро.
Контроль постпрандиальной гликемии значительно улучшился при введении инсулина лизпро в сравнении с простым человеческим инсулином, о чем свидетельствовал постпрандиальный рост глюкозы плазмы. Улучшение наблюдалось в течение 2 ч после еды и при применении всех схем инсулинотерапии: интенсифицированная схема или инъекции инсулина лизпро 2 раза в день в комбинации с базальным инсулином один или два раза в день.
В перекрестном исследовании (19) у 1008 больных число эпизодов гипогликемий (с явной клинической симптоматикой и бессимптомных) достоверно снизилось при введении инсулина лизпро по сравнению с числом гипогликемий на фоне введения простого человеческого инсулина. В других исследованиях (20) частота эпизодов гипогликемии между группами сравнения достоверно не отличалась. У всех больных как с ИЗСД, так и с ИНСД частота и характер побочных эффектов инсулина лизпро и простого человеческого инсулина достоверно не отличались.
При изучении безопасности препарата во всех исследованиях определяли антитела 4 типов: специфические антитела к инсулину лизпро, специфические антитела к простому человеческому инсулину, перекрестные антитела (связывающие и инсулин лизпро, и простой человеческий инсулин) и антитела к ЕСР (антитела к полипептидам Escherichia coli). Результаты анализа антител к инсулину были получены в 6 регистрационных исследованиях у больных с ИЗСД и ИНСД, которые прежде получали инсулинотерапию (18). Ни в одном из исследований частота обнаружения повышенных титров антител к инсулину лизпро или простому человеческому инсулину не отличалась между группами сравнения. При применении обоих инсулинов было выявлено статистически достоверное повышение перекрестных антител, однако значения оставались низкими и не имели клинического значения. Иммуногенность инсулина лизпро изучалась также и у больных ИЗСД и ИНСД, которые ранее не получали инсулин (19). В целом клинически значимых изменений уровней антител против инсулина лизпро, простого человеческого инсулина, полипептидов Е. coli и перекрестных антител не выявили ни в одном из исследований.
Относительно физических нагрузок инсулин лизпро (учитывая фармакодинамику препарата) должен уменьшать вероятность гипогликемических состояний после инъекции. В большинстве случаев пациенты выполняют физические нагрузки не ранее чем через 2-3 ч после инъекции инсулина и приема пищи.
В такой ситуации профиль действия инсулина лизпро более безопасен, чем профиль действия человеческого инсулина для больных, ведущих активный образ жизни.
У больных как СД 1 типа, так и СД 2 типа Хумалог, по сравнению с простым человеческим инсулином, обеспечивает лучший контроль постпрандиальной гликемии при его использовании в качестве компонента двукратной схемы инсулинотерапии.
В одном исследовании у 110 больных СД (90 – СД 1 типа, 10 – СД 2 типа) был специально изучен вопрос об отношении пациентов к Хумалогу и простому человеческому инсулину (21). Предпочтение было отдано Хумалогу в результате более гибкого действия препарата, а 76% больных предпочли продолжить лечение Хумалогом после завершения клинического исследования.
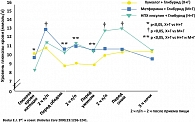
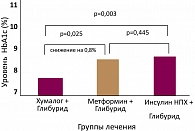
В 2000 году были опубликованы результаты клинического исследования терапии пациентов с СД типа 2 и неэффективностью лечения препаратами сульфонилмочевины. В исследовании принимали участие 135 пациентов, которые были разделены на три группы, в зависимости от получаемой терапии. Исследование длилось 3 месяца. В результате исследования было четко продемонстрировано, что назначение инсулина Хумалог приводит к более низкому постпрандиальному уровню гликемии и достоверному снижению уровня HbA1c, по сравнению с данными показателями в других группах терапии (рисунки 2, 3).
Хумалог в терапии детей и подростков
Компенсация углеводного обмена у детей и подростков, больных СД 1 типа, представляет значительные трудности. Это связано с выраженной лабильностью заболевания и психологическими особенностями детей и подростков. С 1999 года инсулин лизпро (Хумалог) применяется для лечения больных СД детей. Основными показателями эффективности и безопасности применения Хумалога в сравнении с инсулином короткого действия являлись: общий контроль гликемии, контроль постпрандиальной гликемии, частота гипогликемий, показатели HbA1c, иммуногенность. На основании клинических исследований показано, что Хумалог по сравнению с простым человеческим инсулином приводит к одинаковому или более низкому уровню постпищевой гликемии после завтрака и ужина и перед обедом, не вызывает различий в уровне HbА1с, не вызывает увеличения частоты эпизодов гипогликемии, может назначаться после приема пищи без потери контроля гликемии.
Лечение больных пожилого возраста
Особой группой пациентов являются также пожилые больные СД ввиду позднего диагностирования заболевания, сопутствующей патологии, раннего развития осложнений. Лечение больных пожилого возраста проводится с учетом ожидаемой продолжительности жизни, сохранности функций головного мозга. При ожидаемой продолжительности жизни более 10-15 лет и сохранном интеллекте пациента критерии компенсации заболевания не должны отличаться от рекомендуемых.
Наибольшую опасность для лиц пожилого возраста с СД 2 типа представляют гипогликемические состояния, которые могут возникнуть либо вследствие передозировки препарата, либо в результате снижения скорости выведения его из организма.
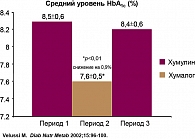
В старческом возрасте гипогликемические состояния могут спровоцировать развитие гипертонического криза, спазма коронарных сосудов с развитием инфаркта миокарда, внезапную потерю зрения. У пациентов пожилого возраста, получающих лечение простым человеческим инсулином, вероятность развития гипогликемических состояний выше, чем получающих лечение инсулином Хумалог. Доказательством тому может быть клиническое исследование, проведенное с 30 пациентами в возрасте старше 77 лет. Пациенты нуждались в сестринском уходе и получали лечение простым человеческим инсулином в сочетании с инсулином НПХ. Дизайн исследования предполагал разделение пациентов на три группы и лечение группы из 10 человек инсулином лизпро (Хумалог) после приема пищи, доза рассчитывалась исходя из принятого количества углеводов. Перекрестное исследование проводилось 3 периодами по 4 месяца в каждой группе лечения: группы I и III – простой человеческий инсулин за 30 мин. перед каждым приемом пищи; инсулин НПХ на ночь; группа II – Хумалог непосредственно после каждого приема пищи, доза рассчитывается исходя из принятого количества углеводов; инсулин НПХ на ночь.
В результате исследования было четко продемонстрировано достоверное снижение уровня HbA1c в группе пациентов, получающих лечение инсулином Хумалог, по сравнению с другими группами лечения (рисунок 4).
Лечение инсулином Хумалог при беременности
В США по классификации FDA Хумалог относится к категории безопасности для беременных «B»; в инструкции к препарату указано, что Хумалог «должен использоваться во время беременности только при обоснованной необходимости». В Европе в инструкции к препарату указано: «Данные, полученные у небольшого числа беременных, получавших препарат, указывают на то, что инсулин лизпро не оказывает нежелательного влияния на течение беременности или здоровье плода/новорожденного». Результаты экспериментов у животных свидетельствуют об отсутствии у Хумалога тератогенного эффекта.
Опубликованные описания клинических случаев и клинических исследований подтверждают безопасность и эффективность Хумалога у беременных.
Было проведено клиническое исследование, включившее 42 женщин в возрасте старше 18 лет. Гестационный СД был диагностирован при гестационном сроке от 14 до 32 недель. Пациенты рандомизированы на две группы лечения: Хумалог перед приемом пищи или простой инсулин человека перед приемом пищи плюс инсулин НПХ в качестве базального в обеих группах лечения. После стандартного теста с приемом пищи определяли инсулин сыворотки крови, уровень глюкозы плазмы и С-пептида. Антитела к инсулину и уровень HbА1с определяли на момент включения в исследование и через 6 нед. В родах в пуповинной крови измеряли уровень Хумалога и человеческого инсулина. Хумалог не определялся в пуповинной крови. Ни в одной из групп лечения не было выявлено аномалий развития со стороны плода или новорожденного. Не было выявлено достоверных различий в частоте операции кесарева сечения, гестационном возрасте при рождении, росте, массе тела и перцентилях новорожденных.
В когортном исследовании, включавшем 97 беременных, страдавших до беременности СД в течение 7 лет, 70 беременных получали простой человеческий инсулин (у 69 – СД 1 типа, у 1 – СД 2 типа), 27 беременных получали Хумалог (у 20 – СД 1 типа, у 7 – СД 2 типа). Данное исследование продемонстрировало, что Хумалог при беременности:
- не проникает через плаценту;
- не влияет на частоту врожденных пороков развития;
- может снижать постпрандиальную гликемию и уровень HbА1с;
- не влияет на гестационный возраст при рождении;
- не увеличивает массу тела новорожденных.
Таким образом, первый аналог человеческого инсулина – Хумалог, используемый более 10 лет, показал высокую эффективность в прандиальной регуляции, безопасность при длительном применении, в том числе в разных популяциях больных сахарным диабетом.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.