Показатели вазорегулирующей функции эндотелия у больных МС на фоне терапии Редуксином
- Аннотация
- Статья
- Ссылки
С развитием науки понятие МС пополнялось все новыми составляющими. В настоящее время не вызывают сомнений следующие его компоненты: абдоминальное ожирение, гиперинсулинемия, нарушение толерантности к глюкозе (НТГ), дислипидемия, артериальная гипертензия (АГ), микроальбуминурия, нарушение гемостаза, ранний атеросклероз. Метаболическому синдрому часто сопутствуют нарушения пуринового обмена, синдром ночных апноэ, синдром поликистозных яичников, недостаточное снижение АД в ночное время и неалкогольная жировая болезнь печени. Риск развития ишемической болезни сердца (ИБС), мозгового инсульта, общей и коронарной смертности возрастает по мере увеличения числа компонентов МС (12, 13, 14). В исследовании J.H. Park и соав. (2007), включавшем 478 пациентов с ишемическим инсультом, МС был выявлен у 53,4% больных (критерии NCEP ATP III), а значение показателя толщины комплекса интима-медия сонных артерий повышалось прямо пропорционально увеличению числа имеющихся компонентов синдрома (20).
Проблема лечения МС по-прежнему остается в центре внимания практических врачей. Основная цель терапии больных с МС – максимальное снижение риска развития сердечно-сосудистых заболеваний и их осложнений.
Лечение МС включает изменение образа жизни и диетические рекомендации: снижение калорийности рациона, полное исключение алкоголя, ограничение жиров животного происхождения и холестерина (менее 300 мг/сут), употребление полиненасыщенных жирных кислот (содержащихся, в частности, в морской рыбе), активную физическую нагрузку (4-5 занятий в неделю по полчаса в день при отсутствии клинических признаков ИБС).
Согласно современным рекомендациям, начальное снижение массы тела (МТ) у пациентов с МС должно составлять не менее 10% исходной (3, 27). Снижение МТ позволяет уменьшить ИР, а также получить положительный эффект в отношении АГ и показателей липидного спектра крови. В целом практика показывает, что более чем 90% людей, снизивших МТ, в течение одного года вновь прибавляют свой вес и только около 4-5% больных МС могут достичь положительных результатов без дополнительной фармакотерапии (3, 17).
У большинства больных МС в той или иной степени выражены расстройства пищевого поведения, включая синдром ночной еды, прием пищи на фоне эмоционального дискомфорта, пищевые кутежи, бесчисленные перекусы и др. Очевидно, что перечисленные нарушения значительно затрудняют соблюдение пациентами медицинских рекомендаций по рациональному и сбалансированному питанию. Поэтому для достижения оптимальных результатов терапии целесообразно и обоснованно применение в лечении больных МС фармакологических препаратов, не только способствующих снижению МТ, но и оказывающих нормализующее воздействие на пищевое поведение и аппетит.
В ряду таких средств особое место принадлежит сибутрамину – препарату центрального действия (17, 18, 24). С одной стороны, ингибируя обратный захват серотонина и норадреналина, пролонгируя их действие, сибутрамин усиливает и продлевает чувство насыщения, снимает пищевую зависимость пациентов. С другой стороны, еще один эффект препарата направлен на увеличение скорости метаболизма за счет стимуляции пищевого термогенеза (активация b3- и b2-адренорецепторов жировой ткани) и, следовательно, на повышение энергозатрат организма. Уменьшая потребление энергии, увеличивая ее расход, сибутрамин регулирует обе стороны энергетического баланса.
На кафедре эндокринологии и диабетологии МГМСУ было проведено открытое неконтролируемое исследование эффективности и переносимости сибутрамина (Редуксин), а также влияния препарата на метаболизм углеводов и вазорегулирующую функцию эндотелия у 40 больных с МС (30 женщин и 10 мужчин в возрасте от 19 до 47 лет – медиана, интерквартильный размах 34 года (28, 37); индекс массы тела (ИМТ) более 27).
Диагностика МС проводилась согласно рекомендациям комитета экспертов Национальной образовательной программы по холестерину (NCEP АТР III, 2001). В исследование не включались пациенты, которые имели сахарный диабет, неконтролируемую АГ, булимию, психические и тяжелые соматические заболевания. Все пациенты наблюдались амбулаторно в течение всего периода лечения. Оно продолжалось 13 недель (1 неделя – вводный период; 12 недель – период лечения). В течение 3 месяцев пациенты получали сибутрамин по 10-15 мг/сут на фоне гипокалорийного питания с энергодефицитом в 500-600 ккал по сравнению с расчетным индивидуальным показателем суточной потребности и увеличения физической активности. Если в течение первых 4 недель лечения сибутрамином по 10 мг/сут не было достигнуто снижение МТ на 2 кг и более, то с 5 недели его доза увеличивалась до 15 мг/сут.
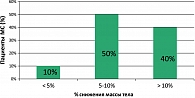
За период лечения Редуксином у большинства больных МС снижение МТ достигло клинически значимых величин (рисунок 1): половина исследуемых достигла снижения МТ более чем на 5% исходной, еще 40% похудели более чем на 10% и только у 10% пациентов вес снизился менее чем на 5%.
Большинство включенных в наше исследование имели ожирение второй степени (80%), а ожирение первой степени наблюдалось у 20% пациентов. Снижение МТ сопровождалось закономерным уменьшением степени выраженности ожирения: к концу курса лечения частота ожирения второй степени снизилась вдвое; частота ожирения первой степени составила 35%, а значительная часть больных МС относились уже к категории избыточной массы тела (25%), хотя вначале все участники имели ожирение различной степени. Снижение МТ эффективно сказалось на параметрах, характеризующих абдоминальное ожирение. За период лечения Редуксином ОТ уменьшился не менее чем на 4 см у 80% больных МС, а у 20% – на 10 см и более по сравнению с исходным показателем.
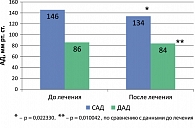
Известно, что около 40% больных ожирением страдает АГ, которая является частым компонентом МС (23, 28). Согласно мнению экспертов ВОЗ, в западных странах в среднем у трети пациентов АГ обусловлена избыточной МТ, а у мужчин до 45 лет этот показатель достигает 60% (6). В этой связи пациентам с АГ, имеющим избыточную МТ, следует настойчиво рекомендовать постепенное и эффективное похудение. Учитывая норадренергический механизм действия сибутрамина, мы изучили влияние препарата на артериальное давление (АД) у больных МС. Среди наших участников более чем у половины отмечена контролируемая АГ. В течение всего периода лечения у наблюдаемых пациентов не отмечалось резких колебаний АД, в связи с чем нам не потребовалось изменять ни суточных доз препаратов, ни схемы антигипертензивной терапии. До лечения медиана, интерквартильный размах показателей САД и ДАД у больных МС составили соответственно 146,0 мм рт. ст. (132,0; 150,0) и 86,0 мм рт. ст. (82,0; 90,0); через 12 недель терапии показатели САД и ДАД достоверно снизились, медиана, интерквартильный размах составили соответственно 134,0 мм рт. ст. (124,0; 134,0); р = 0,022330 и 84,0 мм рт. ст. (80,0; 86,0); р = 0,010042 (рисунок 2). Важно заметить, что степень снижения МТ по-разному отразилась на показателях АД. При сравнении динамики АД на фоне лечения мы выявили, что у достигших снижения МТ на 10% и более исходной (40% пациентов), показатели САД и ДАД были достоверно ниже, чем у похудевших на 5% и более первоначального веса (60% пациентов). Интерпретировать эти данные можно следующим образом: снижение МТ нивелирует возможное повышение АД у больных МС, обусловленное активностью норадреналина, а эффективное похудение способствует, в свою очередь, снижению АД. Практически прежней осталась ЧСС – 80,0 уд./мин. (78,0; 82,0) (до лечения – 80,0 уд./мин. (76,0; 82,0)); р = 0,832055. В целом динамика антропометрических показателей и данных АД свидетельствует об улучшении функционального состояния сердечно-сосудистой системы у больных МС, наблюдаемом на фоне терапии Редуксином снижения МТ и выраженности абдоминального ожирения.
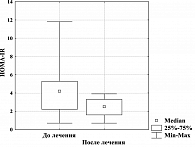
Важным проявлением эффективности Редуксина стало и его благоприятное влияние на метаболизм углеводов и в первую очередь на чувствительность тканей к инсулину. Отмечено снижение уровня гликемии натощак, медиана, интерквартильный размах которого до лечения были 5,7 ммоль/л (5,2; 6,1), после терапии – 5,0 ммоль/л (4,8; 5,5), р = 0,024500. Позитивные изменения касались и показателей постпрандиальной гликемии: медиана, интерквартильный размах до лечения – 6,8 ммоль/л (5,6; 7,0), после терапии – 5,2 ммоль/л (3,9; 6,6); р = 0,0323400. У двух пациентов, имевших НТГ до лечения, через 12 недель терапии Редуксином по результатам ОГТТ, отмечена нормальная толерантность к глюкозе. На фоне терапии препаратом наблюдалось достоверное снижение уровня иммунореактивного инсулина (ИРИ) – как базального, так и стимулированного нагрузкой глюкозой. Так, медиана, интерквартильный размах базального ИРИ исходно составили 16,2 мкЕД/мл (8,1; 24,8), после фармакотерапии – 10,0 мкЕД/мл (6,8; 14,1); различия статистически достоверны, р = 0,004230. У стимулированного ИРИ исходно аналогичные показатели были 40,0 мкЕД/мл (20,6; 48,0), после лечения – 26,8 мкЕД/мл (10,2; 38,0); различия статистически достоверны, р = 0,003220. Одновременно с этим у большинства пациентов отмечалось значимое улучшение чувствительности к инсулину, о чем свидетельствовало снижение показателя HOMA-IR у 92% больных МС (рисунок 3).
В настоящее время важная роль в развитии атеросклеротического процесса, начиная с ранних стадий, отводится эндотелиальной дисфункции (ЭД) (7, 8, 25). В связи с этим, безусловно, научный и практический интерес представляло изучение влияния снижения МТ в ходе терапии сибутрамином на вазорегулирующую функцию эндотелия у больных МС. Под ЭД понимают нарушение баланса физиологических регуляторных механизмов и биологических активных молекул, обеспечивающих гомеостаз и тонус сосудов (15). Хорошо известно, что тонус сосудов в норме и при различных патологических состояниях в значительной степени определяется равновесием факторов вазодилятации (оксид азота (NO), простациклин, натрийуретический пептид С-типа) и вазоконстрикции (эндотелин, тромбоксан А2, ангиотензин II) эндотелиальной природы (4, 11, 15). Дисфункция эндотелия является маркером метаболических и сосудистых нарушений (7). В начальный период развития атерогенеза, когда еще отсутствуют явные клинические проявления и видимые морфологические изменения сосудов, основную роль играет именно дисфункция эндотелия (13, 19).
С каждым годом заметно увеличивается число известных физиологических и патофизиологических функций NO, играющего существенную роль в метаболических, гемодинамических и иммунных процессах (19). Кроме классических вазодилятирующих эффектов, NO обладает ангиопротективными свойствами, включая подавление пролиферации и миграции гладкомышечных клеток сосудов, синтеза коллагена этими клетками, торможение экспрессии молекул адгезии, агрегации лейкоцитов и миграции макрофагов (4, 10). Результаты экспериментальных исследований свидетельствуют о роли NO в регуляции пищевого поведения, метаболизма жиров и энергетического гомеостаза (11, 19, 22).
Эндотелин-1 (ЭТ-1) во многом обладает противоположным действием по отношению к NO и в настоящее время признается его антагонистом (5, 21). Повышенный уровень ЭТ-1 связан с повреждением эндотелиоцитов и может считаться маркером ЭД (15). В литературе представлены экспериментальные данные о тесной взаимосвязи ИР и повышенного содержания ЭТ-1: в работе J.J. Wilkes и соавт. (2003) крыс подвергали 5-дневной инфузии ЭТ-1 с использованием осмотической минипомпы (26). При этом было показано, что введение ЭТ-1 приводит к выраженному снижению (на 30%) утилизации глюкозы периферическими тканями. Кроме того, авторами продемонстрировано, что длительное применение ЭТ-1 нарушает in vivo инсулинозависимый транспорт глюкозы в изолированных мышечных полосках, а in vitro проведение инсулинового сигнала, снижая на 30-40% количество белкового компонента субстрата инсулинового рецептора-1 (СИР-1) и каталитической субъединицы р110a, ассоциированный с СИР-1, а также уменьшает активность протеинкиназы В (Akt).
Наряду с влиянием на периферическую утилизацию глюкозы известна и важная роль ЭТ-1 в регуляции энергетического гомеостаза (16, 21). В исследовании J. Chi-Chang и соавт. (2003) выявлено зависимое от времени и применяемой дозы ингибирующее действие ЭТ-1 на экспрессию и секрецию адипонектина в 3Т3-L1 адипоцитах (9). Эти эффекты пептида блокируются антагонистом рецепторов ЭТ-А BQ-610, но не антагонистом рецепторов ЭТ-В.
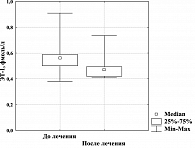
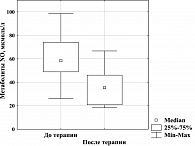
Наше исследование влияния терапии Редуксином на параметры эндотелиальной функции показало статистически значимое уменьшение (на 17%) концентрации ЭТ-1 у больных МС (рисунок 4): после 12-недельного курса она снизилась до практически нормальных значений. Анализируя изменения базального содержания метаболитов NO в крови на фоне фармакотерапии, мы установили, что при их высоком исходном уровне к концу лечения продукция NO нормализовалась (рисунок 5). Наблюдаемая динамика параметров эндотелиальной функции дает нам возможность предположить адаптационное значение повышенной продукции NO у больных МС. Снижение базальной эндогенной продукции NO до нормальных показателей после курса лечения Редуксином, очевидно, обусловлено уменьшением метаболических расстройств, а самое главное – степени ИР.
Итак, мы установили, что снижение МТ на фоне приема Редуксина позволило улучшить эндотелиальную функцию у больных МС, о чем свидетельствовала нормализация концентрации метаболитов NO и снижение содержания ЭТ-1. По нашему мнению, эффективное снижение МТ, сопровождающееся целым комплексом позитивных метаболических сдвигов, включая улучшение чувствительности тканей к инсулину, снижение ГИ, приводят в целом к улучшению функционального состояния эндотелия.
При суммарной оценке эффективности сибутрамина нами отмечено исчезновение отдельных компонентов МС у 79% пациентов, а у 52% участников исследования после проведенного лечения мы вообще не выявили признаков МС (по критериям NCEP ATP III).
Анализ индивидуальных пищевых дневников и опрос пациентов свидетельствуют, что регулярный прием сибутрамина в дозе 15 мг/сут позволяет легко и эффективно соблюдать рекомендации врача по низкокалорийному питанию. Начиная с 4-й недели терапии и в последующем процессе исследования все пациенты проявили полную приверженность к фармакотерапии в сочетании с немедикаментозными методами лечения. Тем более что переносимость препарата была хорошей, лишь у 2 больных отмечалась сухость во рту, беспокоившая в течение первых 2-3 недель лечения.
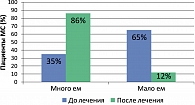
Обычно пациенты, страдающие ожирением, недооценивают количество съеденного. В практическом плане важно подчеркнуть, что модификация пищевого поведения у больных МС на фоне терапии сибутрамином привела к изменению их мнения относительно алиментарного фактора, т.е. количества и качества потребляемой пищи (рисунок 6). Так, до начала терапии сибутрамином большинство отмечало, что едят мало и аппетит у них не повышен. В процессе лечения на фоне снижения объема съеденной пищи большинство пациентов пересмотрели свои пищевые привычки, заметив, что все-таки до терапии сибутрамином, имея повышенный аппетит, они потребляли большое количество пищи.
Не вызывает сомнений, что основная роль в этиологии ожирения принадлежит алиментарному фактору, и отдаленные результаты лечения все еще остаются неблагоприятными: более чем 90% людей, снизивших МТ, в течение одного года вновь наращивают свой вес. Поэтому центральная проблема лечения ожирения – удержание достигнутого снижения МТ, т.е. предотвращение повторной прибавки веса. Снижение скорости метаболизма с развитием синдрома низкого Т3 часто затрудняет дальнейшую эффективную потерю избыточной массы тела у большинства пациентов. В этой связи важен механизм действия сибутрамина, ускоряющий метаболические процессы в ходе снижения МТ (17), что способствует удержанию МТ, достигнутой в процессе терапии. Поэтому через 8 месяцев после окончания лечения сибутрамином нами были повторно осмотрены больные МС. Большинство из них (79%) и спустя 32 недели после отмены препарата сохранили достигнутые результаты.
Лечение препаратом Редуксин инициируют с начальной дозы 10 мг, принимаемой однократно утром, независимо от приема пищи. В дальнейшем оценивается эффективность проводимой терапии, и если не достигнуто снижение массы тела на 2 кг и более в течение 4 недель от начала лечения, то доза препарата увеличивается до 15 мг/сут. Редуксин в комплексе с диетой и физическими упражнениями разрешен для непрерывного применения в течение 2 лет, также возможен и более короткий курс терапии (3-6 месяцев) (17, 25). Среди возможных нежелательных эффектов следует отметить учащение пульса на 4-8 уд./мин., незначительное повышение САД в среднем на 1-3 мм рт. ст., ДАД на 1,8-2,4 мм рт. ст. (17, 24). Увеличение ЧСС опосредовано периферическим эффектом блокады переносчика нейротрансмиттера норадреналина. Однако в большинстве случаев возможное повышение АД, обусловленное активностью норадреналина и не являющееся частым побочным действием препарата (< 1,5%), нивелируется успешным снижением МТ на фоне терапии сибутрамином. В целом при приеме сибутрамина пациентами без АГ, а также в случае хорошо контролируемой АГ, изменения САД и ДАД сравнимы с аналогичными показателями в группе плацебо (18).
Рекомендуется в начале первого месяца терапии Редуксином контролировать ЧСС, АД каждые 2 недели, а в дальнейшем один раз в 1-3 месяца. Лечение препаратом необходимо прекратить, если ЧСС увеличилась на 10 и более ударов, а показатели САД и ДАД при двух последовательных визитах повысились на 10 мм рт. ст. Среди других возможных нежелательных эффектов терапии наиболее часто отмечаются головная боль, бессонница, запоры, сухость во рту. Препарат противопоказан при неконтролируемой гипертензии (³ 145/90 мм рт. ст.), тяжелой ИБС, нарушениях сердечного ритма, застойной сердечной недостаточности, эпилепсии, печеночной и почечной недостаточности, терапии ингибиторами МАО и антидепрессантами, глаукоме (17). Следует воздержаться от приема во время беременности и лактации.
В заключение следует отметить, что, вызывая быстрое наступление чувства насыщения, увеличивая расходы энергии, терапия Редуксином в дозе 10-15 мг/сут в сочетании с нефармакологическими методами позволяет достичь большинству больных реального снижения МТ, в пределах рекомендуемого (на 5-10% исходной МТ), приводящего к повышению чувствительности тканей к инсулину и к улучшению вазорегулирующей функции эндотелия. Удобство в применении, гибкость в титрации дозы, высокая эффективность и хорошая переносимость, а также способность препарата удерживать достигнутый результат в течение длительного времени позволяют рекомендовать Редуксин для снижения МТ у больных с МС.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.