Позитивная клинико-иммунологическая эффективность препарата Имунофан® в комплексном лечении иммунокомпрометированных женщин с хроническими инфекционно-воспалительными заболеваниями генитального тракта
- Аннотация
- Статья
- Ссылки
- English
Цель – оценка клинико-иммунологической эффективности иммунопатогенетически обоснованной иммуномодулирующей терапии препаратом Имунофан® в коррекции комбинированных нарушений функционирования иммунной системы иммунокомпрометированных женщин с ХВЗГТ.
Материал и методы. Проведено клинико-анамнестическое и иммунологическое обследование 57 женщин (20–40 лет) с ХВЗГТ в период обострения до лечения – группа исследования 1 (ГИ1) – и 20 условно здоровых женщин – группа сравнения (ГС). Иммунокомпрометированным женщинам с ХВЗГТ проводилась в группе исследования 1а (ГИ1а, n = 22) традиционная терапия и в группе исследования 1б (ГИ1б, n = 35) комплексная терапия с включением препарата Имунофан® в дозе 45 мкг/мл 1 мл внутримышечно один раз в сутки в течение десяти дней.
Результаты. У женщин ГИ1 выявлены комбинированные нарушения функционирования Т- и В-клеточного иммунитета, естественных киллерных клеток (ЕКК) и нейтрофильных гранулоцитов (НГ). На фоне традиционной терапии в ГИ1а при достижении нестойкой клинической ремиссии отмечалось отсутствие позитивного влияния проводимого традиционного лечения на восстановление показателей иммунной системы. Напротив, в ГИ1б наблюдалось восстановление содержания Т- и В-лимфоцитов, ЕКК, фагоцитарной и киллинговой активности НГ, что сопровождалось регрессом в более короткие сроки симптомов воспаления в период обострения ХВЗГТ и уменьшением частоты рецидивов через шесть месяцев после лечения.
Заключение. Комплексное лечение с включением иммуномодулирующей терапии препаратом Имунофан®, оказывающим плейотропное действие, способствует устранению дисрегуляции основных противоинфекционных механизмов адаптивного и врожденного иммунитета, что позитивно сказывается на характере и исходе обострения воспаления и предупреждает возникновение рецидивов ХВЗГТ у иммунокомпрометированных женщин.
Цель – оценка клинико-иммунологической эффективности иммунопатогенетически обоснованной иммуномодулирующей терапии препаратом Имунофан® в коррекции комбинированных нарушений функционирования иммунной системы иммунокомпрометированных женщин с ХВЗГТ.
Материал и методы. Проведено клинико-анамнестическое и иммунологическое обследование 57 женщин (20–40 лет) с ХВЗГТ в период обострения до лечения – группа исследования 1 (ГИ1) – и 20 условно здоровых женщин – группа сравнения (ГС). Иммунокомпрометированным женщинам с ХВЗГТ проводилась в группе исследования 1а (ГИ1а, n = 22) традиционная терапия и в группе исследования 1б (ГИ1б, n = 35) комплексная терапия с включением препарата Имунофан® в дозе 45 мкг/мл 1 мл внутримышечно один раз в сутки в течение десяти дней.
Результаты. У женщин ГИ1 выявлены комбинированные нарушения функционирования Т- и В-клеточного иммунитета, естественных киллерных клеток (ЕКК) и нейтрофильных гранулоцитов (НГ). На фоне традиционной терапии в ГИ1а при достижении нестойкой клинической ремиссии отмечалось отсутствие позитивного влияния проводимого традиционного лечения на восстановление показателей иммунной системы. Напротив, в ГИ1б наблюдалось восстановление содержания Т- и В-лимфоцитов, ЕКК, фагоцитарной и киллинговой активности НГ, что сопровождалось регрессом в более короткие сроки симптомов воспаления в период обострения ХВЗГТ и уменьшением частоты рецидивов через шесть месяцев после лечения.
Заключение. Комплексное лечение с включением иммуномодулирующей терапии препаратом Имунофан®, оказывающим плейотропное действие, способствует устранению дисрегуляции основных противоинфекционных механизмов адаптивного и врожденного иммунитета, что позитивно сказывается на характере и исходе обострения воспаления и предупреждает возникновение рецидивов ХВЗГТ у иммунокомпрометированных женщин.




Введение
В настоящее время при использовании современных эффективных антибактериальных препаратов в лечении хронических воспалительных заболеваний генитального тракта (ХВЗГТ) достигнуты определенные успехи, касающиеся купирования обострения воспалительного процесса. Однако отмечается тенденция к увеличению вялотекущих, затяжных, стертых и часто рецидивирующих ХВЗГТ, характеризующихся полисистемным поражением, в частности снижением системного и мукозального иммунитета, развитием синдрома эндогенной интоксикации, нарушениями микробиома слизистых оболочек, нейроэндокринными изменениями, что не способствует предупреждению рецидивов ХВЗГТ и является одной из самых актуальных проблем в клинической практике [1, 2].
К ХВЗГТ относятся как самостоятельные нозологические формы – эндометрит, сальпингит, оофорит, так и различные их комбинации. Значительную роль в формировании ХВЗГТ играют инфекции, передаваемые половым путем, вызванные Neisseria gonorrhoeae (25–50%), Chlamydia trachomatis (25–30%) и Mycoplasma genitalium (7–20%) [3]. В то же время при нарушении иммунокомпетентности стали чаще встречаться ХВЗГТ (метроэндометриты, сальпингоофориты, вульвовагиниты, цервициты), нарушения микробиоты влагалища (бактериальный вагиноз), обусловленные условно-патогенными (оппортунистическими) микроорганизмами, нежели ХВЗГТ, вызванные абсолютными патогенами. Полимикробная этиология ХВЗГТ представлена облигатно-анаэробными и факультативно-анаэробными патогенами и их ассоциацией, которые в низких титрах могут присутствовать в составе нормальной микрофлоры влагалища (Bacteroides spp., Gardnerella vaginalis, Peptostreptococcus spp., Escherichia coli, Clostridium spp., Prevotella spp., Streptococcus spp. и т.д.) и вирусами [4]. Определение вида возбудителя при ХВЗГТ не всегда представляется возможным с использованием стандартных методов диагностики, и в 70% случаев этиология заболеваний остается неизвестной. Кроме того, бактериальная инфекция нередко сочетается с вирусной нагрузкой (папилломавирусом, герпесвирусом).
Проблема диагностики и лечения пациенток с ХВЗГТ также связана с тем, что отмечается увеличение числа женщин с клиническими признаками иммунокомпрометированности, к которым относятся инфекционно-воспалительные процессы любой локализации с часто рецидивирующим, вялотекущим течением, неэффективностью стандартной терапии, преобладанием в качестве возбудителей условно-патогенных микроорганизмов и патогенной флоры с атипическими биологическими свойствами, наличием антибиотикорезистентности, что оказывает существенное негативное влияние на репродуктивный потенциал женщины. Стандартная схема противовоспалительной терапии включает назначение антибактериальных, противогрибковых препаратов, санацию влагалища и витаминотерапию, которые способны оказать положительное влияние на исчезновение симптомов, нормализовать микрофлору, однако эффективность элиминации инфекционного агента из эндометрия и фаллопиевых труб всегда остается под сомнением, так как нет достаточного количества результатов исследований проведенной терапии и оценки частоты возникновения поздних осложнений. Несвоевременное и неадекватное диагностирование и лечение ХВЗГТ провоцируют развитие диспареунии, контактных кровотечений, формирование опухолевидных образований шейки, тела и придатков матки, которые нередко становятся причинами хронических тазовых болей, бесплодия и невынашивания беременности, часто обусловливают развитие патологии плода и новорожденного, приводят к стойкому нарушению менструальной, половой, репродуктивной функций, что способствует инвалидизации. В 48–80% наблюдений ХВЗГТ обусловливают развитие внематочной беременности [5].
Исходя из вышеизложенного, одной из перспективных задач является изучение влияния иммунотропных препаратов в комплексной терапии ХВЗГТ. Согласно литературным данным, использование в лечении ХВЗГТ иммунотропных препаратов (аминодигидрофталазиндиона натрия, азоксимера бромида, глюкозаминилмурамилдипептида и др.) оказывает позитивный клинико-иммунологический эффект. Отмечен положительный эффект влияния на клеточное и гуморальное звенья иммунитета – увеличение ТCD3+-лифмоцитов, иммунорегуляторного индекса (ИРИ), увеличение синтеза иммуноглобулина A (IgA) и нормализация уровня IgG [6]. Среди лекарственных средств, обладающих иммуномодулирующими свойствами, особый интерес представляет гексапептид (ГП) аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин, который является активным центром гормона тимуса тимопоэтина и обладает иммунорегуляторными свойствами, а также способностью вызывать инактивацию свободнорадикальных и перекисных соединений, восстанавливая баланс окислительно-антиокислительных реакций при инфекционно-воспалительных заболеваниях.
Гексапептид аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин, синтетический аналог активного центра гормона тимуса тимопоэтина, который обладает всеми биологическими свойствами нативного гормона тимуса, является действующим веществом лекарственного препарата Имунофан® [7]. Тимопоэтин способен связываться с никотиновыми ацетилхолиновыми рецепторами (NACHR) нейронального типа и оказывать физиологические эффекты влияния на клетки иммунной системы, в первую очередь на Т-лимфоциты и клетки нейронального типа [8]. NACHR представляют собой пентамерные катионные каналы, экспрессирующиеся на трех типах лейкоцитарных гранулоцитарных клеток: нейтрофильных гранулоцитах (НГ), базофилах и эозинофилах [9, 10]. NACHR также присутствуют на естественных киллерных клетках (ЕКК), дендритных клетках, макрофагах и могут стать важной лекарственной мишенью для вмешательства при воспалении. Воздействие на NACHR, экспрессированные на ЕКК, подавляет рецепторы NKG2D и уменьшает NKG2D-зависимую клеточно-опосредованную цитотоксичность и продукцию интерферона γ, а также демонстрирует их противовоспалительную роль, что важно для регуляции иммунного ответа [11].
Препарат получил широкое применение в лечении различных иммунозависимых заболеваний. ГП отличается способностью проявлять дезинтоксикационные, гепатопротекторные, антиоксидантные и иммунорегуляторные свойства – индуцирует раннюю дифференцировку Т-лимфоцитов, а также может усиливать эффективность антибактериальной терапии и ингибировать множественную лекарственную устойчивость, что является перспективным для его использования у иммунокомпрометированных женщин в период обострения ХВЗГТ с целью оптимизации лечения.
Таким образом, особую актуальность приобретает поиск новых научно обоснованных подходов к комплексной терапии ХВЗГТ, предполагающих более адекватное влияние на все звенья патогенеза заболевания, в том числе коррекцию нарушенных механизмов противоинфекционного иммунитета, направленных на достижение стойкой клинико-иммунологической ремиссии, а также предупреждение последующих рецидивов и поздних осложнений.
Цель исследования
Цель исследования – оценка клинико-иммунологической эффективности иммунопатогенетически обоснованной иммуномодулирующей терапии препаратом на основе гексапептида (Имунофан®) в коррекции комбинированных нарушений функционирования иммунной системы иммунокомпрометированных женщин с хроническими воспалительными заболеваниями генитального тракта.
Материал и методы
Под нашим наблюдением находились 57 женщин репродуктивного возраста (от 20 до 40 лет) с ХВЗГТ в период обострения, поступивших в отделение дневного стационара Клиники ФГБОУ ВО КубГМУ Минздрава России.
Для оценки клинико-иммунологической эффективности проводимого комплексного лечения пациентки были разделены на клинические группы в соответствии с терапевтической тактикой:
- группу исследования 1 (ГИ1) – 57 женщин с ХВЗГТ в период обострения до лечения;
- группу исследования 1а (ГИ1а) – 22 женщины с ХВЗГТ в период обострения после лечения с использованием только традиционной терапии;
- группу исследования 1б (ГИ1б) – 35 женщин с ХВЗГТ в период обострения после комплексной терапии, включавшей традиционную терапию и иммунотерапию с препаратом на основе ГП Имунофан®: 45 мкг/мл 1 мл внутримышечно один раз в сутки в течение десяти дней (курсовая доза – 450 мкг).
Группу сравнения (ГС) составили 20 здоровых женщин репродуктивного возраста, обратившихся в клинику с целью контрацепции (установка внутриматочной спирали).
Методом проточной цитофлуориметрии (FC500 Beckman Coulter, США) с соответствующими МкАТ Beckman Coulter International S.A. (Франция) проведено иммунофенотипирование Т- и В-лимфоцитов (CD3+CD19-, CD3+CD4+, CD3+CD8+, CD3-CD19+), ЕКК (CD3-CD16+CD56+) периферической крови (ПК), рассчитан ИРИ – CD3+CD4+/CD3+CD8+. Тестирование фагоцитарной и микробицидной функций НГ осуществлялось с определением количества активно фагоцитирующих Staphylococcus aureus НГ (%ФАН), захвата (фагоцитарного числа (ФЧ), фагоцитарного индекса (ФИ)), оценкой переваривающей активности (процента переваривания (%П), индекса переваривания (ИП)). NADPH-оксидазную активность НГ определяли по показателям NBT-теста спонтанного и стимулированного (S. aureus), при этом учитывался процент формазан-позитивных клеток (%ФПК), средний цитохимический индекс (СЦИ), по соотношению %ФПКст/%ФПКсп рассчитывался коэффициент мобилизации (КМ). Тестирование иммунной системы проводилось до лечения и через два-три дня после проведения комплексного лечения с включением иммунотерапии препаратом на основе ГП Имунофан® или стандартной терапии.
Статистическую обработку данных осуществляли в компьютерных программах Microsoft Exel 2016 и StatPlus 2010. Использовали критерий Стьюдента для оценки клинических параметров (M ± m) и непараметрические статистические критерии Вилкоксона и Манна – Уитни для оценки иммунологических параметров (Me (Q1; Q3)). Статистически значимые различия определяли при p < 0,05.
Результаты
Показано, что у всех исследуемых женщин ХВЗГТ характеризовались длительным анамнезом (более пяти лет), частыми обострениями (три раза в год и более) или вялотекущим затяжным течением обострений, отсутствием стойкого клинического эффекта при использовании традиционной системной и местной противовоспалительной терапии.
При изучении данных анамнеза женщин ГИ1 выявлены дополнительные критериальные признаки иммунокомпрометированности [12, 13]: в 56% случаев присутствовали латентные или рецидивирующие моно- или микст- герпесвирусные инфекции (ГВИ) (инфекции, вызванные вирусами простого герпеса (ВПГ) 1 и 2, генитальной и орофациальной локализации с частотой обострений до пяти-шести раз в год), папилломавирусная инфекция (ПВИ) (кондиломы аногенитальной области), рекуррентные ОРВИ с частотой эпизодов до семи-восьми раз год.
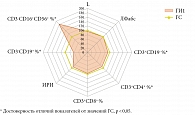
Оценка показателей клеточного иммунитета выявила, что у женщин ГИ1 на фоне обострения хронического воспалительного процесса не менялось содержание общего количества лейкоцитов и лимфоцитов и при этом отмечалось снижение Т-лимфоцитов CD3+CD19- до 69,8 (63,8; 72,0) против 76,1 (73,4; 78,1)% в ГС (p < 0,05), содержания Т-хелперов CD3+CD4+ до 39,9 (35,2; 40,7) против 43,4 (41,4; 44,8)% в ГС (p < 0,05). Содержание цитотоксических Т-лимфоцитов (ЦТЛ) CD3+CD8+ не менялось (p > 0,05) (рис. 1). При явном снижении клеточных механизмов адаптивного иммунитета наблюдалось увеличение в два раза содержания цитотоксических клеток врожденного иммунитета – ЕКК CD3-CD16+CD56+ – до 19,4 (15,6; 23,0) против 10,7 (9,8; 12,5)% в ГС (p < 0,05) (см. рис. 1). Отмечалось также уменьшение в 1,6 раза содержания В-лимфоцитов CD3-CD19+ – до 9,1 (6,3; 10,4) против 14,4 (12,3; 16,1)% в ГС (p < 0,05), что предполагает функциональную несостоятельность гуморального иммунитета (см. рис. 1).
Помимо этого выявлены дефекты функционирования системы НГ. На фоне отсутствия количественного прироста НГ в ответ на воспаление наблюдалось снижение %ФАН до 54,0 (47,5; 56,5) против 61,0 (60,0; 63,0)% в ГС (p < 0,05), %П до 40,6 (39,8;45,0) против 56,0 (51,0; 58,0)% в ГС (p < 0,05) и ИП до 0,8 (0,6; 1,0) против 1,6 (1,4; 2,4) в ГС (p < 0,05) (рис. 2).
Проведение стандартной этиопатогенетической терапии (антибактериальная терапия, противовоспалительная терапия, противогрибковая терапия, витаминотерапия, местная терапия антисептическими препаратами) привело к достижению мнимой клинической ремиссии. Так, оценка клеточного иммунитета в ГИ1а выявила отсутствие позитивного влияния проводимого лечения на восстановление показателей иммунной системы. Уровни Т-лимфоцитов, Т-хелперов, В-лимфоцитов не отличались от значений ГИ1 до лечения (p1–3 > 0,05) и были ниже, чем в ГС (p1–3 < 0,05). Отмечалось снижение количества ЕКК CD3-CD16+CD56+ с 19,4 (15,6; 23,0)% в ГИ1 до 13,6 (8,8; 16,3)% в ГИ1а и до 10,7 (9,8; 12,5)% в ГС (p > 0,05) (табл. 1). Одновременно с этим не наблюдалось восстановление процессов как захвата (%ФАН), так и переваривания (%П, ИП) бактериального антигена НГ (табл. 2). Недостаточная эффективность стандартной этиопатогенетической терапии свидетельствует о сохранении признаков иммунокомпрометированности на фоне позитивных клинических эффектов, связанных с купированием основных симптомов обострения ХВЗГТ, и не учитывает особенностей иммунопатогенеза данного заболевания и возможности коррекции дисфункции иммунной системы. К тому же имеется риск сохранения воспалительного процесса и высокая вероятность возникновения рецидивов ХВЗГТ в краткосрочном периоде после окончания терапии.
Выявленная дисрегуляция иммунной системы, обусловленная комбинированным дефектным функционированием Т- и В-клеточного иммунитета и системы НГ, диктует необходимость включения иммунопатогенетически обоснованной иммуномодулирующей терапии в комплексное лечение иммунокомпрометированных женщин с ХВЗГТ. С этой целью нами был использован препарат Имунофан®, основной действующей субстанцией которого является ГП: 45 мкг/мл 1 мл внутримышечно один раз в сутки в течение десяти дней (курсовая доза – 450 мкг).
Показана иммунологическая эффективность использования разработанной программы иммунотерапии. Так, наблюдалось восстановление количества Т-лимфоцитов, Т-хелперов до показателей ГС (p1–2 > 0,05), повышение уровня В-лимфоцитов с 9,1 (6,3; 10,4)% в ГИ1 до 11,1 (10,5; 12,4)% в ГИ1б до показателей ГС – 14,4 (12,3; 16,1)% (p > 0,05). Как и у женщин ГИ1а, у женщин в ГИ1б отмечалось снижение количества ЕКК CD3-CD16+CD56+ до 13,5 (9,6; 18,8)%, достигающее показателей женщин в ГС – 10,7 (9,8; 12,5)% (p > 0,05) (см. табл. 1).
Оценка фагоцитарной функции НГ после проведенной терапии с включением препарата Имунофан®, основной действующей субстанцией которого является ГП, продемонстрировала полное восстановление в ГИ1б процессов захвата бактериального антигена НГ (%ФАН) до показателей ГС и, что особенно важно, процессов киллинговой активности (%П, ИП) (p1–3 > 0,05) (см. табл. 2).
Выявленные эффекты коррекции дефектного функционирования иммунной системы сопровождались положительной клинической динамикой. В частности, отмечалась регрессия воспалительного процесса при обострении ХВЗГТ у иммунокомпрометированных женщин в виде уменьшения интенсивности и продолжительности болевого синдрома (боли внизу живота), выраженности дискомфорта в области наружных половых органов и ее длительности (рис. 3).
Оценка отдаленных результатов показала, что через шесть месяцев лечения при проведении иммуномодулирующей терапии препаратом Имунофан® в 88,5% случаев обострений ХВЗГТ не было. В 11,4% случаев возникло обострение ХВЗГТ вследствие медицинских манипуляций (биопсия шейки матки, экстракорпоральное оплодотворение с предшествующим введением глюкокортикостероидов). Однако после проведения стандартной терапии в 13,6% случаев возникли обострения ХВЗГТ уже через три месяца после лечения, а в катамнезе шести месяцев рецидивы ХВЗГТ были в 36,4% случаев. Кроме того, у иммунокомпрометированных женщин сократилась частота рекуррентных ОРВИ, обострений ВПГ 1/2-инфекции различной локализации после проведения программы лечения с включением препарата Имунофан®. В 100% случаев как во время лечения препаратом Имунофан®, так и в более поздние сроки после лечения побочных эффектов иммунотерапии не зарегистрировано.
Обсуждение
Таким образом, полученные в результате исследования данные свидетельствуют о дефекте Т-клеточного иммунитета, в большей мере за счет Т-хелперов, что приводит к дисрегуляции иммунной системы и отсутствию полноценного ответа на клинически выраженное обострение хронического воспалительного процесса в генитальном тракте [14]. Вероятно, увеличение уровня ЕКК связано с ответом на наличие у женщин с ХВЗГТ других критериев иммунокомпрометированности в виде рекуррентных ОРВИ, ГВИ, ВПЧ-инфекции [15]. Снижение содержания В-лимфоцитов предполагает функциональную несостоятельность гуморального иммунитета. В то время как неадекватная работа системы НГ не способствует клиренсу патогенов, поддерживает воспалительный процесс. Выявленные дисфункции иммунной системы при ХВЗГТ в полной мере отражают признаки иммунокомпрометированности, что требует разработки иммунопатогенетических подходов к лечению ХВЗГТ, что совпадает с мнением ряда исследователей [1–3, 16]. Одним из перспективных препаратов для коррекции дисрегуляции иммунной системы является фармпрепарат на основе ГП Имунофан®, который успешно используется при инфекционно-воспалительных заболеваниях вирусной, бактериальной и грибковой этиологии, аллергопатологии и ряде других иммунозависимых заболеваний [17, 18]. Предложенная программа иммуномодулирующей терапии позволила прежде всего посредством восстановления нарушенных функций иммунной системы модифицировать клиническое течение ХВЗГТ, уменьшив остроту обострений и предупредив в дальнейшем развитие рецидивов ХВЗГТ.
Заключение
Проведение традиционной терапии не способствует регрессу выявленных дефектов функционирования иммунной системы у иммунокомпрометированных женщин с вялотекущими или рецидивирующими ХВЗГТ, что приводит к возникновению рецидивов заболеваний уже через три месяца после лечения в 13,6% случаев, а через шесть месяцев – в 36,4% случаев. Клинический эффект стандартной терапии можно охарактеризовать как кратковременный и недостаточный, что диктует необходимость пересмотра патогенетической терапии и применения таргетной иммуномодулирующей терапии, направленной на коррекцию комбинированных дефектов иммунной системы при ХВЗГТ. В то же время полученные позитивные клинико-иммунологические эффекты комплексного лечения с включением иммуномодулирующей терапии свидетельствуют о целесообразности применения препарата Имунофан®, основной субстанцией которого является ГП, у иммунокомпрометированных женщин с данной патологией. Выявленное иммуномодулирующее влияние препарата Имунофан® способствует устранению дисрегуляции основных противоинфекционных механизмов адаптивного и врожденного иммунитета у женщин с вялотекущими или рецидивирующими ХВЗГТ, учитывая таргетное плейотропное действие препарата Имунофан® на различные клетки иммунной системы, что позитивно сказывается на характере и исходе обострения воспалительного процесса, а также оказывает протективный эффект – предупреждает возникновение рецидивов ХВЗГТ в 88,5% случаев спустя шесть месяцев после иммунопатогенетически обоснованной терапии. Успех комплексной терапии с включением препарата Имунофан® также связан с хорошей переносимостью лечения, отсутствием побочных эффектов и различных осложнений (аллергических реакций, дисбиоза слизистых урогенитального тракта и кишечника и др.).
I.V. Nesterova, MD, PhD, Prof., S.V. Kovaleva, MD, PhD, G.A. Chudilova, MD, PhD, S.Т. Pikturno, L.V. Lomtatidze, PhD, A.M. Chulkova, PhD, N.S. Prosolupova, Y.V. Teterin
Kuban State Medical University
Patrice Lumumba Peoples' Friendship University of Russia
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
The problem of traditional approaches to the treatment of women with indolent and recurrent chronic inflammatory diseases of the pelvic organs (pelvic inflammatory disease – PID) is closely associated with polysystemic lesions and immunocompromise in patients, which does not contribute to the achievement of stable remission and dictates the need search of new targeted immunotherapeutic strategies in the complex therapy of PID.
Aim – to evaluate the clinical and immunological efficacy of immunopathogenetically substantiated immunomodulatory therapy with Imunofan® in the correction of combined disorders of the immune system functioning of immunocompromised women with PID.
Material and methods. Conducted clinical-anamnestic and immunological examination of 57 women (20–40 years old) with PID in the period of exacerbation before treatment – study group 1 (SG1) and 20 conditionally healthy women – comparison group (CG). Immunocompromised women with PID underwent: in study group 1a (SG1a, n = 22) – traditional therapy and in study group 1b (SG1b, n = 35) – complex therapy with the inclusion of the drug Imunofan®: 45 μg/ml 1 ml intramuscularly 1 time per day for 10 days.
Results. In SG1 women, combined disorders of the functioning of T- and B-cell immunity, natural killer cells (NK) and neutrophilic granulocytes (NG) were revealed. Against the background of traditional therapy in SG1a, when an unstable clinical remission was achieved, there was a lack of a positive effect of the ongoing traditional treatment on the restoration of the immune system. On the contrary, in SG1b there was a restoration of the content of T- and B-lymphocytes, NK, phagocytic and killing activity of NG, which was accompanied by a regression in a shorter period of symptoms of inflammation during the exacerbation of PID and a decrease in the frequency of relapses 6 months after treatment.
Conclusion. The effects of complex treatment with the inclusion of immunomodulatory therapy with Imunofan®, which has a pleiotropic effect, helps to eliminate the dysregulation of the main anti-infective mechanisms of adaptive and innate immunity, which positively affects the nature and outcome of exacerbation of inflammation and prevents the occurrence of relapses of PID in immunocompromised women.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.