Расширение доказательной базы эффективности и безопасности базального аналога инсулина гларгин 300 ЕД/мл
- Аннотация
- Статья
- Ссылки
- English
С ноября 2016 г. в России применяется новый базальный аналог инсулина гларгин 300 ЕД/мл. Препарат отличается равномерным и пролонгированным профилем действия. Это обеспечивает снижение риска развития эпизодов гипогликемии.
В статье представлен обзор доказательной базы в отношении инсулина гларгин 300 ЕД/мл, в том числе результаты исследования BRIGHT и их субанализ.
С ноября 2016 г. в России применяется новый базальный аналог инсулина гларгин 300 ЕД/мл. Препарат отличается равномерным и пролонгированным профилем действия. Это обеспечивает снижение риска развития эпизодов гипогликемии.
В статье представлен обзор доказательной базы в отношении инсулина гларгин 300 ЕД/мл, в том числе результаты исследования BRIGHT и их субанализ.




Введение
Последние два десятилетия мировое сообщество столкнулось с пандемией хронических болезней. Речь, в частности, идет о таких заболеваниях, как сахарный диабет (СД), хронические болезни сердца, легких, почек. Нередко отмечается их сочетанное течение.
Согласно данным Всемирной организации здравоохранения, в 2014 г. в мире СД страдали 422 млн взрослых, что в четыре раза больше, чем в 1980 г. [1].
Из года в год число пациентов с диабетом неуклонно увеличивается, что в определенной степени связано с повышением численности и среднего возраста населения, популяции с избыточным весом или ожирением. При этом страны с низким и средним уровнем дохода по темпам прироста больных опережают страны с высоким уровнем дохода.
К 2045 г. эксперты Международной федерации диабета прогнозируют увеличение количества больных до 629 млн [2].
Россия входит в десятку стран с наибольшим числом пациентов с СД. По данным федерального регистра, в 2017 г. в нашей стране было 4,5 млн (3,06%) больных СД, из них с СД 1 типа – 256,1 тыс. (5,7%), с СД 2 типа – 4,1 млн (92,1%) [3].
Рост популяции больных, прежде всего с СД 2 типа, и частоты его хронических осложнений – одна из актуальных проблем здравоохранения. Самыми опасными последствиями заболевания являются системные сосудистые осложнения – нефропатия, ретинопатия, поражение сосудов сердца, головного мозга, периферических сосудов нижних конечностей. Именно они являются основной причиной инвалидизации и смерти пациентов. Так, согласно данным Всемирной организации здравоохранения, в 2016 г. диабет унес 1,6 млн человеческих жизней против менее 1 млн в 2000 г. и занял седьмое место среди причин смертности.
Учитывая данные о взаимосвязи компенсации углеводного обмена и частоты развития сосудистых осложнений, а также об эффективной защите бета-клеток от воздействия проапоптических стимулов, инсулинотерапию, при наличии показаний, можно рассматривать как наиболее эффективный вариант лечения СД 2 типа и единственно патогенетически обоснованный и жизненно необходимый при СД 1 типа.
Исследование ACHIEVE показало, что в России терапия базальным инсулином назначается при уровне гликированного гемоглобина (HbA1c) 9,7%, готовыми смесями – при HbA1c 10,1%, в базис-болюсном режиме – при HbA1c 10,4%. Эти данные свидетельствуют о тенденции начинать инсулинотерапию только при HbA1c > 9,0% [4]. Такая клиническая инертность не позволяет достигать целевых значений гликемии даже при применении высокоэффективных препаратов.
Необходимо отметить, что первый аналог базального инсулина суточного действия – инсулина гларгин 100 ЕД действующего вещества в 1 мл раствора появился в 2000 г. (в России зарегистрирован в марте 2003 г.). Препарат позволил существенно расширить возможности управления СД. Так, в отличие от инсулина НПХ он обладает большей продолжительностью действия, ассоциируется с меньшей частотой гипогликемии, характеризуется равномерным высвобождением из подкожно-жировой клетчатки и сниженной вариабельностью [5]. Как следствие, существенно повышается качество жизни пациентов и их приверженность терапии.
Минимальный риск гипогликемий и сердечно-сосудистая безопасность инсулина гларгин доказаны в исследовании ORIGIN [6].
Использование инсулина гларгин позволяет сократить расходы на лечение. Так, гларгин оказался экономически выгоднее детемира на 36–39% за счет продолжительности действия [7, 8].
Несмотря на эффективность, хорошую переносимость и благоприятный профиль безопасности инсулина гларгин 100 ЕД/мл, при титрации дозы риск гипогликемий увеличивался, а в ряде случаев длительность его действия не достигала 24 часов.
Дальнейшие разработки привели к появлению инновационной формы инсулина гларгин 300 ЕД/мл. Новый препарат Туджео СолоСтар® применяется в России с ноября 2016 г.
Туджео СолоСтар®
В Туджео СолоСтар® в 1 мл раствора концентрация действующего вещества в три раза выше. Поэтому при введении одинакового количества единиц объем инсулина гларгин 300 ЕД/мл будет соответствовать одной трети объема инсулина гларгин 100 ЕД/мл. За счет уменьшения площади поверхности преципитата скорость высвобождения гларгина при введении 300 ЕД/мл меньше, чем при введении 100 ЕД/мл [9]. Как следствие, обеспечивается более равномерный фармакокинетический профиль и длительный период действия – до 36 часов [10].
Программа EDITION
Клиническую эффективность и безопасность инсулина гларгин 300 ЕД/мл и инсулина гларгин 100 ЕД/мл сравнивали в программе EDITION [11–13]. EDITION – многоцентровое рандомизированное открытое шестимесячное клиническое исследование фазы IIIа. В него было включено более 3500 пациентов с неконтролируемым СД.
EDITION состояло из четырех исследований. В исследованиях EDITION 1–3 участвовали пациенты с СД 2 типа (n = 2496), в исследовании EDITION 4 – больные СД 1 типа.
В исследования EDITION 1–3 не включали пациентов с уровнем HbA1c менее 7,0%. В EDITION 1 ограничение по верхнему значению HbA1cоставляло более 10%, EDITION 3 – более 11%.
Все исследования программы EDITION имели схожий дизайн.
В исследование EDITION 1 были отобраны получавшие базальный инсулин короткого действия [11], в EDITION 2 – получавшие базальный инсулин в комбинации с пероральными сахароснижающими препаратами [12], в EDITION 3 – принимавшие только пероральные препараты [13].
В группу инсулина гларгин 300 ЕД/мл было рандомизировано 1247 пациентов, в группу гларгина 100 ЕД/мл – 1249.
В исследованиях EDITION 1–3 использовались модифицированные шприц-ручки. Дозу препарата титровали до достижения целевого диапазона гликемии натощак 4,4–5,6 ммоль/л.
Результаты трех исследований EDITION продемонстрировали сопоставимость эффектов инсулинов гларгин 300 и 100 ЕД/мл в достижении гликемического конт-роля. Уровень HbA1c в группах в среднем снизился на 1,02 ± 0,03% (при 95%-ном доверительном интервале (ДИ) -0,08–0,07%). Необходимо также отметить, что через шесть месяцев группы оказались сопоставимыми по вариабельности гликемии натощак – 20,0 ± 0,32% для гларгина 300 ЕД/мл и 20,0 ± 0,33% для гларгина 100 ЕД/мл. Разница 0,02% (95% ДИ 0,89–0,93).
Несмотря на то что тяжелая гипогликемия встречалась редко, инсулин гларгин 300 ЕД/мл превосходил инсулин гларгин 100 ЕД/мл в отношении кумулятивного количества случаев ночной подтвержденной или тяжелой гипогликемии. Разница составила 14%. Так, в исследованиях EDITION 2 и 3 риск гипогликемии снизился на 23 и 25%, в EDITION 1 – всего на 5%. Уменьшение частоты гипогликемии отмечалось уже в первые восемь недель лечения, а также на протяжении всего периода лечения. Данный эффект можно объяснить фармакокинетическими и фармакодинамическими особенностями инсулина гларгин 300 ЕД/мл.
За период исследования доза базального инсулина увеличилась в обеих группах, особенно в первые 12 недель. Средняя доза инсулина гларгин 300 ЕД/мл составила 0,85 ± 0,36 ЕД/кг/сут, инсулина гларгин 100 ЕД/мл – 0,76 ± 0,32 ЕД/кг/сут. Таким образом, в группе гларгина 300 ЕД/мл доза была больше на 12%. Данная тенденция наблюдалась во всех трех исследованиях EDITION. Полагают, что это может быть связано с более длительным депонированием инсулина гларгин 300 ЕД/мл в подкожной клетчатке и увеличением ферментативной инактивации тканевыми пептидазами в месте инъекции.
Увеличение дозы препаратов могло повлиять на массу тела пациентов – +0,51 ± 0,10 кг в группе гларгина 300 ЕД/мл и +0,79 ± 0,10 кг в группе гларгина 100 ЕД/мл. В первом случае набор массы тела был меньше – разница составила 0,28 кг (95% ДИ -0,55– -0,01), p = 0,039.
Частота побочных эффектов была сопоставимой во всех трех исследованиях EDITION. Нежелательные явления выявлены у 57,3% получавших инсулин гларгин 300 ЕД/мл и у такого же количества получавших инсулин гларгин 100 ЕД/мл. В группе инсулина гларгин 300 ЕД/мл реакции в местах инъекций зафиксированы у 2,4% пациентов, в группе инсулина гларгин 100 ЕД/мл – у 3,1%. Серьезные нежелательные явления – у 5,2% получавших гларгин 300 ЕД/мл и у 5,0% получавших гларгин 100 ЕД/мл. В группе гларгина 300 ЕД/мл про-изошло четыре (0,3%) летальных исхода, в группе гларгина 100 ЕД/мл – три (0,2%). Необходимо отметить, что они не были связаны с приемом препаратов [11–13].
Таким образом, в исследованиях EDITION 1–3 инсулин гларгин 300 ЕД/мл продемонстрировал сопоставимый с инсулином гларгин 100 ЕД/мл сахароснижающий эффект, но с меньшим риском развития гипогликемических состояний в течение суток и в ночное время, а также набора массы тела.
Оценка фармакологической активности
Фармакологическая активность инсулина гларгин 300 ЕД/мл была изучена R.H. Becker и соавт. В ходе клинического исследования пациентам с СД 1 типа (n = 50) вводили инсулин в дозе 0,4 ЕД/кг/сут на протяжении шести дней [14]. Выявлена низкая вариабельность концентраций инсулина, медианное кумулятивное действие линейно увеличивалось в течение 24 часов, срединное колебание средней концентрации составляло 3,3 (2,7–4,7) мкЕД/мл. Срединная вариабельность за 24 часа – 1,8 (1,6–2,1), перепад – 0,8 (0,6–1,1), колебание между максимальной и минимальной концентрациями в равновесном состоянии – 0,6 (0,4–0,8). Средний показатель вариабельности за один день составил 17,4% с коэффициентом вариабельности действия между участниками 34,8%. Следовательно, после введения инсулина гларгин 300 ЕД/мл наблюдались низкие колебания концентраций с высоким уровнем воспроизводимости действия.
В другом исследовании R.H. Becker и соавт. [15] сравнили фармакокинетические и фармакодинамические профили инсулинов гларгин 300 и 100 ЕД/мл в равновесном состоянии после введения один раз в сутки в течение восьми дней у пациентов с СД 1 типа (С-пептид плазмы < 0,3 нмоль/л). Для этого исследователи использовали эугликемический клэмп. На восьмой день после последнего введе-ния инсулинов в дозе 0,4 ЕД/кг эугликемия сохранялась в течение 32,7 и 28,7 часа соответственно. При введении гларгина 300 ЕД/мл в дозе 0,6 ЕД/кг эугликемия сохранялась до 35,3 часа. Экспозиция инсулина гларгин 300 ЕД/мл характеризовалась более ровным распределением на протяжении всего периода клэмпа по сравнению с экспозицией инсулина гларгин 100 ЕД/мл. При введении 300 ЕД/мл жесткий гликемический контроль (≤ 105 мг/дл (5,9 ммоль/л)) удерживался на пять часов дольше (в среднем 30 часов), чем при использовании гларгина 100 ЕД/мл, также наблюдалась низкая 24-часовая и межсуточная вариабельность экспозиции.
Таким образом, в равновесном состоянии гларгин 300 ЕД/мл обладает более равномерным и пролонгированным фармакокинетическим профилем по сравнению с гларгином 100 ЕД/мл.
Исследование BRIGHT и субанализ его результатов
Сравнение инсулина гларгин 300 ЕД/мл проводилось не только с базальными инсулинами первого поколения, но и с базальным инсулином второго поколения, в частности с инсулином сверхдлительного действия деглудек 100 ЕД/мл [16].
В прямом сравнительном рандомизированном контролируемом 24-недельном исследовании BRIGHT участвовали пациенты с неконтролируемым СД 2 типа, ранее не получавшие инсулин.
Пациенты были рандомизированы в соотношении 1:1 в группы гларгина 300 ЕД/мл (n = 466) и деглудека 100 ЕД/мл (n = 463).
Оба препарата вводили в вечернее время. Дозу подбирали до достижения уровня глюкозы плазмы натощак 4,4–5,6 ммоль/л. Его пациенты измеряли самостоятельно. Схема подбора дозы базального аналога инсулина приведена в табл. 1. Дозу титровали не реже одного раза в неделю, но не чаще одного раза в три дня.
В качестве первичной конечной точки выбрано изменение уровня НbА1с через 24 недели по сравнению с исходными величинами.
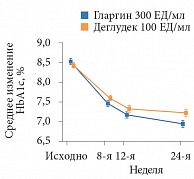
Через 24 недели в обеих группах отмечено сопоставимое снижение показателей HbА1с – с 8,7% в группе гларгина 300 ЕД/мл и 8,6% в группе деглудека 100 ЕД/мл до 7,0%. Наименьшие квадраты средних различий – 0,05% (95% ДИ -0,15–0,05), что свидетельствовало о не меньшей эффективности инсулина гларгин 300 ЕД/мл (р < 0,0001). Доля пациентов с эпизодами гипогликемии и частота эпизодов гипогликемии через 24 недели в обеих группах были также сопоставимыми. Однако в период активной титрации дозы (до 12-й недели) доля пациентов с подтвержденной гипогликемией и частота эпизодов подтвержденной гипогликемии (≤ 3,9 и < 3,0 ммоль/л) в любое время суток были ниже в группе инсулина гларгин 300 ЕД/мл.
Достижение целевой гликемии в период титрации дозы
В течение первых недель лечения базальным инсулином пациентам подбирают оптимальную дозу. Это очень важный период: от него зависит приверженность терапии [17].
Основная цель данного периода – достижение необходимых значений дозы инсулина и целевых показателей глюкозы [18]. Подбор дозы инсулина ограничен множеством факторов как со стороны пациента, так и со стороны врача [19].
Установлено, что развитие гипогликемических состояний в первые 12 недель от начала применения базальных инсулинов ассоциируется с увеличением общего риска таковых. Кроме того, невозможность достичь целевых показателей в период подбора дозы повышает риск их недостижения в будущем [18–21].
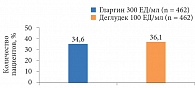
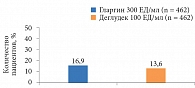
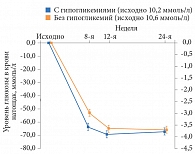
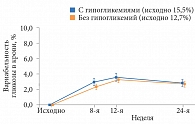
Дополнительный анализ результатов исследования BRIGHT на 12-й неделе показал, что число достигших уровня HbA1c < 7,0% было сопоставимым в обеих группах (рис. 1). В то же время доля пациентов, достигших данного показателя без гипогликемии, к 12-й неделе была выше среди получавших инсулин гларгин (рис. 2) [22].
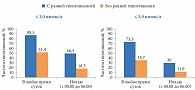
На четвертой и восьмой неделях доля участников, которые достигли уровня глюкозы плазмы натощак ≤ 7,2 ммоль/л (согласно рекомендациям Американской диабетической ассоциации [23]), была больше среди получавших инсулин деглудек. На 12-й неделе значимых различий между группами уже не наблюдалось (рис. 3) [22].
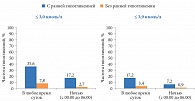
На первой – пятой неделях исследования число достигших целевых значений гликемического контроля без гипогликемии было выше в группе инсулина деглудек. Аналогичных показателей пациенты группы гларгина достигли на 6–12-й неделях, что было обусловлено снижением частоты гипогликемии (рис. 4) [22].
Таким образом, в период активной титрации дозы инсулина риск гипогликемии был ниже у получавших гларгин. Меньший риск гипогликемии в этот период может способствовать повышению приверженности терапии [19].
Кроме того, на момент окончания периода титрации дозы более 75% пациентов достигли целевого значения глюкозы плазмы натощак [22].
Полученные данные свидетельствуют, что базальные аналоги инсулина второго поколения могут обеспечить более полноценную титрацию дозы для достижения целевой гликемии без повышения риска развития гипогликемических состояний.
Клиническая характеристика пациентов с гипогликемией и возможные исходы
Для клинической практики важно знать, какие пациенты с СД находятся в зоне повышенного риска развития гипогликемий. Ответ на этот вопрос дал субанализ результатов исследования BRIGHT.
Среди 929 больных 466 получали гларгин, 463 – деглудек. Завершили исследование 94,2% пациентов.
Для оценки эффективности и безо-пасности получавшие гларгин и деглудек были объединены. Результаты проанализированы с помощью методов описательной статистики.
Участники исследования BRIGHT были разделены на две подгруппы: с (n = 470) и без гипогликемий (n = 454) в период титрации дозы. Подтвержденной считалась гипогликемия при ≤ 3,9 или < 3,0 ммоль/л вне зависимости от наличия симптомов, а также тяжелая гипогликемия, потребовавшая медицинской помощи [24].
Гипогликемия в период титрации выявлена у 470 (50,9%) пациентов. Среди них преобладали лица старшего возраста, с более низким индексом массы тела (ИМТ), выраженной нефропатией, большей длительностью диабета, а также получавшие препараты сульфонилмочевины и меглитиниды (табл. 2).
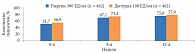
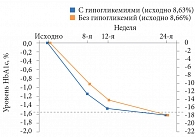
Установлено, что пациенты с гипогликемиями в период титрации достигали большего снижения HbA1c по сравнению с пациентами без гипогликемий (рис. 5). Тем не менее на 24-й неделе значимого различия в отношении снижения уровня HbA1с между подгруппами не наблюдалось. Аналогичные результаты получены при сравнении уровня глюкозы плазмы натощак и профиля вариабельности гликемии (рис. 6 и 7) [24].
Частота гипогликемий (≤ 3,9 или < 3,0 ммоль/л) на 13-й и 14-й неделях среди тех, у кого при титрации дозы была отмечена гипогликемия, была выше, чем у пациентов без гипогликемий в указанный период (рис. 8 и 9).
Таким образом, титрация базального инсулина в первые недели терапии имеет решающее значение для достижения целей гликемического контроля и улучшения отдаленных результатов.
При субанализе данных исследования BRIGHT также было установлено, что гипогликемии в период титрации ассоциируются с повышением риска развития гипогликемии в любое время суток в период поддерживающей терапии. Следовательно, уменьшение риска гипогликемий в период титрации позволяет снизить указанный риск в дальнейшем [24].
Эффективность и безопасность в некоторых группах пациентов
Пациенты с хронической болезнью почек
Распространенность хронической болезни почек среди больных СД 2 типа достигает 38%. Примерно у 20% из них отмечаются 3a и 4 стадии хронической почечной недостаточности [25]. Данная патология признана независимым фактором риска развития гипогликемий. Кроме того, хроническая болезнь почек увеличивает сердечно-сосудистую заболеваемость и смертность.
Из-за повышенного риска гипогликемии и снижения почечного клиренса у пациентов с СД 2 типа и хронической болезнью почек следует проявлять осторожность при назначении некоторых сахароснижающих препаратов, включая инсулин [26].В связи с этим важно было оценить безопасность и эффективность инсулинотерапии в данной популяции.
У пациентов с нарушением функции почек (расчетная скорость клубочковой фильтрации (СКФ) < 60 мл/мин/1,73 м2) при применении инсулина гларгин 300 ЕД/мл наблюдалось достоверно более выраженное снижение уровня HbA1c, чем при использовании инсулина деглудек. Различие средних по методу наименьших квадратов относительно инсулина деглудек -0,43% (95% ДИ -0,74– -0,12). При этом группы терапии не различались по частоте эпизодов гипогликемии (рис. 10) [27].
Пациенты пожилого возраста
Еще одной уязвимой группой являются лица старшей возрастной группы. Неадекватный гликемический контроль в данной популяции ассоциируется с повышенным риском смерти [28]. Учитывая это, было проведено сравнение инсулина гларгин 300 ЕД/мл и инсулина деглудек в отношении снижения HbA1c и риска гипогликемии у пожилых пациентов с СД 2 типа. Гларгин обеспечивал сопоставимое с деглудеком снижение HbA1c в целом по группе пожилых пациентов. Однако у лиц 70 лет и старше отмечено достоверно большее снижение показателя на фоне инсулина гларгин 300 ЕД/мл (рис. 11). Риск гипогликемии в обеих группах был сопоставимым [29].
Заключение
С ноября 2016 г. в Российской Федерации применяется новый базальный аналог инсулина, содержащий молекулу инсулина гларгин в концентрации 300 ЕД/мл. Увеличение концентрации действующего вещества привело к изменению фармакокинетики и фармакодинамики препарата и, следовательно, дополнительным клиническим преимуществам. Речь, в частности, идет об увеличении длительности и более ровном профиле действия, имитирующем физиологическую секрецию инсулина. Это в свою очередь снижает риск развития гипогликемии.
Результаты проведенных рандомизированных клинических исследований подтверждают, что базальный аналог инсулина последнего поколения – инсулин гларгин 300 ЕД/мл обладает эффективностью и высоким профилем безопасности при лечении пациентов с сахарным диабетом.
A.M. Mkrtumyan, MD, PhD, Prof.
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
Contact person: Ashot M. Mkrtumyan, vagrashot@mail.ru
According to the results of studies, in Russia, when initiating basal insulin therapy, the average level of glycated hemoglobin in patients is 9.7%, ready-mix therapy – 10.1%, basic bolus therapy – 10.4%. One of the key barriers preventing timely insulin administration is the increased risk of hypoglycemia. Since November, 2016, a new basal insulin analogue glargine 300 U/ml has been used in Russia. The drug is being distinguished by uniform and prolonged action profile. This reduces the risk of hypoglycemia episodes.
The article presents an overview of the evidence base for insulin glargine 300 U/ml, including the results of the BRIGHT study and their sub-analysis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


