Состояние диастолической функции левого желудочка и эндотелиальной функции у больных сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English

Введение
Сахарный диабет (СД) 2 типа – независимый фактор риска развития сердечной недостаточности и сердечно-сосудистых осложнений. Около 80% пациентов с СД умирают от сердечно-сосудистых заболеваний. Известно, что сердечная недостаточность встречается в 4 раза чаще у мужчин и в 8 раз чаще у женщин с СД 2 типа в возрасте 65 лет, чем в общей популяции [1]. Ежегодно сердечная недостаточность развивается у 3,3% больных СД 2 типа, не имевших признаков сердечной недостаточности изначально [2]. В исследовании SOLVD (Studies on Left Ventricular Dysfunction – Исследование дисфункции левого желудочка) диабет был определен как независимый фактор риска смерти [3]. В исследовании DIGAMI (Diabetes Mellitus Insulin-Glucose Infusion in Acute Myocardial Infarction – Сахарный диабет, инфузии глюкозы с инсулином в острую фазу инфаркта миокарда) сердечная недостаточность оказалась наиболее частой причиной летального исхода среди больных СД 2 типа, перенесших инфаркт миокарда, и обусловила 66% смертельных случаев в год [4].
СД является независимым от возраста, артериальной гипертонии, ишемической болезни сердца, ожирения, гиперлипидемии предиктором развития хронической сердечной недостаточности [5]. По данным исследования UKPDS (UK Prospective Diabetes Study – Проспективное исследование сахарного диабета в Великобритании), частота встречаемости хронической сердечной недостаточности у больных СД пропорциональна уровню гликированного гемоглобина (HbA1c) и риск ее развития составляет около 3% в год [6].
Первым доклиническим признаком нарушения сердечной деятельности при СД 2 типа большинством исследователей признается диастолическая дисфункция левого желудочка [7, 8]. Важная роль отводится дисфункции эндотелия, которая, как правило, сопутствует СД и является одной из патогенетических основ развития осложнений. Все это обусловливает важность применения инструментальных методов исследования для выявления показателей диастолической и эндотелиальной дисфункции и применения препаратов, способных корректировать нарушения. В настоящее время в реальной клинической практике доступен такой метод функциональной диагностики, как эхокардиография с оценкой трансмитрального кровотока. Возможно также проведение пробы с постокклюзионной гиперемией для оценки показателей диастолической функции левого желудочка и эндотелиальной функции.
Для лечения СД в настоящее время используется большое количество препаратов, многие из которых имеют побочные действия: способствуют увеличению массы тела, повышают риск развития гипогликемии, не замедляют потерю функциональной активности бета-клеток поджелудочной железы. Кроме того, несмотря на проводимое лечение, в результате применения комбинации препаратов двум третям пациентов не удается достичь целевого уровня гликемии и снизить риск сердечно-сосудистых заболеваний [6].
Открытие инкретиновых гормонов привело к появлению нового класса сахароснижающих препаратов на основе эффекта инкретинов. Такие препараты могут использоваться не только в качестве альтернативы имеющимся сахароснижающим препаратам, но и как препараты, благотворно влияющие на состояние сердечно-сосудистой системы у пациентов с СД 2 типа, поскольку рецепторы инкретинов обнаружены в сердце, эндотелии сосудов, других органах и тканях [8].
Цели и задачи исследования
Нами было проведено шестимесячное исследование с целью оценки диастолической и эндотелиальной функции у пациентов с СД 2 типа на фоне терапии эксенатидом. Были определены следующие задачи:
- Изучить диастолическую функцию левого желудочка у пациентов с СД 2 типа до и после терапии эксенатидом.
- Изучить состояние эндотелиальной функции у наблюдаемых пациентов до и после терапии эксенатидом.
- Изучить состояние углеводного обмена на фоне проводимой сахароснижающей терапии.
Материалы и методы
Под нашим наблюдением в поликлинике Минэкономразвития России находились 70 пациентов с СД 2 типа в возрасте от 40 до 75 лет, индекс массы тела – 25,0–39,1 кг/м2, длительность диабета – от 3 до 20 лет. До начала исследования все пациенты прошли сахароснижающую терапию: 84% получали таблетированные сахароснижающие препараты (метформин в суточной дозе 2000 мг и препараты сульфонилмочевины), 16% – комбинированное лечение (инсулин и таблетированные сахароснижающие препараты).
Степень компенсации углеводного обмена оценивали по уровню HbA1c, который определялся в клинико-диагностическом отделении поликлиники Минэкономразвития РФ методом иммунохроматографии на аппарате анализатора гликированного гемоглобина Glycomat DS – 5N11 (производство Drew Scientific, Великобритания). В обследуемой группе 52% пациентов имели уровень HbA1c до 7,5%, 48% пациентов – более 7,5%.
У всех пациентов отмечалась артериальная гипертония второй степени, в связи с чем больные получали терапию ингибиторами ангиотензинпревращающего фермента в среднетерапевтических дозах.
Все пациенты прошли эхокардиографическое исследование с соотношением интервалов электрокардиограммы с фазами сердечного цикла (заведующая кабинетом функциональной диагностики А.О. Петросян).
Всем пациентам проводилось эхокардиографическое исследование сердца в отделении функциональной диагностики поликлиники врачом О.А. Новоселовой на аппарате Mindray (Shenzhen Mindray Bio-Medical Electronics Co., Ltd) датчиком 3,25 МГц в М-модальном и двухмерном режимах в стандартных эхографических позициях с использованием импульсной и постоянно-волновой допплерографии и цветового допплеровского картирования.
Трансмитральный кровоток оценивался в режиме импульсного допплера из верхушечной четырехкамерной позиции. Для оценки диастолической функции измерялись следующие скоростные и временные показатели: максимальная скорость кровотока раннего диастолического наполнения (Е, см/с), максимальная скорость кровотока во время предсердной систолы (А, см/с), время замедления кровотока раннего диастолического наполнения левого желудочка (DT, мс), время изоволюметрического расслабления (IVRT, мс) и соотношение Е/А. Диастолическую дисфункцию устанавливали при IVRT > 160 мс, DT > 220 мс, соотношении Е/А < 1.
Кроме того, для оценки функционального состояния эндотелия проводилась проба с постокклюзионной реактивной гиперемией по классической методике, предложенной D.S. Celermajer, в модификации О.В. Ивановой. Исследование проводилось утром, натощак, в положении больного на спине после 10–15-минутного отдыха. На плечо накладывалась манжета сфигмоманометра. Для измерения диаметра сосуда использовался линейный датчик с частотой 7,5 МГц, снабженный допплеровской функцией. Изображение оценивалось в одно- и двухмерном режимах. Датчик располагали в продольном направлении ниже места наложения манжеты, на 2–10 см выше локтевой ямки. Определялся базальный диаметр сосуда как расстояние между проксимальным и дистальным по отношению к датчику сигналом. Стимулом, вызывающим реактивную гиперемию в плечевой артерии, являлась пятиминутная компрессия сосуда, достигавшаяся нагнетанием в манжету давления, на 50 мм рт. ст. превышающего систолическое артериальное давление, измеренное до начала проведения теста. После быстрого снижения давления в манжете в изучаемом сегменте артерии проводились измерения диаметра на первой, второй и третьей минутах после реперфузии, в фазу диастолы. Нормальной реакцией считалась дилатация артерии на фоне постокклюзионной реактивной гиперемии более чем на 10% от исходного диаметра, меньшее ее значение или вазоконстрикция считались патологическими и свидетельствовали о снижении вазомоторной функции эндотелия.
Одновременно оценивалась усредненная по времени скорость кровотока. Величина объемной скорости кровотока вычислялась как произведение площади поперечного сечения сосуда на усредненную по времени скорость кровотока. Исследование проводилось в отделении функциональной диагностики совместно врачами М.И. Свиридовой и О.А. Новоселовой.
После предварительного обследования пациенты были рандомизированы на две группы:
основная группа (n = 50): к таблетированным сахароснижающим препаратам был добавлен миметик глюкагоноподобного пептида 1 (ГПП-1) эксенатид (Баета) в режиме двухкратных подкожных инъекций в дозе 5 мкг два раза в сутки в течение месяца, затем – 10 мкг два раза в сутки в течение пяти месяцев;
группа сравнения (n = 20): пациенты продолжали получать предшествующую сахароснижающую терапию.
В течение полугода с пациентами обеих групп проводились беседы о необходимости соблюдения принципов питания с исключением легкоусвояемых углеводов, ограничением жиров, необходимости увеличения физической активности, проводился мониторинг дневников самоконтроля один раз в месяц с коррекцией сахароснижающей терапии.
Через шесть месяцев лечения в клинико-диагностической лаборатории всем пациентам проведено повторное измерение уровня HbA1c, антропометрических показателей, повторно выполнены эхокардиография, электрокардиография, проведена проба с постокклюзионной реактивной гиперемией.
Статистическая обработка результатов исследования осуществлялась с помощью пакета прикладных программ Statistiсa 6. Для оценки достоверности различий использовался t-критерий Стьюдента для рядов с нормальным распределением переменных. Различия считались достоверными при значениях р < 0,05. Зависимость показателей оценивалась методом Спирмана с расчетом коэффициента корреляции. Результаты представлены в виде М ± SD, где М – среднее арифметическое, SD – среднестатистическое отклонение.
Результаты
Оценка состояния компенсации углеводного обмена по интегральному показателю HbA1c не показала наличия соотношения между имеющимися признаками диастолической и эндотелиальной дисфункции и степенью компенсации диабета. В обеих группах признаки диастолической дисфункции и эндотелиальной дисфункции были определены более чем у 70% пациентов независимо от уровня гликированного гемоглобина (у 72% пациентов с уровнем HbA1c < 7,5% и у 73% пациентов с уровнем HbA1c > 7,5%).
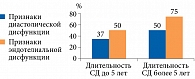
При помощи инструментальных обследований в отделении функциональной диагностики было изучено влияние длительности СД на состояние диастолической и эндотелиальной функции. Распространенность диастолической дисфункции и эндотелиальной дисфункции при длительности СД более 5 лет достоверно выше, чем при длительности заболевания менее 5 лет (рисунок).
Было проведено сравнение антропометрических показателей, скорости кровотока, состояния диастолической и эндотелиальной функций у пациентов основной группы (до и после завершения терапии эксенатидом) и пациентов контрольной группы (таблица).
В группе эксенатида отмечено снижение HbA1c по сравнению с группой контроля (основная группа – с 8,2 ± 1,2 до 7,4 ± 1,1%, контрольная – с 7,6 ± 0,7 до 7,4 ± 0,5%, p < 0,0008).
У пациентов, принимавших эксенатид, также зафиксировано уменьшение массы тела – в среднем на 6 кг, в группе сравнения этот показатель практически не изменился.
Соотношение Е/А у пациентов, получающих лечение эксенатидом, увеличилось с 0,8 ± 0,2 до 0,9 ± 0,2 (p < 0,01), пик Е вырос с 68,2 до 73,9 см/с, p < 0,09. В группе контроля, наоборот, отмечалось ухудшение соотношения Е/А.
В основной группе при проведении пробы с окклюзионной гиперемией наблюдалась тенденция к увеличению изменения диаметра плечевой артерии, которое в среднем составило от 3,6 до 4,8% с вероятностью 0,3 (в группе контроля данной тенденции не выявлено).
При анализе данных электрокардиографии изначально в обеих группах пациентов не отмечено удлинение интервала QTs. После лечения в течение полугода в обеих группах уменьшилась длительность интервала QTs.
Обсуждение
У пациентов с СД 2 типа выявлена зависимость диастолической дисфункции и состояния эндотелиальной функции от длительности СД. Полученные результаты позволяют считать, что назначение эксенатида благотворным образом влияет на состояние углеводного обмена и улучшает показатели эндотелиальной функции у пациентов с СД 2 типа, в подавляющем большинстве имеющих нарушения даже при небольшой длительности заболевания. Проба с окклюзионной гиперемией демонстрировала увеличение диаметра плечевой артерии, которое было получено только в группе пациентов, получающих эксенатид, хотя улучшение показателей углеводного обмена достигнуто в обеих группах. Таким образом, можно сказать, что в основе улучшения эндотелиальной функции лежит не только улучшение углеводного обмена, но и дополнительное вазопротективное действие аналогов ГПП-1, рецепторы которых обнаружены в эндотелии сосудов, сердце и во многих других органах и тканях.
Вместе с тем в группе пациентов, получающих эксенатид, определены показатели, свидетельствующие и об улучшении диастолической функции у пациентов с СД 2 типа. Так, было отмечено увеличение соотношения Е/А, что позволяет говорить о кардиопротективном эффекте препарата уже в ходе шестимесячного курса лечения.
Выводы
- Применение аналога ГПП-1 (эксенатид) улучшает состояние углеводного обмена у пациентов с СД 2 типа.
- Применение эксенатида снижает массу тела тучных пациентов с СД 2 типа.
- Получены данные об улучшении показателей эндотелиальной функции, диастолической функции пациентов с СД 2 типа, что позволяет использовать препарат для коррекции кардиоваскулярных нарушений, которые отмечаются у подавляющего большинства пациентов независимо от состояния углеводного обмена.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.