Современное представление об адъювантной лекарственной терапии меланомы кожи высокого риска
- Аннотация
- Статья
- Ссылки
- English
Введение
Адъювантная лекарственная терапия направлена на снижение риска рецидива и прогрессирования заболевания, увеличение общей выживаемости (ОВ) при сохранении качества жизни, поскольку речь идет о потенциально хирургически излеченных пациентах. Вариантами лекарственной терапии у пациентов с наличием мутации в гене BRAF являются иммунотерапия ингибиторами контрольных точек иммунного ответа (ИКТИ) или комбинированная таргетная терапия iBRAF/iMEK. У пациентов без мутации в гене BRAF выбор более ограничен – использование ИКТИ или терапии интерфероном (по поводу которой споры и обсуждение потенциальной эффективности и переносимости идут уже долгие годы в профессиональном сообществе). Ежедневный выбор врача должен основываться на результатах имеющихся исследований, оценке рисков и пользы для каждого конкретного пациента.
Обсуждение
Назначение адъювантной лекарственной терапии требуется значительной доле пациентов с меланомой кожи, включая стадии IIB, IIC, III и IV при условии радикального хирургического лечения. Необходимость адъювантной терапии обусловлена отдаленными результатами и прогнозом: если у пациентов с IIA стадией пяти- и десятилетняя выживаемость составляет 94 и 88%, то начиная со стадии IIB эти показатели снижаются до 87 и 82% соответственно. Показатели выживаемости для пациентов с III стадией сильно различаются в зависимости от подстадии: если для IIIA стадии пяти- и десятилетняя выживаемость составляет относительно высокие значения 93 и 88%, сопоставимые с IIA стадией, то для IIID стадии эти значения резко снижаются до 32 и 24% соответственно [1]. Помимо этого, адъювантная терапия также проводится пациентам в случае рецидива или прогрессирования заболевания после радикального хирургического лечения.
С целью улучшения результатов лечения активно ведутся исследования в области неоадъювантной терапии. В настоящее время имеющиеся данные представлены результатами исследований I–II фаз. Несмотря на первые успехи такого подхода, требуются дальнейшее наблюдение и исследования III фазы, чтобы определить место неоадъювантной терапии в лечении пациентов с меланомой кожи. Зарубежные рекомендации, в частности NCCN, предлагают использовать неоадъювантную терапию только в рамках клинических исследований [2]. Мы видим тенденцию – лекарственное лечение «переносится» на все более ранние и потенциально хирургически удалимые стадии, поскольку дальнейший прогноз и возможность улучшить результаты зависят от лекарственной терапии. Адъювантная терапия остается стандартом лечения пациентов с меланомой кожи стадий IIB–IV, хотя результаты исследования II фазы SWOG S1801 [3] нашли свое отображение в последней версии практических рекомендаций Российского общества клинических онкологов (RUSSCO) [4], которые предлагают пациентам с клинически выявленными резектабельными метастазами в регионарных лимфоузлах (стадии IIIB–IIID) проводить на первом этапе неоадъювантную терапию пембролизумабом.
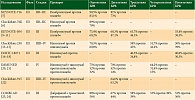
Большая часть адъювантной терапии меланомы кожи высокого риска (IIB–IV стадии) представлена монотерапией анти-PD-1, за исключением вариантов комбинированной иммунотерапии в IV стадии и комбинированной таргетной терапии в III стадии у пациентов с мутацией в гене BRAF V600E/K (таблица).
Адъювантная терапия стадий IIB–IIC представлена иммунотерапией анти-PD-1, в первую очередь пембролизумабом. Данный подход основан на результатах исследования III фазы KEYNOTE-716, в котором 976 человек получили пембролизумаб против плацебо в соотношении 1:1 [5]. На медиане наблюдения 27 месяцев безрецидивная выживаемость (БРВ) была выше в группе пембролизумаба: двухлетняя БРВ составила 81% против 73% (отношение рисков (ОР) 0,64, 95% доверительный интервал (ДИ) 0,50–0,84).
Первые результаты другого исследования III фазы CheckMate-76K были представлены относительно недавно – осенью 2022 г. [6]. В этом исследовании участвовали 790 человек, которые получили адъювантную терапию ниволумабом или плацебо в соотношении 1:1. На медиане наблюдения 16 месяцев однолетняя БРВ составила 89% в группе пембролизумаба против 79% в группе плацебо (ОР 0,42, 95% ДИ 0,30–0,59). На основании значимого различия в безрецидивной выживаемости год адъювантной терапии для стадий IIB–IIC также является допустимой опцией, включенной в рекомендации RUSSCO [4].
Говоря о стадии IIB–IIC, нельзя не упомянуть адъювантную терапию интерфероном, которая присутствует в рекомендациях RUSSCO и клинических рекомендациях, одобренных Научно-практическим советом Министерства здравоохранения РФ [4, 7]. Сейчас этот подход практически не применяется в связи с появлением более современных препаратов для этих стадий (пембролизумаба и ниволумаба) и их лучшими результатами в отношении снижения риска рецидива и прогрессирования. Тем не менее один из наиболее крупных метаанализов, объединивший 15 исследований, изучавших адъювантную терапию интерфероном, продемонстрировал небольшое, но значимое преимущество в отношении БРВ (2,5%) и ОВ (2,6%) на интервале десять лет по сравнению с плацебо [8]. Стоит отметить, что данных по ОВ в исследованиях KEYNOTE-716 и CheckMate-76K в настоящее время нет в связи с малым периодом наблюдения. Терапия интерфероном может быть применена при отсутствии доступа к иммунотерапии анти-PD-1 у пациентов именно с изъязвленными формами меланомы – T3bN0M0 и T4bN0M0, поскольку подгрупповой анализ не продемонстрировал преимущества такого подхода у пациентов без изъязвления первичной опухоли. С учетом побочных эффектов, связанных с терапией интерфероном, возможной опцией при отсутствии доступа к иммунотерапии анти-PD-1 также может быть тщательное динамическое наблюдение для пациентов со стадией IIB–IIC после радикального хирургического лечения.
Пембролизумаб и ниволумаб до их применения в адъювантной терапии меланомы кожи IIB–IIC стадии длительное время применялись в III и IV стадиях (ниволумаб – для IIIB–IV и пембролизумаб – для III). Пембролизумаб изучался в исследовании III фазы KEYNOTE-054 [9, 10]. В данное исследование были включены 1019 пациентов с III стадией, которые получали пембролизумаб или плацебо в течение года, в соотношении 1:1. Пембролизумаб достоверно улучшил трехлетнюю БРВ – 63,7% (95% ДИ 59,2–67,7) в группе пембролизумаба по сравнению с 44,1% (95% ДИ 39,6–48,4) в группе плацебо. В 2022 г. были опубликованы данные пятилетней БРВ, демонстрирующие преимущество назначения пембролизумаба: 55,4% в группе пембролизумаба по сравнению с 38,3% в группе плацебо (ОР 0,61, 95% ДИ 0,51–0,72) [11]. Результаты ОВ в настоящее время недоступны в рамках данного исследования, однако представляют интерес для медицинского сообщества, так как особенностью исследования была возможность перейти на пембролизумаб при прогрессировании. Это может позволить отчасти оценить влияние адъювантной иммунотерапии анти-PD-1 на общую выживаемость.
Другое исследование III фазы S1404, изучавшее адъювантную терапию пембролизумабом, также показало улучшение БРВ по сравнению с другими опциями лечения – высокими дозами интерферона и высокими дозами ипилимумаба (10 мг/кг) [12]. В исследование был включен 1301 пациент с меланомой кожи III и IV стадии после радикального хирургического лечения. На медиане наблюдения 47,5 месяца пембролизумаб значимо улучшил БРВ по сравнению с другими опциями лечения (ОР 0,77, 99,62% ДИ 0,59–0,99), но не улучшил ОВ (ОР 0,82, 96,3% ДИ 0,61–1,09). Отсутствие различий в ОВ может быть обусловлено эффективной терапией метастатической меланомы кожи: почти половина больных в группе интерферона и ипилимумаба после прогрессирования получили препараты анти-PD-1 в последующих линиях лечения.
Ниволумаб в адъювантной терапии был изучен в исследовании III фазы CheckMate-238, в которое были включены 906 пациентов со стадией IIIB–IV, получивших адъювантную терапию ниволумабом или ипилимумабом в течение года в соотношении 1:1 [13–15]. Ниволумаб достоверно улучшает пятилетнюю БРВ (50% против 39%, ОР 0,72, 95% ДИ 0,6–0,86), но не пятилетнюю ОВ (76% против 72%, ОР 0,86, 95% ДИ 0,66–1,12).
Отдельного внимания заслуживает одно из первых исследований III фазы, изучавших адъювантную терапию ипилимумабом в высоких дозах (10 мг/кг) по сравнению с плацебо у 951 пациента с меланомой кожи III стадии [16–18]. Отличием данного исследования от вышеописанных является то, что ипилимумаб достоверно увеличил не только БРВ, но и ОВ: на медиане наблюдения 6,9 года ипилимумаб по сравнению с плацебо улучшил БРВ (ОР 0,75, 95% ДИ 0,63–0,88; p < 0,001) и ОВ (ОР 0,73, 95% ДИ 0,60–0,89; p = 0,002), абсолютная разница в ОВ составила 8,7%. Данные результаты были достигнуты за счет высокой токсичности терапии: нежелательные явления 3–4-й степени были зарегистрированы более чем у половины пациентов, получивших ипилимумаб, в связи с чем данный дозовый режим не применяется в лечении меланомы кожи.
Другой дозовый режим ипилимумаба в адъювантной терапии изучался в исследовании III фазы E1609 [19]. В него были включены 1670 пациентов с IIIB–IV стадией, которые получили адъювантную терапию ипилимумабом 10 мг/кг, ипилимумабом 3 мг/кг или высокими дозами интерферона в соотношении 1:1:1. Отмечено значимое снижение токсичности лечения: нежелательные явления 3–5-й степеней были зарегистрированы у 37% пациентов, получивших ипилимумаб в дозе 3 мг/кг, у 58% пациентов, получивших ипилимумаб в дозе 10 мг/кг, и у 79% пациентов, получивших высокие дозы интерферона. На медиане наблюдения 57,4 месяца ипилимумаб в дозе 3 мг/кг по сравнению с высокими дозами интерферона улучшил БРВ (ОР 0,85, 99,4% ДИ 0,66–1,09; p = 0,065) и пятилетнюю ОВ (72% против 67%, ОР 0,78 95%, ДИ 0,61–0,99), однако при этом ипилимумаб в дозе 10 мг/кг по сравнению с высокими дозами интерферона не продемонстрировал преимуществ в отношении БРВ и ОВ. Подобные расхождения могут быть связаны с токсичностью терапии: 54% пациентов прекратили лечение ипилимумабом в дозе 10 мг/кг из-за развившихся нежелательных явлений, в то время как лечение интерферонами было прекращено только у 20% пациентов.
С учетом токсичности ипилимумаба и того факта, что результаты CheckMate-238 показали преимущество назначения ниволумаба в отношении БРВ, ипилимумаб более не является стандартной опцией адъювантной терапии. Тем не менее ипилимумаб в дозе 3 мг/кг можно рассматривать в отдельных случаях, например при необходимости повторного назначения адъювантной терапии после радикального хирургического лечения по поводу рецидива/прогрессирования в случае ранее проведенной неэффективной адъювантной терапии анти-PD-1.
Эффективность комбинированной иммунотерапии в лечении метастатической меланомы кожи привела к ее изучению в адъювантном режиме. Первым было представлено исследование II фазы IMMUNED, в котором 167 пациентов с IV стадией после радикального хирургического лечения получали адъювантную терапию в соотношении 1:1:1 (комбинированная иммунотерапия ипилимумабом с ниволумабом, иммунотерапия ниволумабом или плацебо) [20, 21]. Комбинированная иммунотерапия продемонстрировала достоверное преимущество по сравнению с плацебо. Четырехлетняя БРВ составила 64,2% (95% ДИ 49,2–75,9) в группе ипилимумаба с ниволумабом, 31,4% (95% ДИ 19,7–43,8) в группе ниволумаба и 15,0% (95% ДИ 6,7–26,6) в группе плацебо. Четырехлетняя ОВ составила 83,8% (95% ДИ 68,8–91,9) в группе ипилимумаба с ниволумабом, 72,6% (95% ДИ 57,4–83,2) в группе ниволумаба и 63,1% (95% ДИ 46,9–75,6) в группе плацебо. При этом ниволумаб по сравнению с плацебо продемонстрировал улучшение БРВ, но не ОВ, что, вероятно, обусловлено назначением в последующих линиях иммунотерапии анти-PD-1 у пациентов в группе плацебо после прогрессирования. Нежелательные явления 3–4-й степени были зарегистрированы у 71% пациентов в группе ипилимумаба с ниволумабом и у 27% пациентов в группе ниволумаба, что привело к прекращению терапии в 62 и 13% случаев соответственно. На основании этих данных комбинированная иммунотерапия в адъювантном режиме была внесена в рекомендации RUSSCO [4].
Результаты исследования III фазы CheckMate-915 были представлены позднее [22]. В исследование было включено 1833 пациента с меланомой кожи IIIB–IV стадии, которые получили адъювантную терапию ниволумабом или комбинированную иммунотерапию ипилимумабом с ниволумабом. Это исследование оказалось негативным: комбинированная иммунотерапия не улучшила БРВ по сравнению с монотерапией ниволумабом. Стоит отметить, что в данном исследовании применялся нестандартный режим комбинированной иммунотерапии с низкой дозой ипилимумаба, который мог повлиять на результаты: ниволумаб 240 мг каждые две недели с ипилимумабом 1 мг/кг каждые шесть недель, всего год терапии. Комбинированная иммунотерапия в адъювантном режиме может рассматриваться только для пациентов с IV стадией с учетом потенциального риска и пользы на основании результатов исследования IMMUNED.
Помимо различных вариантов иммунотерапии, адъювантная терапия меланомы кожи также представлена таргетной терапией для пациентов с мутацией в гене BRAF V600E/К.
Мутация в гене BRAF V600E/К встречается у 40–50% пациентов с меланомой кожи и определяет более неблагоприятное течение болезни. Косвенные данные по исторической выживаемости пациентов с III стадией можно получить из исследований KEYNOTE-054 и COMBI-AD, в которых терапия сравнивалась с плацебо [9–11, 23, 24]. В исследовании KEYNOTE-054 трехлетняя БРВ для пациентов без мутации в гене BRAF в группе плацебо составила 46,5%, в то время как для пациентов с мутацией в гене BRAF трехлетняя БРВ составила 37,1%. В исследовании COMBI-AD данные сопоставимы для пациентов с мутацией в гене BRAF, получивших плацебо, в отношении трехлетней БРВ – 40%.
В настоящее время доступны результаты двух исследований, изучавших таргетную терапию в адъювантном режиме: BRIM8 и COMBI-AD.
Исследование III фазы BRIM8 изучало эффективность вемурафениба по сравнению с плацебо в адъювантном режиме у пациентов со стадией IIC–III с мутацией в гене BRAF [25]. Всего было включено 498 пациентов. В исследовании не была достигнута первичная конечная точка, в связи с этим вемурафениб не был одобрен в лечении меланомы в адъювантном режиме. Хотя эффективность вемурафениба была нумерически выше в когорте 1 (для стадий IIC–IIIB: медиана ВБП не была достигнута в группе вемурафениба по сравнению с 36,9 месяца (21,4 – не достигнуто) в группе плацебо (ОР 0,54, 95% ДИ 0,37–0,78; p = 0,0010). В когорте 2 (стадия IIIC) значимых различий получено не было. Гипотеза исследования предполагала статистическую значимость в случае, если в двух когортах будут значимые различия, поэтому в связи с незначительными различиями в когорте 2 исследование было признано негативным. Монотерапия ингибиторами BRAF в лечении меланомы в настоящее время не проводится в связи с более высокой эффективностью и лучшей переносимостью комбинированной таргетной терапии BRAF/MEK-ингибиторами. Исследование III фазы COLUMBUS-AD для оценки эффективности и безопасности комбинированной таргетной терапии энкорафенибом и биниметинибом при IIB–IIC стадии меланомы с мутацией в гене BRAF проводится в настоящее время, результатов пока нет (NCT05270044).
В исследование III фазы COMBI-AD было включено 870 пациентов на III стадии с мутацией в гене BRAF V600E/K, которые получили адъювантную терапию дабрафенибом с траметинибом в течение года или плацебо, в соотношении 1:1 [23, 24]. Результаты исследования демонстрируют выигрыш от назначения таргетной терапии: пятилетняя БРВ составила 52% в группе дабрафениба с тарметиннибом против 36% в группе плацебо (ОР 0,51, 95% ДИ 0,42–0,61). Также были представлены данные трехлетней ОВ, которые продемонстрировали нумерическое, но не значимое увеличение ОВ в группе таргетной терапии: 86% против 77% (ОР 0,59, 95% ДИ 0,42–0,79; p = 0,0006 при заданной границе p = 0,000019). Повторный анализ ОВ не проводился в связи с недостаточным количеством наступивших событий для анализа. Нежелательные явления 3–4-й степени были зарегистрированы у 41% пациентов.
Выбор адъювантной иммунотерапии или таргетной терапии для пациентов с мутацией в гене BRAF в III стадии точно не определен. При непрямом сравнении результатов исследований KEYNOTE-054, CheckMate-238 и COMBI-AD данные в целом сопоставимы. Данные по общей выживаемости доступны в двух исследованиях (CheckMate-238 и COMBI-AD). Рандомизированных клинических исследований, сравнивающих опции двух видов лечения у пациентов с мутацией в гене BRAF, нет. Выбор терапии основан на предпочтениях и знаниях врача и пациента, а также на противопоказаниях у пациента к тому или иному виду лечения.
Однако на конференции ASCO 2022 г. был представлен анализ пациентов реальной клинической практики из 13 центров Германии с меланомой кожи III стадии с мутацией в гене BRAF. Включено 288 пациентов, из которых 131 получал иммунотерапию анти-PD-1, 114 – комбинированную таргетную терапию и 43 не получали лечения, оставаясь под тщательным динамическим наблюдением. ВБП в течение 24 месяцев составила 66% по сравнению с 48 и 45% между группами соответственно. Медиана ВБП составила в группе ИКТИ 20,6 месяца (95% ДИ 11,3 – не достигнуто), а в группе комбинированной таргетной терапии не достигнута (95% ДИ 26,8 – не достигнуто) [26].
Требуются дальнейшие исследования и поиск биомаркеров для пациентов с мутацией в гене BRAF, чтобы более точно определить подгруппу пациентов, которая в большей степени выиграет от назначения таргетной или иммунотерапии.
Заключение
Современная адъювантная лекарственная терапия основана на результатах крупных рандомизированных исследований, преимущественно III фазы, и некоторым образом отличается в зависимости от стадии болезни (IIB–C vs III vs IV). Очевидно, что сегодня подавляющему большинству пациентов необходимо назначать современную адъювантную лекарственную терапию, которая позволяет значимо снизить риск рецидива и прогрессирования болезни и отчасти (в контексте комбинированной таргетной терапии при BRAF-мутации) повлиять на общую продолжительность жизни пациентов.
A.E. Akhmetianova, K.V. Orlova, PhD, L.V. Demidov, PhD
N.N. Blokhin National Medical Research Centre of Oncology
Contact person: Angelina E. Akhmetianova, a.e.akhmetianova@gmail.com
Adjuvant therapy in cutaneous melanoma is the standard of care in high-risk patients, including stages IIB, IIC, III and IV (after surgical treatment). Adjuvant therapy options are different, including single-agent immunotherapy, combined immunotherapy, targeted therapy in the patient with BRAF mutation. The choice of treatment option depends on many factors, such as the stage of the disease, previous history of the disease, concomitant disease and patient preferences. This review is a comprehensive summary of published research on the basis of which modern adjuvant therapy is based.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.