Противовирусная терапия хронического гепатита С: современный взгляд на проблему
- Аннотация
- Статья
- Ссылки
![Рис. 1. Заболеваемость хроническими вирусными гепатитами в РФ в 2002–2009 гг. (на 100 тыс. населения) [19]](/upload/resize_cache/iblock/cea/195_350_1/pegintron1.jpg)
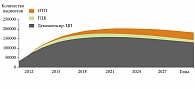


Эпидемиологические и фармакоэкономические аспекты лечения гепатита С По данным ВОЗ, в 2007 г. число носителей вируса гепатита С в мире составляло около 180 млн человек (то есть 3% населения планеты). При этом ежегодно регистрировалось 3–4 млн новых случаев гепатита С. Можно предположить, что рост заболеваемости будет сохраняться на том же уровне, в первую очередь из-за отсутствия профилактических вакцин против HCV-инфекции. В подтверждение сказанному, по данным Федерального центра гигиены и эпидемиологии Роспотребнадзора, в России за последние 10 лет наблюдается постоянная тенденция к повышению заболеваемости ХГС, уровень которой в 2009 г. составил почти 41 на 100 тыс. населения (рис. 1).
Кроме того, не вызывает сомнения факт, что ХГС является наиболее частой причиной развития цирроза печени (ЦП), печеночной недостаточности, гепатоцеллюлярной карциномы (ГЦК) и, как следствие, основным показанием к ортотопической трансплантации печени (ОТП) в развитых странах [1]. Следует также помнить, что в 65–85% случаев острая HCV-инфекция переходит в хроническую.
В связи с вышеизложенным важное значение имеет прогноз заболеваемости на ближайшие десятилетия. Специалисты подсчитали, как будет прогрессировать частота HCV-ассоциированных заболеваний в США в течение 20 лет, начиная с 2009 г. (рис. 2). Было показано, что число больных с «продвинутой» стадией заболевания (выраженный фиброз/цирроз печени) к 2029 г. увеличится в 4 раза. Прогнозируется, что еще больше увеличится частота ГЦК и число ОТП по поводу HCV-инфекции, примерно так же вырастут и затраты на медицинское обеспечение данной категории пациентов. По-видимому, следует ожидать похожей динамики HCV-ассоциированных заболеваний и в нашей стране.
В последние годы достаточно часто обсуждаются вопросы фармакоэкономики ПВТ, которые, на наш взгляд, связаны с достижением устойчивого вирусологического ответа (УВО).
На сегодняшний день имеются данные, что при наличии УВО вероятность авиремии в течение 5 лет превышает 99%, а достижение УВО может свидетельствовать о клиническом излечении больного ХГС [2].
С другой стороны, один из последних метаанализов, посвященных значению УВО, показал, что частота декомпенсации ЦП, развития ГЦК и смерти от заболеваний печени у больных ХГС с выраженным фиброзом в случаях терапевтической неудачи составляет около 2–3% в год, в то время как у пациентов, достигших УВО, относительный риск составил лишь 0,16–0,23% [3]. Приводятся также данные, что экономическая эффективность противовирусного лечения ХГC сопоставима с эффективностью таких широко проводимых лечебно-профилактических мероприятий, как лечение артериальной гипертонии, скрининг на рак молочной железы и колоректальный рак и т.д. (Wright J., Weinstein M., 1998).
Современные подходы к диагностике при ХГС
ХГС у большинства пациентов имеет мало- или бессимптомное течение, что требует точности при выполнении диагностических тестов у пациентов данной категории. Выполнение диагностического алгоритма необходимо не столько для установления полного диагноза с указанием стадии заболевания, уровня репликации, генотипа HCV, осложнений, сколько для представления так называемого портрета пациента, который позволяет правильно оценить показания и противопоказания для ПВТ, выявить благоприятные и неблагоприятные предикторы для достижения УВО, исключить или выявить сопутствующие заболевания, коррекция которых может потребоваться в процессе лечения, определить «базальный» уровень лабораторных показателей, мониторинг которых требуется при проведении ПВТ.
Необходимо, на наш взгляд, по-прежнему выделять группу пациентов, которые имеют один или несколько неблагоприятных предикторов (так называемая группа «трудных» пациентов), которые могут привести к неудачным результатам ПВТ.
В течение последнего года активно обсуждается возможность применения в качестве диагностических тестов различных генетических маркеров у пациентов c ХГС. К настоящему времени доказано, что интерлейкин-28В (IL-28B) может рассматриваться как один из самых «сильных» предикторов УВО. В частности, было показано, что генотип C/C является самым «сильным» предиктором УВО у нелеченых пациентов с 1 генотипом (OR = 5,2; 95-процентный ДИ 4,1–6,7; р < 0,001) по сравнении с генотипами СТ и ТТ [4]. Причем этот маркер может служить предиктором как у пациентов с высокой, так и с низкой виремией. В настоящее время данный показатель активно используется в клинической практике за рубежом, и мы надеемся, что в ближайшее время этот тест войдет в рутинную практику в нашей стране. Надо понимать, что применение указанного теста позволит использовать его не только для прогноза УВО перед лечением, но и для выбора правильной тактики лечения у пациентов без быстрого вирусологического ответа.
Современные подходы к ПВТ
Прежде всего, хотелось бы подчеркнуть, что современные подходы к ПВТ отнюдь не являются догмой, их можно рассматривать как точку отсчета на пороге новой эры прямых антивирусных агентов (в зарубежной литературе часто используется термин DAA – direct-antiviral agent).
Принципы терапии укладываются в понимание и знание ответов на представленные ниже вопросы:
- Каковы цели терапии?
- Кого лечить?
- Чем лечить?
- Как долго лечить?
- Каковы правила мониторинга?
Цели терапии. В настоящее время считается, что основная цель ПВТ – стойкое подавление репликации НСV и достижение УВО, который определяется как отсутствие вирусной РНК в сыворотке крови пациента через 24 недели после окончания противовирусного лечения. При этом доказано: УВО улучшает прогноз заболевания вплоть до полного пожизненного излечения (D.R. Nelson, G.L. Davis, I. Jacobson и соавт., 2009).
Основываясь на данных последних и наиболее представительных клинических исследований, можно утверждать, что в случаях гепатита, вызванного 2 и 3 генотипом вируса, при применении пегилированного интерферона-α (ПЭГ-ИФН-α) и рибавирина УВО составляет 67–82% [5–8]. При 1 генотипе эффективность лечения ниже: УВО составляет 39–44% [5, 8–11].
Кого лечить? Если в начале 2000-х гг. большинство экспертов, учитывая низкую эффективность ПВТ (5–15%), высказывались в пользу выжидательной тактики, то в настоящее время такой подход пересмотрен. Сейчас считается, что все пациенты должны рассматриваться как потенциальные кандидаты для ПВТ. Исключение могут составлять пациенты с неблагоприятным генотипом IL-28В (в первую очередь ТТ) при невозможности включения в схему ПВТ прямых антивирусных агентов.
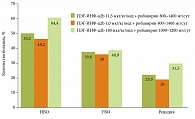
К вопросу «Чем лечить?», несомненно, следует подходить с позиции доказательной медицины. Стандартом лечения во всем мире считается комбинация ПЭГ-ИФН-α и рибавирина. При выборе между ПЭГ-ИФН-α2а (Пегасис) и ПЭГ-ИФН-α2b (Пегинтрон) следует руководствоваться результатами самого доказательного на сегодняшний день клинического исследования в этой области IDEAL (международное мультицентровое проспективное сравнительное), в котором было показано отсутствие достоверной разницы в достижении УВО (рис. 3) при применении указанных лекарственных препаратов [12].
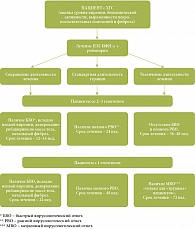
Важным является вопрос «Как долго лечить?». Стандартная длительность терапии составляет 48 недель при 1 и 4 генотипе HCV; при 2 и 3 генотипе – 24 недели. Однако в настоящее время считается, что длительность ПВТ зависит от вирусологического ответа (в зарубежной литературе используется термин response-guided strategy). Речь идет об индивидуализации подхода к лечению пациента на основе оценки динамики вирусной нагрузки. При этом обсуждается как возможность сокращения, так и пролонгирования (в ряде случаев) сроков ПВТ с позиции доказательной медицины [13]. Указанный подход или алгоритм выбора длительности терапии (рис. 4) должен включать ряд важнейших критериев: наличие быстрого вирусологического ответа (БВО), исходная виремия, отсутствие фиброза или его начальных проявлений, а также дозирование рибавирина в зависимости от массы тела.
Так, в случае 2–3 генотипа при наличии низкой исходной виремии (менее 400000 МЕ/мл) и БВО, при отсутствии выраженного фиброза/цирроза, а также при назначении рибавирина в зависимости от массы тела сроки ПВТ могут быть сокращены с 24 до 16 недель. У пациентов с 1 генотипом при наличии перечисленных условий длительность ПВТ может быть сокращена с 48 до 24 недель. С другой стороны, при наличии медленного вирусологического ответа у пациентов с 1 генотипом сроки терапии могут быть увеличены до 72 недель.
Следует иметь в виду, что уменьшение длительности ПВТ будет способствовать не только сокращению расходов на лечение, но и позволит избежать возможных нежелательных явлений (НЯ), а также обеспечит повышение приверженности пациентов к терапии.
Принципы и правила мониторинга. Как известно, мониторинг при проведении любого вида лечения включает 3 основных направления: эффективность, безопасность и приверженность.
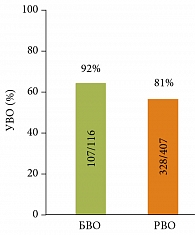
Основная задача – наиболее ранняя оценка эффективности терапии, что достигается с помощью оценки динамики вирусной нагрузки. К настоящему времени получены убедительные данные, что БВО (то есть отрицательная HCV РНК после 4 недель терапии) является самым сильным предиктором УВО. Вместе с тем достаточно важным предиктором остается полный ранний вирусологический ответ (рис. 5) [14].
Другая задача мониторинга – безопасность лечения. При этом важно уметь не только диагностировать, но и эффективно проводить коррекцию возможных НЯ. Особенно важными среди таковых считаются гематологические НЯ.
Достижением современного этапа является доказательство того, что не существует корреляции между частотой инфекционных осложнений и нейтропенией [16, 17], частотой кровотечений и снижением тромбоцитов [18] при проведении ПВТ, что позволяет пересмотреть существующие рекомендации по модификации дозы противовирусных препаратов.
Терапевтические подходы, рекомендованные фирмами-производителями в зависимости от степени снижения гематологических показателей, представлены в таблице 3.
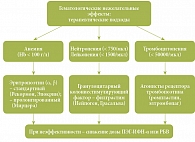
Однако большинство исследователей сходятся во мнении, что критерии анемии, лейкопении, нейтропении, тромбоцитопении, рекомендуемые сегодня для модификации дозы и отмены ПВТ, индивидуальны. При этом большое значение приобретают подходы, связанные не с модификацией дозы, а с использованием препаратов, стимулирующих различные звенья гемопоэза (рис. 6). Так, при развитии анемии ниже 100 г/л рекомендуется подкожное введение эритропоэтина-α (или -β) (Эпокрин, Рекормон) в дозах 8–40 тыс. ЕД/нед (2–3 раза в неделю). При развитии нейтропении (< 750/мкл) и лейкопении (< 1500/мкл) рекомендуется подкожное введение гранулоцитарного колониестимулирующего фактора – филграстима (Нейпоген, Грасальва, Лейкостим) по 300 мкг в режиме от 1–2 раз в неделю до 1 раза в 2–3 недели под контролем соответствующих показателей крови. Кроме того, в настоящее время проходят клинические исследования по изучению эффективности и безопасности агонистов рецептора тромбопоэтина (Ромпластин, Элтромбопаг) для оценки возможности применения указанных фармакологических агентов при ХГС.
Применение препаратов, стимулирующих гемопоэз, обусловлено, в первую очередь, необходимостью выполнять правило «80 + 80 + 80»: кумулятивная доза ИФН и рибавирина, полученная пациентом, должна составлять не менее 80% от назначенных доз, общая длительность лечения – не менее 80% от необходимой продолжительности терапии.
В то же время, несмотря на несомненные успехи ПВТ, у части пациентов с ХГС терапия оказывается неэффективной (так называемые нон-респондеры). По прогнозам ведущих экспертов, число нон-респондеров к концу 2011 г. достигнет в мире более 500 тыс. человек. В связи с этим особенно важно появление в клинической практике первых ингибиторов протеазы NS3/4A (Боцепревир, Телапревир), которые показаны в первую очередь для указанной категории пациентов и будут применяться в качестве третьего компонента в известной стандартной схеме (ПЭГ-ИНФ-α + рибавирин). К сожалению, в клинических исследованиях тройная терапия показала большее количество нежелательных явлений, в том числе таких, как анемия, сыпь, извращение вкуса и другие, которые, по-видимому, будут являться лимитирующим фактором для полноценной ПВТ.
Достижением последних лет явились итоги клинического исследования HALT-C (Hepatitis C Antiviral Long-term Treatment against Cirrhosis) по изучению эффективности длительной поддерживающей терапии у пациентов с циррозом печени (ЦП) в исходе ХГС. Результаты исследования показали, что длительная терапия поддерживающими дозами ПЭГ-ИНФ-α у пациентов ЦП не приводит к каким-либо достоверным положительным эффектам по сравнению с группой без лечения по таким критериям, как выживаемость, прогрессирование фиброза, частота декомпенсаций и частота развития ГЦК [15], что вызывает необходимость применения более агрессивной тактики лечения уже на стадии начального и тем более продвинутого фиброза. С другой стороны, ПВТ у больных c ЦП может рассматриваться «запоздалым» мероприятием, учитывая еще и полиморбидность указанной категории пациентов, потенциально низкую частоту УВО, повышенную частоту развития у них нежелательных явлений.
Заключение
Лечение ХГС остается серьезной медико-социальной проблемой. Современные подходы к противовирусному лечению при ХГС во многих случаях требуют от специалистов не только понимания закономерностей инфекционного процесса, но и информированности в области достижений современной медицинской науки и фармацевтики с позиций доказательной медицины. За последние годы произошла ревизия взглядов на показания, противопоказания, фармакоэкономические показатели противовирусной терапии. Ожидаемый эффект от лечения включает эрадикацию вируса, улучшение морфологии печени, снижение инфицированности населения и уменьшение риска развития гепатоцеллюлярного рака.
Современные подходы к противовирусной терапии пациентов c ХГС включают:
- оценку благоприятных и неблагоприятных предикторов эффективности ПВТ;
- выбор антивирусных агентов;
- мониторинг эффективности (на основании динамики вирусной нагрузки или response-guided strategy) и безопасности (диагностика и коррекция нежелательных явлений).
Указанные положения особенно актуальны при применении новых антивирусных препаратов. Появление в клинической практике ингибиторов протеазы открывает новые перспективы повышения эффективности ПВТ. В то же время существует риск увеличения частоты различных нежелательных явлений, а также развития резистентности к новым антивирусным агентам, что потребует от специалистов, занимающихся лечением ХГС, еще больших знаний и опыта.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.