Адъювантная терапия меланомы кожи
- Аннотация
- Статья
- Ссылки
- English
![Рис. 1. Показатели меланома-специфической выживаемости в зависимости от стадии (TNM, 8-е издание) [2]](/upload/resize_cache/iblock/812/195_350_1/Zshukova1.jpg)

![Таблица 2. Продолжающиеся исследования адъювантной терапии при меланоме II стадии [10]](/upload/resize_cache/iblock/ff3/195_350_1/Zshukova3.jpg)
Введение
Меланома относится к злокачественным новообразованиям с агрессивным течением. Это связано прежде всего с высокой пролиферативной активностью и склонностью к регионарному и отдаленному метастазированию. Ключевыми прогностическими факторами в данном случае являются толщина опухоли по Бреслоу, наличие или отсутствие изъязвления, митотическая активность и поражение лимфатических узлов. Несмотря на то что меланома составляет меньшую часть всех опухолей кожи, она занимает первое место по смертности. Чаще диагноз меланомы в Российской Федерации устанавливают на I и II стадиях, в 20% случаев – при местнораспространенном или метастатическом заболевании [1].
Использование современных методов локального и системного лечения позволяет увеличить выживаемость пациентов, тем не менее благоприятный прогноз характерен только для ранних стадий. Пятилетняя выживаемость при I стадии достигает 97–99%, при II стадии – 75–94% в зависимости от наличия или отсутствия изъязвления опухоли. При III стадии, для которой характерно поражение лимфатических узлов и/или наличие транзиторных и/или сателлитных метастазов, этот показатель значительно ниже и варьируется от 32 до 93% (рис. 1) [2, 3].
В зависимости от стадии локальную меланому I–III стадий разделяют на три группы риска прогрессирования: низкий (IA–IIA), промежуточный (IIB, IIIA) и высокий (IIIB–IIID) (табл. 1).
Основными факторами разделения на группы риска являются толщина опухоли, наличие изъязвления, транзиторных и/или сателлитных и/или микросателлитных метастазов, высокий митотический индекс, лимфоваскулярная и периневральная инвазия. Кроме того, некоторые авторы выделяют BRAF-статус в качестве прогностического фактора. Показано, что меланомы с большей толщиной первичной опухоли имеют худший прогноз по сравнению с опухолями с меньшей толщиной и микроскопическим поражением регионарных лимфоузлов, что объясняется преобладанием гематогенного пути метастазирования меланомы [3].
Около десяти лет назад пятилетняя выживаемость при III стадии составляла 40–78%, в то время как при II стадии не превышала 53% [4]. В настоящее время благодаря разработке новых препаратов и их применению в адъювантном режиме удалось значительно увеличить безрецидивную и общую выживаемость.
Системное лечение пациентов с локальными (I–II) стадиями меланомы
Согласно 8-й редакции классификации TNM (TNM8), I стадия меланомы характеризуется толщиной опухоли менее 1 мм или от 1 до 2 мм без изъязвления. К II стадии относятся меланомы более 1 мм с изъязвлением и более 2 мм в отсутствие поражения регионарных лимфоузлов и отдаленных метастазов.
Необходимо отметить, что, согласно TNM8, для установления стадии заболевания всем пациентам должна быть выполнена биопсия сигнального лимфоузла (БСЛУ) при толщине опухоли более 0,8 мм с последующим гистологическим и иммуногистохимическим исследованиями. Данное вмешательство позволяет морфологически подтвердить диагноз локальной формы меланомы и исключить наличие регионарного метастазирования в лимфатические узлы, что соответствовало бы III стадии. При невыполнении БСЛУ регионарные лимфоузлы должны описываться как Nх [3].
Единственно одобренным подходом к лечению меланомы кожи I стадии в России, Соединенных Штатах Америки и Европе является радикальное иссечение первичной опухоли в пределах здоровых тканей. Адъювантную терапию, в том числе интерфероном (ИФН) альфа, при меланоме I стадии с низким риском прогрессирования и благоприятным прогнозом проводить не рекомендуется.
Первым этапом лечения меланомы кожи II стадии также является хирургический. Однако учитывая, что группа пациентов с меланомой кожи II стадии достаточно неоднородна и включает пациентов с низким (IIA), промежуточным (IIB) и высоким (IIC) риском прогрессирования (табл. 1), подходы к адъювантной лекарственной терапии различаются в зависимости от подстадии. Согласно рекомендациям Министерства здравоохранения РФ, Ассоциации онкологов России (АОР) и Российского общества клинической онкологии (RUSSCO), после радикального иссечения первичной опухоли при подтвержденной IIА стадии заболевания (группа низкого риска) какая-либо адъювантная терапия неэффективна и целесообразно проводить только динамическое наблюдение. При меланоме кожи изъязвленной формы IIB–IIC стадий рекомендовано начать адъювантную терапию ИФН-альфа в низких дозах (3–5 млн Ед подкожно три раза в неделю) не позднее девяти недель от операции. Терапия в совокупности проводится в течение года [5, 6].
Несмотря на то что в настоящее время для пациентов с меланомой кожи II стадии ИФН-альфа исключен из рекомендаций Американской ассоциации онкологов (NCCN), в рекомендациях Минздрава России, АОР и RUSSCO для пациентов с изъязвлением данная опция сохранена.
Как известно, предиктивным фактором чувствительности к терапии ИФН-альфа является именно наличие изъязвления первичной опухоли. Метаанализ 14 рандомизированных исследований применения ИФН-альфа в качестве адъювантной иммунотерапии меланомы кожи продемонстрировал статистически значимое увеличение безрецидивной (снижение относительного риска прогрессирования на 18%) и общей выживаемости (ОВ) (снижение относительного риска смерти на 11%) [7]. Отдельно следует отметить, что, согласно российским, европейским и американским рекомендациям, пациентам с II стадией меланомы кожи следует предлагать участие в клинических исследованиях при наличии такой возможности.
С учетом равнозначности рисков прогрессирования между локальной (II) и регионарной (III) стадиями сегодня назрела необходимость поиска новых эффективных подходов к адъювантной терапии меланомы II стадии. Например, десятилетняя ОВ при IIС стадии составляет 75%, что сопоставимо с десятилетней ОВ при IIIВ стадии (77%) меланомы, при которой применяется эффективное адъювантное лечение (рис. 1). На данный момент проходит ряд клинических исследований адъювантной терапии меланомы. Однако в большинство исследований пациенты с II стадией заболевания не включались.
Опубликованы данные рандомизированного исследования III фазы BRIM8, в котором изучали эффективность современной адъювантной терапии при II стадии меланомы у пациентов с положительным статусом BRAF и IIC–III стадиями заболевания после радикального лечения. Исследователи оценивали влияние вемурафениба (против плацебо) на ОВ и безрецидивную выживаемость (БРВ). Первичной конечной точкой была выбрана БРВ в когорте 2 (пациенты со стадией IIIC), которая не была достигнута. Несмотря на достоверное влияние на БРВ в когорте 1 (у пациентов с IIC, IIIA или IIIB медиана не достигнута по сравнению с 36,9 месяца, отношение рисков (ОР) 0,54; 95%-ный доверительный интервал (ДИ) 0,37–0,78), вемурафениб не был одобрен для назначения в послеоперационном режиме ни для II, ни для III стадий в России, Европе и США [8].
Продолжается поиск эффективной послеоперационной терапии II стадии меланомы кожи. Ожидаются результаты исследования KEYNOTE-716, посвященного оценке сравнительной эффективности ингибитора PD-1 пембролизумаба в адъювантном режиме у пациентов с резецированной меланомой высокого риска (IIB–C стадии) и плацебо [9].
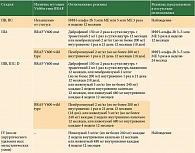
В 2024 г. ожидаются результаты исследования NCT04099251, в котором изучают эффективность другого PD-1-ингибитора – ниволумаба для профилактического лечения меланомы аналогичной стадии после радикального иссечения первичной опухоли. В таблице 2 перечислены текущие исследования эффективности адъювантной терапии II стадии меланомы кожи [10]. Возможно, будет рассматриваться вопрос изучения в адъювантном режиме зарегистрированного в апреле 2020 г. для лечения метастатической меланомы отечественного препарата пролголимаба (anti-PD-1, BCD-100) [11].
Системное лечение пациентов с III стадией меланомы
Адъювантная терапия меланомы III стадии вне зависимости от статуса BRAF
До недавнего времени опции послеоперационного системного лечения были весьма ограниченны и стандартным подходом считалось назначение препаратов рекомбинантного ИФН-альфа. Так продолжалось до 2011 г., когда одобрили первый анти-CTLA-4-препарат и стали развиваться два новых направления в лечении меланомы – таргетная терапия и иммунотерапия.
Первым ингибитором контрольных точек иммунитета (check-point ингибитор), продемонстрировавшим эффективность в адъювантном режиме, был ипилимумаб – CTLA-4-ингибитор. Он был одобрен в США в 2015 г. на основании результатов III фазы рандомизированного исследования СА184-029/EORTC18071, в котором сравнивали ипилимумаб 10 мг/кг внутривенно капельно каждые три недели с плацебо. В исследуемые группы были включены пациенты с IIIA–C стадией меланомы после хирургического лечения [12]. На фоне применения ипилимумаба отмечалось значимое увеличение пятилетней БРВ (41 против 30% в группе плацебо, ОР 0,76; 95% ДИ 0,64–0,89; p < 0,001) и ОВ (65 против 54% соответственно, ОР 0,72; 95% ДИ 0,58–0,88; p = 0,001) по сравнению с группой контроля. Однако в 48% случаев развились побочные эффекты 3–4-й степени, что привело к смерти 5 (1,1%) пациентов [13].
Впоследствии были получены результаты исследования E1609, в котором сравнивали ипилимумаб 3 или 10 мг/кг внутривенно капельно каждые три недели и высокодозный ИФН-альфа. Было продемонстрировано, что меньшая доза ипилимумаба увеличивает пятилетнюю ОВ по сравнению с ИФН-альфа (72 против 67%, ОР 0,78; 95% ДИ 0,61–0,99). Подобное увеличение ОВ не отмечалось при использовании ипилимумаба 10 мг/кг, что, вероятно, связано с прекращением лечения из-за токсичности более чем у половины пациентов [14]. С учетом выраженной токсичности данного препарата и наличия других опций для адъювантного режима ипилимумаб не рекомендован к применению в России, США и Европе и не включен в клинические рекомендации.
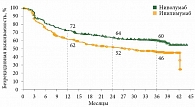
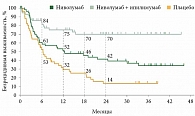
В 2017 г. появились результаты III фазы рандомизированного исследования СheckMate 238, в котором сравнивали новый ингибитор контрольных точек иммунитета, PD-1-ингибитор, ниволумаб 3 мг/кг (не более 240 мг) внутривенно капельно каждые две недели с ипилимумабом 10 мг/кг внутривенно капельно каждые три недели. В исследование СheckMate 238 были включены пациенты с IIIВ–С и IV стадиями после полной циторедукции. У 42% пациентов имелась мутация в гене BRAF [15]. Обновленные результаты трехлетней выживаемости были представлены на ежегодной встрече Европейского общества медицинской онкологии (ESMO) в 2019 г. По сравнению с ипилимумабом ниволумаб продемонстрировал преимущество в увеличении трехлетней БРВ, что являлось первичной конечной точкой исследования. У пациентов с III стадией она составила 60 и 46% соответственно (ОР 0,68; 95% ДИ 0,55–0,84) (рис. 2). Важно отметить, что увеличение БРВ на фоне ниволумаба не зависело от наличия или отсутствия мутации BRAF и уровня экспрессии PD-L1. Однако у пациентов с высокой экспрессией (PD-L1 ≥ 5%) выживаемость была лучше: 55 против 46% для группы PD-L1 < 5% и 76 против 58% для группы PD-L1 ≥ 5% (ОР 0,73, 95% ДИ 0,57–0,92 и ОР 0,54, 95% ДИ 0,36–0,81 соответственно) [16, 17].
Профиль токсичности ниволумаба значительно лучше такового ипилимумаба: только у 14% развились иммуноопосредованные нежелательные явления 3–4-й степени против 46% соответственно, что значительно реже приводило к отмене лечения (4 и 30% соответственно).
Впервые ниволумаб для адъювантной терапии III–IV стадии после хирургического лечения был зарегистрирован в США в 2017 г., позднее, в 2018 г. – в Европе и России. Согласно клиническим рекомендациям, в РФ ниволумаб показан для адъювантной терапии IIIB–D и IV стадии в течение 12 месяцев в дозе 3 мг/кг (не более 240 мг внутривенно капельно каждые две недели) или 480 мг внутривенно капельно каждые четыре недели.
Помимо ниволумаба в России, США и Европе в 2019 г. был зарегистрирован другой анти-PD-1-ингибитор – пембролизумаб. Его эффективность в адъювантном режиме превысила эффективность плацебо в рандомизированном клиническом исследовании III фазы KEYNOTE-054, в которое были включены пациенты с IIIA–C стадиями после хирургического лечения. Пембролизумаб назначался в фиксированной дозе 200 мг внутривенно капельно на 12 месяцев. На данный момент получены результаты с медианой наблюдения 18 месяцев.
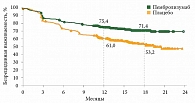
По сравнению с плацебо кривая БРВ на фоне приема пембролизумаба была значительно выше. Так, на 18-м месяце наблюдения 71,4% пациентов были живы, а в группе плацебо – 53,2% (рис. 3).
Кроме того, БРВ оценивали в зависимости от мутационного статуса BRAF. 18-месячная БРВ в группе BRAFmut на фоне лечения составила 69,2 и 52,4% соответственно (ОР 0,57; 95% ДИ 0,37–0,89), в группе BRAFwt – 66,7 против 48,8% в группе плацебо (ОР 0,64; 95% ДИ 0,42–0,96). Выживаемость при положительном статусе PD-L1 была также лучше по сравнению с отрицательным уровнем экспрессии. Через 18 месяцев после начала лечения 74,2% пациентов были живы в группе PD-L1+ по сравнению с 54,5% в группе плацебо (ОР 0,54; 95% ДИ 0,42–0,69). Среди пациентов с PD-L1-отрицательным статусом аналогичная БРВ составила 60,6 и 52,2% соответственно (ОР 0,47; 95% ДИ 0,26–0,85) [18].
Пембролизумаб характеризуется благоприятным профилем токсичности. Иммуноопосредованные нежелательные явления возникли у 14,7% пациентов, в группе плацебо – у 3,4%. Однако была зафиксирована одна смерть на фоне лечения из-за миозита.
В РФ рекомендовано назначение пембролизумаба в адъювантном режиме при IIIA–D стадиях в дозе 200 мг внутривенно капельно каждые три недели в течение 12 месяцев. В начале этого года в США было одобрено применение пембролизумаба по схеме 400 мг внутривенно капельно каждые шесть недель, однако в России данная схема введения пока не зарегистрирована.
Суммируя сказанное, в арсенале врача-онколога есть несколько опций адъювантной терапии меланомы III стадии независимо от мутационного статуса BRAF: пембролизумаб и ниволумаб. Оба препарата относятся к иммунотерапии, характеризуются хорошей переносимостью и профилем токсичности, продемонстрировали клинически значимое увеличение БРВ по результатам рандомизированных клинических исследований.
Адъювантная терапия меланомы III стадии при наличии активирующей мутации в гене BRAF
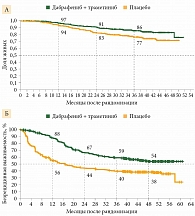
Селективная блокада MAPK-сигнального пути является эффективной альтернативой иммунотерапии в случае положительного мутационного статуса BRAF, что позволяет расширить опции для адъювантного лечения. Результаты III фазы рандомизированного исследования эффективности комбинации дабрафениба и траметиниба по сравнению с плацебо в качестве адъювантной терапии COMBI-AD были опубликованы в 2017 г. Дабрафениб назначали в дозе 150 мг дважды в день, траметиниб – 2 мг ежедневно. Терапия продолжалась в течение года. Четырехлетняя БРВ в группе комбинации составила 54%, в группе плацебо – 38% (ОР 0,49; 95% ДИ 0,40–0,59; р < 0,001). Трехлетняя ОВ также была выше в группе комбинации: 86 против 77% соответственно (ОР 0,57; 95% ДИ 0,42–0,79; р = 0,0006) (рис. 4) [19, 20].
Комбинация BRAF- и МЕК-ингибиторов удовлетворительно переносится. Серьезные нежелательные явления, связанные с лечением, возникли у 27% получавших таргетную терапию и 4% принимавших плацебо. Токсичность, потребовавшая отмены лечения, зарегистрирована у 26 и 3% пациентов соответственно. На основании результатов исследования COMBI-AD дабрафениб в комбинации с траметинибом был одобрен в 2018 г. в качестве адъювантной терапии III стадии меланомы после радикального хирургического лечения в России, США, Европе. Данное показание включено в российские клинические рекомендации.
На сегодняшний день помимо вышеперечисленных таргетных препаратов изучаются другие BRAF- и МЕК-ингибиторы – энкорафениб и биниметиниб. В случае появления доказательств их эффективности, возможно, появится еще один вариант адъювантного лечения для BRAF-мутированной меланомы помимо комбинации дабрафениба и траметиниба.
Адъювантная терапия меланомы IV стадии после полной циторедукции
Ингибитор контрольных точек иммунитета, anti-PD, ниволумаб – единственный препарат, одобренный для послеоперационной терапии меланомы IV стадии после полной циторедукции в России, Европе и США. Его регистрационным рандомизированным исследованием является СheckMate 238. Его основные характеристики, а также профиль токсичности препарата описаны выше.
В подгрупповом анализе отдельно оценивали БРВ при IV стадии после полной циторедукции. Так, трехлетняя БРВ составила 54% в группе ниволумаба и 40% в группе ипилимумаба (ОР 0,71; 95% ДИ 0,46–1,08) (рис. 5). Увеличение трехлетней БРВ было сходным в подгруппах BRAFmut и BRAFwt [16].
Назначение ниволумаба после полной циторедукции при IV стадии в течение 12 месяцев включено в российские клинические рекомендации в двух режимах – один раз в две или четыре недели.
В 2019 г. на конгрессе ESMO были представлены результаты II фазы рандомизированного исследования IMMUNED. В этом исследовании 167 пациентов были рандомизированы на три группы:
- ниволумаб 1 мг/кг внутривенно капельно каждые три недели + четыре введения ипилимумаба 3 мг/кг внутривенно капельно каждые три недели с дальнейшим поддерживающим режимом ниволумаба в дозе 3 мг/кг внутривенно капельно каждые две недели;
- ниволумаб в монорежиме 3 мг/кг внутривенно капельно каждые две недели;
- плацебо.
Все три группы получали лечение в течение года [21].
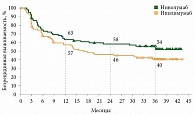
Полученные результаты указывают на статистически достоверное преимущество комбинации ниволумаба и ипилимумаба в увеличении двухлетней БРВ. Так, в группе комбинации она составила 70%, в группе ниволумаба в монорежиме – 42% (ОР 0,40; 95% ДИ 0,22–0,73), в группе плацебо – 14% (рис. 6). Следует отметить, что в группе комбинации медиана БРВ на данный момент не достигнута, в группах ниволумаба и плацебо она составила 12,4 и 6,4 месяца соответственно.
Чаще нежелательные явления 3–4-й степени, связанные с лечением, возникали в группе комбинированной иммунотерапии (71%), реже – на фоне ниволумаба в монорежиме (27%). Токсичность, потребовавшая прекращения лечения, зафиксирована у 13% больных, принимавших ниволумаб, у 62% пациентов, получавших ипилимумаб и ниволумаб, и у 2% пациентов группы плацебо. Приведенные данные, несомненно, требуют подтверждения в ходе III фазы клинического исследования, однако можно предположить, что в ближайшем будущем возможны изменения в стандартной тактике системного лечения при меланоме IV стадии после полной циторедукции.
Возможные варианты адъювантной терапии меланомы II–III и IV стадий после полной циторедукции, согласно клиническим рекомендациям, представлены в табл. 3 [5, 6]. Следует подчеркнуть, что всем пациентам необходимо предлагать участие в клинических исследованиях, если имеется такая возможность.
Заключение
Меланома кожи длительное время оставалась заболеванием, против которого в арсенале врача-онколога имелись по сути только химиотерапия и препараты рекомбинантного ИФН-альфа. С появлением таргетной терапии и ингибиторов контрольных точек иммунного ответа лечебные опции расширились сначала для метастатической стадии, а впоследствии и для профилактики рецидива местнораспространенных стадий.
На нынешнем этапе развития онкологии нам удалось совершить огромный шаг вперед, увеличив безрецидивную выживаемость пациентов за счет назначения новых эффективных препаратов для послеоперационной системной терапии меланомы III стадии. К сожалению, остается много нерешенных вопросов: какая адъювантная терапия наиболее эффективна для IIВ–С стадий? какие предиктивные маркеры могут быть использованы для выбора одной из опций оптимальной терапии? появится ли в будущем возможность назначать иммунотерапию в неоадъювантном режиме и будет ли она эффективна? Несомненно, в обозримом будущем ответы на эти вопросы будут найдены. Но к тому моменту возникнут новые вопросы…
N.V. Zhukova, PhD, R.V. Orlova, PhD, Prof., Ye.A. Kaledina, N.P. Belyak, PhD, A.S. Demchenkova
City Clinical Oncology Center, St. Petersburg
St. Petersburg State University
Contact person: Natalya V. Zhukova, drnvz@yandex.ru
For a long time, there was only one option for treating skin melanoma in adjuvant mode – recombinant interferon alpha drugs. The emergence of anti-CTLA-4-, anti-PD-1-inhibitors and targeted therapy marked the beginning of a new era of the disease effective treatment. Thanks to modern methods of systemic therapy, the rates of relapse-free survival have significantly increased compared to similar indicators that were observed ten years ago. The article provides the analysis of the results of studies of adjuvant therapy of stages II–IV after complete cytoreduction, and highlights the latest clinical recommendations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.