Опыт лечения пациентов с иммуноопосредованными нежелательными явлениями на фоне применения ингибиторов контрольных точек
- Аннотация
- Статья
- Ссылки
- English
![Рис. 1. Время наступления иммуноопосредованных нежелательных явлений от начала терапии [14]](/upload/resize_cache/iblock/dc1/195_350_1/anohina1.jpg)
Введение
Взгляд на иммунотерапию кардинально изменился, когда результаты исследований активирующего влияния на развитие Т-клеточного ответа блокады рецептора CTLA4, начавшиеся в 1995 г., в 2011 г. получили подтверждение в клинической практике [1]. На смену прежнему подходу, предполагавшему стимулирование иммунного ответа, пришел новый, предусматривающий в первую очередь устранение факторов, угнетающих развитие иммунного ответа, – так называемых блокаторов иммунного ответа. Арсенал лекарственных средств при метастатической меланоме кожи расширился за счет ипилимумаба – блокатора рецептора CTLA4. Это первый препарат, продемонстрировавший способность увеличивать медиану общей выживаемости больных меланомой, воздействуя исключительно на иммунную систему [2]. В результате дальнейшего изучения противоопухолевого иммунного ответа первые препараты из группы ингибиторов PD1 пембролизумаб и ниволумаб были одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для лечения больных диссеминированной меланомой кожи в сентябре и декабре 2014 г. соответственно.
В настоящее время новый класс иммуноонкологических препаратов подразделяется на три группы – антитела к антигену цитотоксических Т-лимфоцитов CTLA4 (ипилимумаб), блокаторы рецептора программируемой клеточной гибели PD1 (ниволумаб, пембролизумаб), блокаторы лиганда-1 белка программируемой гибели PD-L1 (авелумаб, дурвалумаб, атезолизумаб).
Важнейшей отличительной особенностью нового направления считается его универсальность. Подтверждение тому – эффективность препаратов при различных злокачественных опухолях. Первоначально эффективность препаратов была доказана у пациентов с нерезектабельными меланомой и немелкоклеточным раком легкого, впоследствии – у больных раком почки, плоскоклеточным раком головы и шеи, раком мочевого пузыря. Не исключено, что скоро этот перечень расширится за счет других злокачественных опухолей [3].
Ипилимумаб представляет собой моноклональное антитело иммуноглобулина класса G1 к четвертому антигену цитотоксических лимфоцитов (CTLA4) [4]. CTLA4 (также известный как CD152) – мембранный рецептор, который экспрессируется на поверхности Т-лимфоцитов и конкурирует с рецептором СD28 за связывание с антигеном CD80. В результате взаимодействия CD28 и CD80 происходит активация Т-лимфоцита. CTLA4 имеет более высокую аффинность к CD80. Их связывание приводит к остановке иммунного ответа и гибели лимфоцита. В экспериментальных исследованиях, которые проводились с 1987 г., показана высокая значимость данного антигена в качестве мишени для иммунотерапии [5]. В ряде клинических исследований у 20–30% больных диссеминированной меланомой на фоне применения ипилимумаба отмечались длительный объективный ответ и стабилизация, увеличивались медианы выживаемости без прогрессирования и общей выживаемости [6].
Физиологическая роль сигнального пути PD1 заключается в предотвращении развития чрезмерно сильного иммунного ответа. При активации рецептора PD1 его специфическими лигандами (PD-L1, PD-L2) запускаются процессы апоптоза цитотоксических лимфоцитов. Гиперэкспрессия PD-L1 в опухоли служит одним из ключевых механизмов феномена ускользания опухоли от иммунного контроля [7].
Несмотря на доказанную эффективность, терапия ингибиторами контрольных точек сопровождается развитием иммуноопосредованных нежелательных явлений (иоНЯ). Анти-CTLA4- и анти-PD1-моноклональные антитела характеризуются аналогичным спектром токсических эффектов. Развитие нежелательных явлений на фоне применения иммуноонкологических препаратов тесно связано с подавлением процессов, обычно отвечающих за торможение аутоагрессии иммунной системы. Аутоиммунное воспаление возникает в различных органах-мишенях: коже, желудочно-кишечном тракте, печени, почках, гипофизе, щитовидной железе, легких, органе зрения, нервной системе и др. [8–11].
Так, в исследовании А. Bertrand у 72% больных диссеминированной меланомой кожи, получавших терапию ипилимумабом, наблюдались иоНЯ, 24% из них тяжелой степени. Летальный исход имел место менее чем в 1% случаев [12]. Средний период до наступления нежелательных явлений 2–4-й степени составил 6,86 недели от начала лечения. Обратите внимание: этот показатель варьируется, иоНЯ могут возникнуть спустя несколько месяцев после окончания лечения [13].
Наиболее частыми осложнениями терапии анти-PD1-моноклональными антителами являются слабость, кожная токсичность в виде сыпи и зуда, кашель, диарея, снижение аппетита, обстипация, артралгия (рис. 1) [14, 15].
Побочные эффекты 3–4-й степени при использовании ниволумаба и пембролизумаба зарегистрированы в 5–10% случаев, комбинации ниволумаба и ипилимумаба – в 54–55% [16].
В отличие от терапии ипилимумабом лечение ингибиторами PD1 редко сопровождается развитием осложнений со стороны желудочно-кишечного тракта. При использовании препаратов этой группы в 1–5% случаев развиваются пневмониты. В литературе описаны летальные исходы, обусловленные пневмонитами 3–4-й степени [17].
Алгоритм лечения
В настоящее время разработаны международные и российские пошаговые рекомендации по выявлению и купированию иоНЯ [18, 19]. Жизнеугрожающие иоНЯ могут развиться и спустя месяцы после завершения лечения. Поэтому больные, принимающие иммуноонкологические препараты, требуют пристального наблюдения не только во время терапии, но и по ее окончании.
В основе алгоритма лечения пациентов, у которых на фоне терапии возникли иоНЯ, лежат несколько принципов.
- Использование ступенчатой терапии при любых иоНЯ. Начальная ступень выбирается исходя из тяжести иоНЯ, переход на более высокие ступени осуществляется при неэффективности проводимой терапии. Переход на более низкую ступень не предусмотрен, лечение отменяется постепенно при условии значительного улучшения симптомов иоНЯ.
Осложнения 1–2-й степени на фоне применения ингибиторов контрольных точек обычно (за исключением иммуноопосредованных пневмонитов) не требуют прекращения иммунотерапии и отмены системных глюкокортикостероидов (ГКС). При осложнениях 2-й степени на фоне проводимой симптоматической терапии в отсутствие улучшения в течение 7–10 дней принимается решение о назначении преднизолона 1 мг/кг веса пациента до купирования нежелательных явлений или уменьшения степени их тяжести до легкой. При осложнениях выраженной степени терапия иммуноонкологическими препаратами приостанавливается или прекращается, назначаются высокие дозы преднизолона (1–2 мг/кг веса пациента).
- Во время лечения пациентов с иоНЯ могут использоваться любые ГКС в дозах, эквивалентных преднизолону.
- Дозы ингибиторов контрольных точек зависят от развития иоНЯ. Терапия либо продолжается в прежних дозах, либо отменяется (при выраженных иоНЯ или их недостаточном контроле).
- Обязательно проведение противоязвенной терапии, коррекции электролитного состава крови в целях профилактики осложнений системного применения ГКС.
- Длительная терапия ГКС, направленная на купирование иоНЯ, способна приводить к развитию нежелательных ятрогенных осложнений, в частности стероидного диабета, и требует коррекции и наблюдения эндокринолога во время лечения и после его окончания.
- Перед началом системной терапии ГКС необходимо исключить инфекционную этиологию осложнений.
- При 3–4-й степени тяжести иоНЯ и длительной (свыше трех недель) терапии ГКС целесообразно назначение противомикробных препаратов для профилактики оппортунистических инфекций.
- В случае выраженной степени тяжести аутоиммунных осложнений при неэффективности терапии ГКС в высоких дозах в течение 3–5 дней и при условии исключения перфорации кишечника, перитонита, внутреннего кровотечения и активного инфекционного процесса назначаются иммунодепрессанты (инфликсимаб, микофенолата мофетил).
- Пациенты, получающие ГКС внутривенно, могут быть переведены на пероральный прием в эквивалентной дозе в начале периода постепенной отмены препарата или по достижении стойкого клинического улучшения. При переводе пациентов на эквивалентную дозу пероральных ГКС следует учитывать более низкую биодоступность последних.
- При перерыве в лечении из-за иоНЯ терапия возобновляется только после снижения степени их выраженности до первой или полного купирования. При возобновлении иммунотерапии системными ГКС их доза к моменту начала терапии не должна превышать 10 мг/сут (эквивалентно преднизолону). Ускорять процесс снижения дозы ГКС для более быстрого начала терапии недопустимо.
Кроме того, при наиболее частых иоНЯ предпочтение следует отдавать специальным алгоритмам, если, конечно, таковые разработаны.
Клиническая практика
Рассмотрим на конкретных примерах алгоритм лечения больных диссеминированными меланомой кожи и раком почки, у которых на фоне приема ипилимумаба и ниволумаба возникли иоНЯ. Все пациенты получали терапию в рамках программ расширенного доступа к указанным препаратам.
Клинический случай 1
Пациент С., 76 лет. 12 января 2009 г. выполнено широкое иссечение образования передней брюшной стенки. Верифицирована узловая пигментная меланома, pT4aN0M0.
13 января 2010 г. выявлены метастазы в аксиллярных лимфатических узлах справа.
8 февраля 2010 г. проведено оперативное лечение в объеме правосторонней аксиллярной лимфаденэктомии.
Результаты контрольного обследования 18 декабря 2014 г. показали прогрессирование процесса: метастаз в правом надпочечнике, повышение уровня лактатдегидрогеназы. Выявлена мутация BRAF V600Е.
1 февраля 2015 г. начата терапия вемурафенибом. Из-за кожной токсичности 3-й степени, которая не поддавалась коррекции после максимальной редукции дозы препарата, лечение было прекращено.
При обследовании в декабре 2015 г. зафиксированы новые единичные метастазы в легких, метастаз в надключичном лимфатическом узле справа, увеличение размеров метастаза в правом надпочечнике.
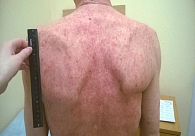
23 декабря начата терапия ипилимумабом. Выполнено два введения препарата. Третье пришлось отложить из-за появления сыпи 3-й степени (рис. 2).
С 4 по 10 февраля 2016 г. проведена терапия преднизолоном 1 мг/кг.
18 февраля выполнено третье введение ипилимумаба.
С 19 февраля отмечалось появление диареи до десяти эпизодов в сутки, о чем пациент своевременно не сообщил лечащему врачу.
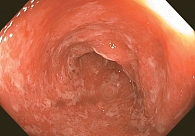
24 февраля больной был госпитализирован с серьезными иоНЯ – эрозивно-язвенным колитом 4-й степени (рис. 3).
Инфузионная терапия преднизолоном 2 мг/кг/сут (120 мг), согласно алгоритму купирования иммуноопосредованных осложнений, терапия октреотидом, кишечными антисептиками, антибактериальная терапия, гидратация, строгая диета с ограничением лактозы, жиров и клетчатки желаемого результата не дали. Отмечалось снижение массы тела на 15 кг.
5 марта, спустя сутки после введения инфликсимаба 5 мг/кг, отмечался клинический эффект в виде уменьшения количества эпизодов диареи. К 9 марта степень выраженности диареи снизилась до второй.
10 марта больного выписали из стационара в удовлетворительном состоянии.
До 23 марта сохранялись слабость, выраженные колебания уровня глюкозы на фоне продолжения терапии преднизолоном 120 мг/сут парентерально.
25 марта осуществлена одномоментная редукция дозы преднизолона до 50 мг/сут. Впоследствии дозу препарата постепенно снижали. Диарея была купирована, общее состояние улучшилось. Пациенту разрешили расширить диету.
Двусторонняя полисегментарная пневмония как проявление оппортунистической инфекции, зафиксированная 6 апреля, была купирована комбинированной антибактериальной терапией в течение недели.
Данные колоноскопии от 10 мая показали признаки поверхностного колита. К июню 2016 г. вес стабилизировался, симптомы иоНЯ отсутствовали, при колоноскопии – нормализация картины.
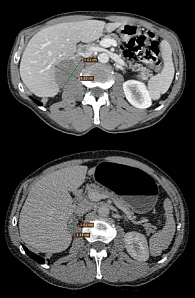
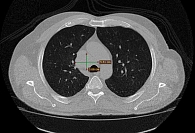
По данным компьютерной томографии органов грудной клетки и брюшной полости от 31 марта 2016 г. (по сравнению с исследованием от 16 декабря 2015 г.) – частичный регресс метастазов в правом надпочечнике, в надключичном лимфатическом узле справа (рис. 4). Стабилизация процесса сохранялась до сентября 2017 г.
Клинический случай 2
Пациентка Е., 26 лет, в 2013 г. обнаружила небольшое плоское пигментное образование в левой височной области на границе волосистой части головы. В апреле 2014 г. выполнено иссечение образования левой височной области, которое верифицировано как меланома, pT1N0M0.
В октябре появилось подкожное образование около 10 мм в проекции околоушной области слева.
В декабре выполнено иссечение образования, гистологически подтвержден метастаз меланомы кожи.
9 декабря проведена экстирпация левой околоушной слюнной железы с препарированием ветвей лицевого нерва. Выявлены метастазы в лимфатических узлах околоушной области.
12 января 2015 г. начата иммунотерапия интерфероном альфа 3 МЕ три раза в неделю.
В сентябре зафиксированы прогрессирование процесса: метастазы в легких, мягких тканях левой ягодичной области, брюшине маточно-прямокишечного кармана, рецидив в области ложа левой околоушной железы.
8 декабря начата терапия ипилимумабом 3 мг/кг. После первого введения отмечалась диарея 3-й степени. Осложнение купировано преднизолоном 1 мг/кг в течение семи дней.
29 декабря выполнено второе введение ипилимумаба.
5 января 2016 г. лечение осложнилось выраженной астенией, гастроэнтероколитом 4-й степени тяжести.
12 января больная была госпитализирована для проведения инфузионной терапии преднизолоном 2 мг/кг, согласно алгоритму купирования иоНЯ. Применялась терапия кишечными антисептиками, антибактериальная терапия.
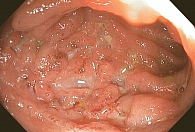
Данные колоноскопии от 19 января: терминальный язвенный илеит, выраженные явления колита (рис. 5). Терапия ГКС оказалась неэффективной. 19 января выполнено введение инфликсимаба 5 мг/кг с клиническим эффектом.
С 21 января проводилась редукция дозы преднизолона с последующим медленным снижением по 2,5 мг через день до полного купирования иоНЯ. Терапия ипилимумабом была прекращена.
Результаты колоноскопии толстой кишки от 14 марта показали выраженную положительную динамику, остаточные явления поверхностного колита.
Клинический случай 3
Пациент М., 61 год, диагноз меланомы кожи спины, pT2N0M0. До начала терапии ипилимумабом проведено два оперативных вмешательства в декабре 2013 г. и феврале 2014 г.
В январе 2015 г. зафиксировано прогрессирование заболевания: метастазы в паратрахеальных лимфатических узлах.
При анализе данных молекулярно-генетического исследования выявлена мутация NRAS Q61L. Проведено четыре цикла химиотерапии дакарбазином, терапия интерфероном альфа 6 МЕ. На фоне лечения возникли головные боли 2-й степени, тошнота 2-й степени, астения 2-й степени, миалгия 2-й степени.
В августе отмечалось прогрессирование заболевания.
3 сентября была начата терапия ипилимумабом.
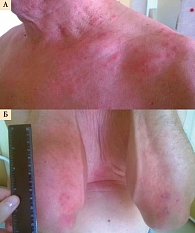
21 сентября после первого введения препарата в области передней грудной стенки, на верхних конечностях, передней брюшной стенке, в паховой и подколенных областях появилась мелкопятнистая кожная сыпь 3-й степени (рис. 6А и 6Б).
Согласно алгоритмам лечения иоНЯ, терапия ипилимумабом была приостановлена и начат прием преднизолона 1 мг/кг, внутрь, ежедневно, до полного купирования симптомов.
7 октября терапия ипилимумабом была возобновлена. Выполнено еще два введения.
19 ноября больного госпитализировали с симптомами фебрильной лихорадки, сухим кашлем.
Данные рентгенографии органов грудной клетки от 17 ноября: усиление легочного рисунка в прикорневых и базальных отделах легких, более выраженное в S10 правого легкого, расширение тени средостения. Комбинированная инфузионная антибактериальная и противогрибковая терапия в течение трех суток эффекта не дала. Диагностированный иммуноопосредованный пневмонит 3-й степени потребовал прекращения терапии ипилимумабом
(рис. 7).
С 23 ноября по 27 декабря проводилась инфузионная терапия преднизолоном 2 мг/кг, согласно алгоритмам лечения иоНЯ, до полного купирования симптомов с последующим медленным снижением дозы препарата.
Данные контрольного обследования от 21 января: прогрессирование процесса в легких (RECIST и irRC).
В феврале 2016 г. пациент получил травму – компрессионный перелом позвоночника Th8 и Th11, после чего проходил длительную реабилитацию.
Осенью 2016 г. пациента включили в программу расширенного доступа к препарату ниволумаб.
С 2 ноября 2016 г. по сентябрь 2017 г. выполнено 19 введений ниволумаба. На фоне терапии отмечался частичный регресс. Нежелательных явлений не зарегистрировано.
Клинический случай 4
Пациент В., 57 лет, диагноз светлоклеточного рака правой почки.
28 марта 2014 г. выполнена правосторонняя нефрэктомия.
10 июля выявлены множественные метастазы в легких, внутригрудных лимфатических узлах.
1 сентября проведена метастазэктомия правого легкого с нормотермической химиоперфузией мелфаланом. Пациент получал вакцинотерапию аутологичными дендритными клетками в адъювантном режиме до марта 2015 г. В марте выявлено прогрессирование метастатического процесса в легких и лимфатических узлах средостения.
На фоне терапии пазопанибом, начатой 14 апреля, достигнут максимальный эффект в виде стабилизации процесса.
В январе 2016 г. выявлены прогрессирование в костях, увеличение размеров метастазов в лимфатических узлах.
29 марта начата терапия ниволумабом в рамках программы расширенного доступа. Достигнута стабилизация, которая сохраняется по настоящее время.
В июне 2016 г. больной отмечал появление болей в мелких суставах кистей и стоп и чувства скованности и болей в мышцах нижних конечностей, которые впоследствии прогрессировали. Ревматическая природа явлений исключалась.
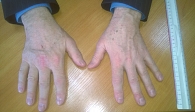
В мае 2017 г. из-за выраженного болевого синдрома и снижения качества жизни пациента на фоне явлений реактивного деформирующего артрита 2-й степени и миозита 1–2-й степени тяжести было назначено системное лечение ГКС (рис. 8).
Пациент получал преднизолон 60 мг/сут две недели. Впоследствии доза была снижена до 10 мг/сут. На фоне терапии преднизолоном отмечался быстрый эффект купирования нежелательных явлений в виде значительного уменьшения скованности и болей в мышцах нижних конечностей. Отек и болезненность мелких суставов кистей и стоп регрессировали к июню 2017 г.
Обсуждение
Анализ клинических случаев 1 и 2 демонстрирует связь между поздним началом терапии и более выраженной степенью иоНЯ.
Успех терапии осложнений обеспечивает своевременное назначение ГКС в высоких дозах и иммунодепрессантов. От лечащего врача-онколога требуется наличие не только опыта терапии препаратами данной группы, но и знаний методов коррекции иоНЯ. Ранняя диагностика и адекватное лечение нежелательных явлений имеют решающее значение для сведения к минимуму вероятности развития жизнеугрожающих состояний. Не последнюю роль играет и взаимодействие между пациентом и лечащим врачом, понимание основополагающих моментов лечебного процесса и динамического наблюдения [20].
Особое место занимает выявление в анамнезе иоНЯ при проведении предыдущих линий иммунотерапии. Выраженные осложнения на фоне иммунологического лечения в прошлом как проявления общей реактивности организма могут быть предвестниками развития серьезных и жизнеугрожающих иоНЯ при использовании ингибиторов контрольных точек. Результаты ряда исследований подтверждают безопасность терапии анти-PD1-ингибиторами у пациентов, у которых на фоне предыдущей терапии ипилимумабом имели место иоНЯ. В клиническом случае 3 продемонстрирована непрямая зависимость между иоНЯ и разными иммуноонкологическими препаратами [21].
В клиническом случае 4 показано, что алгоритмы купирования иоНЯ могут быть модифицированы в исключительных ситуациях, когда иоНЯ 2-й степени тяжести на фоне терапии ниволумабом требуют системной терапии ГКС с целью повышения качества жизни больного.
Для купирования иоНЯ необходимо продолжительное, последовательное и методичное лечение. В свою очередь продолжительное системное применение ГКС при иоНЯ не влияет на эффективность терапии ингибиторами контрольных точек, но способно привести к развитию ятрогенных осложнений, требующих специфического или симптоматического лечения.
Лечение осложнений, возникших на фоне применения ингибиторов контрольных точек, требует мультидисциплинарного подхода с привлечением врачей смежных специальностей, имеющих опыт терапии аутоиммунных заболеваний и иммуноопосредованных осложнений. Речь идет об эндокринологах, офтальмологах, пульмонологах, гепатологах, гастроэнтерологах, неврологах, ревматологах.
В настоящее время появляются работы, устанавливающие связь между эффективностью терапии и степенью тяжести иоНЯ. Дальнейшее изучение подобной корреляции представляется крайне актуальным, поскольку информация о достоверных предиктивных факторах эффективности терапии ингибиторами блокаторов контрольных точек отсутствует.
Заключение
Алгоритмы купирования иоНЯ, применяемые в клинической практике, доказали свою эффективность. Адекватность доз препаратов, своевременность начала терапии и ее продолжительность являются залогом успешного купирования иоНЯ.
S.A. Protsenko, Ye.M. Anokhina, A.V. Novik, A.I. Semyonova
N.N. Petrov National Medical Research Center of Oncology
Contact person: Svetlana Anatolyevna Protsenko, s.protsenko@list.ru
The emergence of new immune-oncological drugs has opened up new opportunities in the treatment of patients with disseminated cancer. Being introduced in the clinical practice, checkpoint inhibitors have shown high efficacy and acceptable toxicity. However, the new spectrum of toxicity, different from the usual complications due to treatment with cytostatics, required the development and testing of special algorithms of immune-mediated undesirable events stopping. The article provides the clinical applications of the checkpoint inhibitors and international algorithms of immune-mediated undesirable events correction.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.