Опыт применения иммунотерапии при погранично резектабельной первичной или олигометастатической меланоме кожи
- Аннотация
- Статья
- Ссылки
- English



Введение
Долгое время показатели пятилетней выживаемости больных с III стадией злокачественной меланомы кожи оставались неутешительными [1, 2]. Сходная ситуация наблюдалась и у больных с рецидивом заболевания после радикального хирургического лечения. Однако появление таргетных препаратов, а затем ингибиторов контрольных точек позволило более чем в три раза улучшить отдельные показатели выживаемости [3, 4].
В настоящее время стандартным подходом к ведению пациентов c III стадией является хирургическое удаление первичной опухоли с последующей адъювантной терапией. Больным с IV стадией показана таргетная терапия или иммунотерапия в зависимости от подтипа и прогноза опухоли. Предоперационная терапия позволяет достигать важнейших целей [5, 6]. Во-первых, уменьшение объема опухолевых очагов облегчает выполнение и повышает радикальность хирургического пособия, а также значительно улучшает косметические характеристики проведенного вмешательства. Во-вторых, появляется реальная возможность определить прогноз течения болезни c помощью оценки лекарственного патоморфоза в операционных образцах. Полный патоморфологический регресс – важнейший прогностический фактор хорошего прогноза. Данная закономерность установлена для HER2-позитивного рака молочной железы, плоскоклеточных опухолей головы и шеи, рака анального канала [7–9]. И наоборот, отсутствие лекарственного патоморфоза служит важным биологическим маркером нецелесообразности проведения адъювантной терапии.
Существенные недостатки предоперационного или неоадъювантного лекарственного лечения – отсрочка потенциально радикального хирургического вмешательства с потерей его радикальности и невозможность выполнения. В связи с этим особое значение приобретает прогнозирование эффекта на ранних этапах терапии. Подобные закономерности показаны для физических свойств опухолевых очагов, в частности жесткости.
Ранее было продемонстрировано, что изменение жесткости опухоли, оцененное методом магнитно-резонансной эластографии, коррелирует с уменьшением размеров опухоли при ее стандартной оценке [10, 11]. Кроме того, на возможность проведения радикального лечения способно повлиять и ухудшение общего состояния больного на фоне токсичности системной предоперационной терапии. Между тем предоперационная лекарственная терапия имеет преимущества, одним из которых является возможность исследования механизмов, определяющих чувствительность и резистентность опухоли к новым лекарственным препаратам, в том числе ингибиторам контрольных точек.
Возможности предоперационного использования иммунотерапевтических препаратов нового поколения изучены недостаточно. Тем не менее имеются крайне обнадеживающие результаты применения данного класса препаратов при локализованных или погранично резектабельных опухолях различных нозологических форм [12, 13]. На текущий момент известно несколько исследований, суммарно включавших 64 больных, в которых использовалась предоперационная иммунотерапия [14].
Учитывая сказанное, мы решили изучить вопрос целесообразности полной циторедукции на фоне терапии ингибиторами контрольных точек у пациентов с меланомой кожи.
Материал и методы
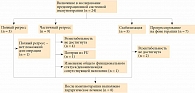
Нами проведено исследование эффективности предоперационной иммунотерапии ингибиторами контрольных точек у больных с гистологически подтвержденной меланомой кожи, значительным местным распространением заболевания или олигометастатическим рецидивом заболевания, относительно удовлетворительным состоянием (ECOG 0/1) и потенциальной возможностью выполнения полного циторедуктивного хирургического вмешательства при условии уменьшения размеров образований. В описываемой группе пациентов применялась комбинированная иммунотерапия (ипилимумаб 3 мг/кг + ниволумаб 1 мг/кг внутривенно капельно каждые три недели) или монотерапия ниволумабом 3 мг/кг внутривенно капельно каждые две недели. Всем больным до начала терапии проводилась ПЭТ-КТ всего тела с фтордезоксиглюкозой для исключения наличия множественных отдаленных очагов, а также общеклиническое обследование в рамках оценки безопасности лечения как элемент стандартных процедур, предусмотренных КСГ. С целью оценки ультразвуковых характеристик опухоли до начала терапии и на ее фоне, а также корреляции ранних изменений и отдаленных результатов лечения выполнялось ультразвуковое исследование в серошкальном режиме с применением допплеровских методик и в режиме компрессионной и сдвиговолновой эластографии на аппарате Philips Epic 7, с описанием ультразвуковых признаков метастатического поражения лимфатических узлов в каждом из них. Ультразвуковыми признаками метастатического поражения в В-режиме являются форма лимфоузла, эхогенность, структура и распределение сосудистого компонента в лимфоузле, а также перифокальное повышение эхогенности тканей за счет отека, бугристые контуры. Исследование проводилось в два этапа – до первого введения противоопухолевого препарата и после третьего введения. Для объективной оценки эффекта на фоне терапии выполнялась компьютерная томография зон поражения с внутривенным контрастированием. Полученные результаты оценивали в соответствии с критериями RECIST v.1.1 [15]. Решение о выполнении хирургического лечения принималось мультидисциплинарной врачебной комиссией при условии возможности полного циторедуктивного лечения R0. После такого лечения было запланировано наблюдение за пациентами в отсутствие системной терапии. Больные, которым выполнение хирургического лечения считалось невозможным, продолжили лечение в соответствии с рекомендациями для неоперабельных пациентов.
Результаты
С 2019 по 2020 г. в исследование было включено 24 пациента, которые получали лечение в ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)». Хирургическое лечение получили восемь из 24 пациентов. Алгоритм включения пациентов в исследование представлен на рис. 1.
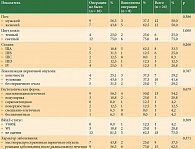
Клинические характеристики больных приведены в табл. 1. У девяти из 24 пациентов первичная опухоль имела локальное распространение, а у 15 являлась изолированным олигометастатическим рецидивом заболевания после радикального лечения. BRAF-статус изучен у шести из 24 пациентов, отсутствие мутаций выявлено у пяти из шести больных.
В рамках исследования иммунотерапии ингибиторами контрольных точек у больных с погранично резектабельной злокачественной меланомой кожи восемь пациентов получили терапию ипилимумабом и ниволумабом и 16 – монотерапию ниволумабом. При этом среднее число введений ипилимумаба составило 1,3 (1–4), ниволумаба – шесть (4–10). На фоне терапии клинический регресс опухоли зарегистрирован у 12 (50%) из 24 пациентов: у трех (8,3%) полный регресс, у девяти (37,5%) – частичный. Стабилизация заболевания отмечалась у пяти больных. Прогрессирование болезни выявлено у восьми (33,3%) из 24 пациентов – одного больного в группе комбинированной иммунотерапии и семи – в группе монотерапии.
Хирургическое лечение проведено восьми (33,3%) из 24 больных. При этом один из 16 больных хирургическое лечение не получил из-за отсутствия субстрата для удаления (полный клинический регресс), семь из 16 больных – из-за прогрессирования заболевания на фоне индукционного лечения, один из 16 – из-за ухудшения общесоматического статуса. Один из 16 пациентов отказался от дальнейшего лечения по личным причинам. У четырех из 16 больных резектабельность на фоне терапии по решению врачебной комиссии не была достигнута.
Достоверных различий в клинических характеристиках между группами с хирургическим лечением и без него не установлено. Медиана времени от начала терапии до выполнения операции составила 3,1 месяца (95%-ный доверительный интервал (ДИ) 0,0–6,2). Все хирургические манипуляции выполнены с R0. Достоверной связи между вариантом лекарственной терапии, достигнутым регрессом и характером лечения (первично распространенная опухоль или олигометастатический рецидив) не зафиксировано. При исследовании операционных гистологических препаратов полный патоморфологический регресс отмечался у двух из восьми пациентов.
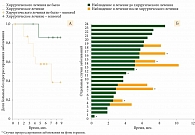
Медиана времени до прогрессирования не достигнута в группе с хирургическим лечением, тогда как в группе без хирургического удаления очагов она составила 7,2 месяца (95% ДИ 1,5–12,8). Моделирование выживаемости без прогрессирования представлено на рис. 2 (А).
Прогрессирование заболевания выявлено у двух из 16 больных в группе без операции и пяти из восьми больных, находившихся на динамическом наблюдении после хирургического лечения. На фоне динамического наблюдения прогрессирование отмечалось в среднем через 2,8 (1,1–4,3) месяца. При этом у двух больных с полным патоморфологическим регрессом опухоли на фоне индукционной иммунотерапии до момента сбора данных прогрессирования не зарегистрировано (2,4 и 4,4 месяца) (табл. 2).
С помощью ультразвукового исследования нами проведена оценка динамики жесткости опухоли на фоне иммунотерапии. Как показал анализ эластографического коэффициента (St/R) в случае стабилизации или регресса опухоли, значения St/R снижались сразу после первого введения иммунотерапевтических препаратов, несмотря на увеличение размеров лимфоузлов (табл. 3). У пациентов с прогрессированием заболевания этот показатель увеличивался.
Примечательно, что у пациентов с полным патоморфологическим регрессом (два пациента из восьми) показатели сдвиговолновой эластографии (модуль Юнга) снижались на фоне лечения. В то же время у пациентов с частичным ответом на лечение и прогрессированием (шесть пациентов из восьми) модуль Юнга возрос (табл. 4). Из-за небольшого числа наблюдений статистическая достоверность описанных выше наблюдений не оценивалась.
Обсуждение результатов
Лекарственная терапия ингибиторами контрольных точек, обладающая высокой эффективностью в неоадъювантном режиме, позволила выполнить радикальное хирургическое вмешательство восьми из 24 больных с местнораспространенной/олигометастатической меланомой кожи. Очевидно, что неоадъювантного лечения недостаточно с точки зрения достижения длительной безрецидивной выживаемости. У большинства наших пациентов (пять из восьми) в отсутствие адъювантного лечения рецидив наблюдался уже в течение трех месяцев после операции. Поэтому все больные местнораспространенной меланомой в случае регресса опухоли и появления возможности выполнения R0 резекции нуждаются в продолжении лекарственного адъювантного лечения.
Особого внимания заслуживают случаи полного патологического регресса. В нашем исследовании в двух из восьми случаев исследования операционного материала опухолевые клетки не выявлены, что позволяет говорить о возможности излечения части больных. Согласно литературным данным, полный патоморфологический регресс является важнейшим признаком благоприятного прогноза для многих опухолей, в том числе меланомы [14]. Двое больных исследуемой группы с полным патологическим регрессом не имеют признаков прогрессирования в течение 2,5 и четырех месяцев в отсутствие терапии после операции.
Несмотря на значимость достижения регресса и выполнения резекции, к сожалению, широкое неоадъювантное применение современных ингибиторов контрольных точек может быть преждевременным. Так, у семи из 24 больных на фоне высокоэффективной терапии зарегистрировано прогрессирование заболевания, в том числе у двух в виде появления многочисленных отдаленных метастазов. Кроме того, в литературе активно обсуждается вопрос гиперпрогрессирования на фоне иммунотерапии, что, вне всякого сомнения, исключает возможность хирургического удаления очагов [16].
Из-за отсутствия высокоинформативных маркеров для прогнозирования эффективности иммунотерапии выбор способа лечения значительно усложняется. Иммунотерапия ингибиторами контрольных точек реализует противоопухолевый эффект путем блокирования ингибирующего сигнала для лимфоцитов. В связи с этим регрессу опухоли предшествует ее массивная инфильтрация клетками иммунной системы, что может сопровождаться изменением ее плотности и соответствующих параметров при ультразвуковом исследовании. Для проверки этой гипотезы у всех пациентов с поверхностно расположенными метастатически измененными лимфатическими узлами оценивалось изменение жесткости опухолевых очагов. Нам удалось выявить тенденцию к повышению коэффициента деформации у больных с прогрессированием болезни, а также снижение модуля Юнга у пациентов с полным патоморфологическим регрессом опухоли. Из-за небольшого числа больных выявленные тенденции не имеют статистической значимости, но безусловно являются основанием для исследования данной проблемы в будущем.
Заключение
Полученные результаты позволяют предположить, что у части больных злокачественной меланомой на фоне терапии современными ингибиторами иммунных контрольных точек достигается полный патоморфологический регресс, который в ряде случаев может быть равносилен излечению от злокачественной опухоли. К сожалению, полное удаление видимых очагов хирургическими методами в отличие от локализованных опухолей не позволяет достигать подобных результатов при местнораспространенных и рецидивирующих формах.
V.V. Yegorenkov, M.S. Molchanov, A.V. Kutkovich, M.S. Aksenov, F.V. Moiseyenko, N.M. Volkov, V.V. Chernobrivtseva, A.S. Zhegalina, K.V. Shelekhova, V.M. Moiseyenko
Saint-Petersburg Clinical Research and Practice Center for Specialized Types of Medical Care (Oncological)
N.N. Petrov National Medical Research Center of Oncology
Contact person: Vitaly V. Yegorenkov, knpc.spb@oncocentre.ru
The study was conducted on the effectiveness of preoperative immunotherapy with checkpoint inhibitors in patients with histologically confirmed skin melanoma, significant local spread of the disease or oligometastatic relapse of the disease, relatively satisfactory ECOG status, and the possibility of performing complete cytoreductive surgery in the case if the size of the formations is reduced. The results obtained suggest that some patients with malignant melanoma on the background of therapy with immune checkpoint inhibitors of the last generation achieve complete pathomorphological regression, which in some cases may be equivalent to a cure from malignant tumor.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.