Применение кризотиниба в терапии ALK-позитивного немелкоклеточного рака легкого
- Аннотация
- Статья
- Ссылки
- English
Введение
Актуальность проблемы рака легкого в Иркутской области обусловлена ростом заболеваемости, высокой смертностью и неудовлетворительными результатами лечения. Рак легкого занимает первое место в структуре онкологической заболеваемости мужчин – 51,5% (в целом по России – 39,06%) и по-прежнему лидирует среди причин смерти от злокачественных опухолей – 42,06% (в целом по России – 34,89%) [1, 2]. Более 70% больных немелкоклеточным раком легкого (НМРЛ) обращаются с распространенным опухолевым процессом IIIB или IV стадии заболевания [1, 2]. При стандартной терапии с использованием платиновых режимов медиана выживаемости в данной группе пациентов составляет 8–10 месяцев, а время до прогрессирования – 4–6 месяцев [3]. В связи с неизлечимостью заболевания и непродолжительным выживанием пациентов с распространенным НМРЛ основными целями лечения являются максимальное продление жизни, облегчение симптомов заболевания, предотвращение серьезных осложнений, а также сохранение и улучшение качества жизни [4, 5].
В последние годы благодаря развитию новых подходов к терапии больных НМРЛ в результатах лечения наблюдается стойкая позитивная динамика. Этот прогресс особенно заметен, когда высокоэффективные таргетные препараты назначаются с учетом молекулярного подтипа опухоли [6].
У больных неплоскоклеточным НМРЛ на первом этапе проводится генетический анализ для определения наличия мутаций гена EGFR (18-й, 19-й и 21-й экзоны) и транслокации ALK. При наличии мутации EGFR пациентам в первой линии назначают ингибиторы тирозинкиназы EGFR – афатиниб, эрлотиниб или гефитиниб. При наличии транслокации ALK больным (предпочтительно в первой линии) назначают кризотиниб. Если мутации не обнаружены, проводится химиотерапия, предпочтителен режим «пеметрексед + цисплатин» или «паклитаксел + карбоплатин с бевацизумабом или без него» [4, 5].
Мутация гена ALK выявляется у 7,13% пациентов, причем у женщин чаще, чем у мужчин, – 13,15 и 4,17% соответственно.
Кризотиниб (Ксалкори) – конкурентный ингибитор АТФ тирозинкиназ рецепторов ALK, MET и ROS1. В результате селективной ингибирующей активности кризотиниба (Ксалкори) прекращается патологическое деление и происходит апоптоз опухолевых клеток. Появление на отечественном фармацевтическом рынке препарата Ксалкори позволило значительно улучшить показатели выживаемости у больных ALK-позитивным НМРЛ. Именно Ксалкори стал первым эффективным препаратом в лечении распространенного ALK-позитивного рака легкого [6].
По данным крупного рандомизированного исследования фазы III PROFILE 1014, у пациентов, получавших кризотиниб, медиана выживаемости без прогрессирования составила 10,9 месяца. У пациентов, получавших химиотерапию, этот показатель достиг 7,0 месяца. Частота объективных ответов у пациентов с ALK-позитивным НМРЛ на фоне терапии кризотинибом составила 75%, у пациентов группы химиотерапии – 45% [7]. В отличие от группы химиотерапии в группе кризотиниба улучшение качества жизни и снижение симптоматики рака легкого были выражены более значительно. Нежелательные явления в группе кризотиниба наблюдались реже и имели легкую степень, а лечение было более длительным, чем в группе химиотерапии (медиана 10,1 против 4,1 месяца) [8].
Ксалкори (кризотиниб) признан стандартом как первой, так и второй линии терапии ALK-позитивного НМРЛ [6].
Клинический случай
В декабре 2014 г. бригадой скорой помощи в клинику доставлена пациентка в возрасте 67 лет. Заболела остро, утром 21 декабря 2014 г. отмечала появление головокружения, тошноты, рвоты. По данным компьютерной томографии (КТ) органов грудной клетки и головного мозга, а также фибробронхоскопии больной поставлен диагноз «перибронхиальный рак нижней доли левого легкого T2N0M1 с метастазами в левую гемисферу мозжечка». 24 декабря 2014 г. выполнена операция: микрохирургическое удаление опухоли мозжечка слева в положении сидя под нейронавигационным контролем. Гистологически – метастаз аденокарциномы легкого. На следующем этапе планировалось проведение препаллиативной операции по удалению первичной опухоли. Однако 15 января 2015 г. произошла массивная тромбоэмболия легочной артерии, подтвержденная лабораторными анализами и данными КТ, с выраженной дыхательной недостаточностью. Источником тромбоэмболии стал тромбоз большой подкожной вены слева. Наличие флотирующего тромба потребовало выполнения 15 января 2015 г. операции – перевязки и разобщения устья большой подкожной вены по Троянову – Тренделенбургу слева. Затем в течение двух месяцев проводилась антикоагулянтная и антиагрегантная терапия, по окончании которой пациентку перевели на поддерживающую терапию препаратом Ксарелто 15 мг/сут.
В середине марта 2015 г. при осмотре сохранялись жалобы на периодические головокружения, общую слабость, одышку при умеренной физической нагрузке. Состояние по шкале ECOG – 1. КТ грудной клетки показала отрицательную динамику: центральный рак с ателектазом и гиповентиляцией сегментов нижней доли левого легкого, появились единичные метастазы в правом легком и канцероматоз медиастинальной плевры слева, гидроторакс слева. КТ головного мозга: данных, подтверждающих рецидив и рост опухоли, нет.
При исследовании полученного образца активирующих мутаций в гене EGFR не выявлено, обнаружена транслокация гена ALK. С 14 марта 2015 г. была начата таргетная терапия препаратом кризотиниб (Ксалкори) 250 мг два раза в день.
Через три месяца на фоне терапии отмечалась положительная динамика в виде субъективного улучшения общего самочувствия, уменьшения одышки. На контрольной КТ от 23 июня 2015 г. прослеживалось уменьшение размеров образования в прикорневой зоне левого легкого, уменьшение размеров образований по медиастинальной плевре слева, уменьшение количества содержимого в плевральной полости слева.
Пациентка переносила лечение удовлетворительно, гематологической и негематологической токсичности не отмечалось. Продолжена таргетная терапия кризотинибом.
Контрольная КТ в августе 2015 г. вновь показала уменьшение размеров образования в прикорневой зоне левого легкого.
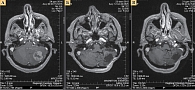
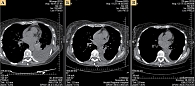
Во время очередного планового обследования при оценке опухоли по критериям RECIST на КТ, выполненной в декабре 2015 г., зафиксирована частичная регрессия опухоли с частичным восстановлением воздушности нижней доли левого легкого (рис. 1).
В марте 2016 г. рентгенологическая картина не отличалась от таковой в декабре 2015 г.: частичная регрессия опухоли сохранялась.
В марте 2016 г. после 12 месяцев терапии кризотинибом рентгенологически подтверждена частичная регрессия опухоли (рис. 2). Масса тела стабильная (58 кг). Сохраняются жалобы на периодические головокружения, одышка отсутствует. Состояние по шкале ECOG – 1. Пациентка ведет активный образ жизни. За год терапии нежелательных явлений, связанных с лечением, она не отмечала. Гематологической и негематологической токсичности не зафиксировано. Планируется продолжить терапию кризотинибом до прогрессирования с оценкой эффективности каждые три месяца.
Обсуждение
Рассмотренный клинический случай иллюстрирует потенциальный благоприятный эффект в отношении отдаленных результатов лечения при назначении кризотиниба в первой линии терапии распространенного ALK-позитивного НМРЛ. Пациентка продолжает получать кризотиниб в течение года. Отмечается частичная ремиссия. Данное лечение позволяет не только увеличить медиану общей выживаемости, но также значительно продлить время до прогрессирования и сохранить качество жизни и социальный статус больной.
При выборе и проведении терапии распространенного неплоскоклеточного НМРЛ следует учитывать, что заболевание на этой стадии неизлечимо. Именно поэтому основными задачами лечения являются увеличение продолжительности жизни больных (одно- и двухлетняя выживаемость), улучшение качества жизни (облегчение симптомов заболевания, профилактика и лечение осложнений терапии), сбалансированность терапевтического эффекта (в том числе выживаемости) и качества жизни пациентов [4, 5].
При НМРЛ выявлена особая немногочисленная подгруппа больных, в опухоли которых обнаружена транслокация гена ALK. Измененный ген кодирует синтез патологического белка, что приводит к патологической активации рецептора ALK на мембране опухолевой клетки и злокачественному прогрессированию. Противоопухолевый эффект кризотиниба вызван блокадой тирозинкиназ внутриклеточного домена активированного рецептора ALK [9]. Уже выделены клинические характеристики, ассоциированные с транслокацией ALK. В ряде работ отмечается, что онкогенная перестройка EML4-ALK чаще регистрируется в аденокарциномах, у некурящих и молодых пациентов. Доказано, что именно EML4-ALK является основным вариантом транслокации ALK при НМРЛ и главным онкогеном для рака легкого [10, 11].
Применение препарата Ксалкори значительно улучшает показатели выживаемости больных ALK-позитивным НМРЛ. Именно Ксалкори стал первым эффективным препаратом в лечении распространенного ALK-позитивного рака легкого [6].
Результаты исследования PROFILE 1014 показали статистически достоверное преимущество кризотиниба перед стандартными режимами химиотерапии по основным оцениваемым аспектам. Так, частота объективного ответа в группе кризотиниба составила 75% (95-процентный доверительный интервал (ДИ) 67–81), в группе химиотерапии – 45% (95% ДИ 37–53). Медиана выживаемости без прогрессирования (ВБП) в группе кризотиниба была на четыре месяца больше – 10,9 месяца. В группе стандартных режимов химиотерапии этот показатель составил семь месяцев. В отличие от группы химиотерапии в группе кризотиниба улучшение качества жизни и снижение симптоматики рака легкого были выражены более значительно [7, 8]. Исследование PROFILE 1014 продемонстрировало преимущество кризотиниба перед химиотерапией в отношении увеличения ВБП и частоты объективного ответа у больных ALK-позитивным НМРЛ. Применение кризотиниба ассоциировалось с улучшением оцениваемых пациентами параметров физического функционирования, симптомов НМРЛ и качества жизни [6].
В рандомизированном клиническом исследовании PROFILE 1007 сравнивали эффективность кризотиниба с эффективностью химиотерапии во второй линии у больных ALK-позитивным НМРЛ. В исследовании участвовали 347 пациентов из стран Европы, Северной и Южной Америки, ряда стран Азиатско-Тихоокеанского региона. В соотношении 1:1 они были рандомизированы в группу кризотиниба (Ксалкори) (n = 173) и группу химиотерапии (n = 174) пеметрекседом (n = 99) или доцетакселом (n = 72). У трех пациентов, случайным образом распределенных в группу химиотерапии, и одного пациента из группы препарата Ксалкори не применялся соответствующий исследуемый метод лечения. Группы были равнозначны по основным факторам прогноза. Согласно полученным данным, частота объективных ответов в группе кризотиниба составила 65% (95% ДИ 58–72), в группе химиотерапии – 20% (95% ДИ 14–26). Эффективность кризотиниба, отмечавшаяся в 66% случаев, достоверно превышала таковую пеметрекседа (29%) и доцетаксела (7%). Исследование показало преимущество кризотиниба (Ксалкори) перед однокомпонентной химиотерапией и по увеличению ВБП. Медиана ВБП в группе препарата Ксалкори составила 7,7 месяца, в группе пеметрекседа – 4,2 месяца, в группе доцетаксела – 2,6 месяца. Анализ основных аспектов продемонстрировал, что наибольшей эффективностью во второй линии терапии больных ALK-позитивным НМРЛ обладает кризотиниб [7, 8, 10].
Результаты перечисленных исследований позволяют сделать вывод, что Ксалкори является препаратом выбора в первой и второй линиях терапии ALK-позитивного НМРЛ [6].
Немаловажен и вопрос переносимости лечения: отсутствие гематологической и негематологической токсичности в рассмотренном клиническом случае позволило сохранить качество жизни и социальный статус пациентки на протяжении всего периода лечения.
Заключение
Следует отметить, что терапия кризотинибом хорошо переносится и приводит к значительному увеличению ВБП и общей выживаемости по сравнению со стандартными схемами химиотерапии.
Кризотиниб признан золотым стандартом лечения пациентов с распространенным ALK-позитивным НМРЛ в первой и второй линиях.
D.Yu. Yukalchuk, D.M. Ponomarenko, Ye.V. Snetkov, T.N. Yukalchuk, A.V. Shevchuk, M.V. Demchenkova, A.V. Shelekhov
District Oncologic Dispensary (Irkutsk)
Contact person: Denis Yuryevich Yukalchuk, dyuyu558@mail.ru
Here, we discuss a clinical case illustrating effects from using crizotinib as a first-line therapy in a patient with ALK-positive non-small cell lung cancer. A targeted therapy with crizotinib prescribed before cancer progression was well tolerated and resulted in significantly increased progression-free survival, total survival compared to basic chemotherapy regimens, and considered as a golden standard for treating patients with advanced stage ALK-positive non-small cell lung cancer.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.