Псориатичеcкий артрит: фокус на таргетную терапию
- Аннотация
- Статья
- Ссылки
- English
Выбор терапии осуществляется с учетом тяжести проявлений заболевания, наличия коморбидных состояний. В настоящее время для лечения псориатического артрита применяют лекарственные средства, относящиеся к разным группам: симптоматические препараты, синтетические и таргетные синтетические базисные противовоспалительные препараты, генно-инженерные биологические препараты. Такое лечение направлено на достижение ремиссии или минимальной активности заболевания, замедление рентгенологического прогрессирования деструктивных процессов в суставах, увеличение продолжительности и качества жизни пациентов, снижение риска развития коморбидных патологий.
Выбор терапии осуществляется с учетом тяжести проявлений заболевания, наличия коморбидных состояний. В настоящее время для лечения псориатического артрита применяют лекарственные средства, относящиеся к разным группам: симптоматические препараты, синтетические и таргетные синтетические базисные противовоспалительные препараты, генно-инженерные биологические препараты. Такое лечение направлено на достижение ремиссии или минимальной активности заболевания, замедление рентгенологического прогрессирования деструктивных процессов в суставах, увеличение продолжительности и качества жизни пациентов, снижение риска развития коморбидных патологий.

Псориатический артрит (ПсА) – хроническое воспалительное заболевание суставов, позвоночника и энтезисов из группы спондилоартритов (СпА), которое обычно развивается у больных псориазом (Пс). Течение ПсА сопровождается различной мультиморбидной патологией.
В настоящее время ПсА рассматривается в качестве компонента псориатической болезни [1].
Выбор терапии зависит от доминанты и активности клинических проявлений ПсА, наличия факторов неблагоприятного прогноза, особенно структурных повреждений суставов и сопутствующих заболеваний.
Целью терапии ПсА являются достижение ремиссии или минимальной активности основных симптомов, замедление рентгенологического прогрессирования деструктивных процессов в суставах, увеличение продолжительности и качества жизни пациентов, а также снижение риска развития коморбидных заболеваний [2].
При всех формах СпА применяют терапевтическую концепцию «лечение до достижения цели» (Treat-to-Target – Т2Т) [2]. Это подразумевает назначение активной противовоспалительной терапии в момент установления диагноза, регулярный и объективный контроль состояния пациента, изменение схемы терапии. Данная стратегия продемонстрировала высокую эффективность при ранних формах ПсА, то есть при длительности течения менее двух лет.
При ПсА применяют нестероидные противовоспалительные препараты (НПВП), глюкокортикостероиды (ГКС), вводимые главным образом внутрисуставно и/или околосуставно (ВСГКС), синтетические базисные противовоспалительные препараты (cБПВП) – метотрексат (МТ), сульфасалазин (ССЗ), лефлуномид (ЛЕФ), циклоспорин А (ЦсА), таргетные синтетические базисные противовоспалительные препараты (тсБПВП) – апремиласт (АПР), тофацитиниб (ТОФА) и современные биологические базисные противовоспалительные препараты (бБПВП) или генно-инженерные биологические препараты (ГИБП). К последним, в частности, относятся ингибиторы фактора некроза опухоли α (TNF-α) – адалимумаб (АДА), голимумаб (ГЛМ), инфликсимаб (ИНФ), цертолизумаба пэгол (ЦЗП), этанерцепт (ЭТЦ), ингибитор интерлейкинов (IL) 12 и 23 устекинумаб (УСТ), ингибитор IL-17А секукинумаб (СЕК).
Медикаментозное лечение прежде всего предполагает назначение НПВП и ВСГКС. Такая терапия способствует уменьшению симптомов артрита, энтезита, спондилита и дактилита. При низкой активности ПсА возможно применение НПВП в виде монотерапии. Следует учитывать, что указанные препараты не оказывают терапевтического воздействия на Пс, не влияют на образование эрозий суставов.
Системные ГКС при ПсА следует использовать с осторожностью, в максимально низких эффективных дозах, поскольку на их фоне может обостриться Пс [3, 4].
При умеренной и высокой активности ПсА, а также наличии факторов неблагоприятного прогноза (эрозии, полиартрит, повышение скорости оседания эритроцитов или уровня С-реактивного белка и/или клинически значимые внесуставные проявления) показаны сБПВП [5].
В случае неэффективности и непереносимости сБПВП применяют ГИБП, которые селективно подавляют биологические эффекты TNF-α, IL-12/23, IL-17А. Внедрение в клиническую практику ГИБП коренным образом изменило парадигму терапии пациентов с ПсА и Пс. Препараты данной группы обеспечивают подавление воспаления как в костно-суставном аппарате, так и в коже, задерживают структурные повреждения суставов. Не так давно в клиническую практику были введены новые эффективные препараты – ингибитор фосфодиэстеразы 4 АПР и ингибитор янус-киназ ТОФА. Они относятся к тсБПВП. Таргетные синтетические базисные противовоспалительные препараты блокируют передачу воспалительного сигнала внутрь клетки, что приводит к модулированию противовоспалительного ответа.
Синтетические базисные противовоспалительные препараты
Метотрексат
Метотрексат имеет наиболее долгую историю применения при ПсА. Его назначают при высокой активности заболевания и неэффективности НПВП. Однако следует учитывать, что сБПВП, включая МТ, неэффективны при аксиальном спондилите и недостаточно эффективны в отношении энтезитов. МТ рекомендуется как препарат первой линии в виде монотерапии или в комбинации с другими препаратами [3]. По мнению ряда исследователей, у пациентов с ПсА метотрексат в дозе 15 мг/сут эффективнее, чем в более низких дозах [6].
Лечение МТ начинают с 10 мг/нед с увеличением дозы на 5 мг каждые две – четыре недели до 25 мг/нед (в зависимости от эффективности и переносимости лечения). Такая терапия способствует уменьшению активности периферического артрита, дактилита. Целесообразно назначение парентеральной (подкожной) формы МТ в связи с большей биодоступностью и меньшим риском возникновения нежелательных реакций (НР) [5].
При назначении МТ обязателен прием фолиевой кислоты в дозе 5–10 мг/нед. К наиболее частым НР относят лейкопению, тромбоцитопению, гепатотоксичность, тошноту, рвоту, афтозный стоматит.
При наличии противопоказаний (или плохой переносимости) следует использовать другие сБПВП.
Сульфасалазин
Сульфасалазин оказывает положительное влияние на периферический артрит и функциональные возможности больных ПсА [7]. Однако данный препарат не способен замедлить прогрессирование деструктивных изменений в суставах [8].
Лечение ССЗ начинают с 500 мг/сут. Еженедельно дозу препарата увеличивают на 500 мг до достижения лечебной дозы – 2 г/сут. В отсутствие эффекта через 12–16 недель ее повышают до 3 г/сут.
На фоне приема ССЗ могут отмечаться повышение уровня трансаминаз в крови, креатинина, снижение количества клеток крови, гастралгии.
При проведении такого лечения рекомендуется принимать до 2–2,5 л воды в день. Это позволит снизить риск камнеобразования.
Лефлуномид
Данный препарат оказывает положительное влияние на воспалительные процессы в суставах и коже при ПсА. В международном двойном слепом рандомизированном контролируемом исследовании TOPAS эффективность ЛЕФ доказана на основании критериев ответа на терапию при ПсА (Psoriatic Arthritis Response Criteria – PsARC), модифицированных критериев Американской коллегии ревматологов 20 (American College of Rheumatology – ACR) и значений индекса тяжести поражения Пс (Psoriasis Area and Severity Index – PASI) [9–11].
Лефлуномид может применяться как в виде монотерапии, так и в комбинации с МТ [12].
Препарат назначают в дозе 20 мг/сут с предшествующей нагрузочной дозой 100 мг/сут в течение трех дней.
Терапия ЛЕФ характеризуется как низкотоксичная.
Однако при применении ЛЕФ могут наблюдаться гепатотоксичность, повышение артериального давления, реже – диарея, тошнота, нейтропения, агранулоцитоз [13].
Циклоспорин А Циклоспорин А эффективен при периферическом артрите и Пс. Доказана эффективность данного препарата в комбинации с МТ и ингибиторами TNF-α [14, 15].
Препарат назначают из расчета 2,5–5 мг/кг/сут, в минимально эффективной дозе – на длительное время, но не более двух лет. Это связано с потенциальным нефротоксическим и гепатотоксическим воздействием, а также с сердечно-сосудистым риском.
Сочетанное применение МТ и ЦсА не рекомендуется из-за высокого риска развития НР.
Генно-инженерные биологические препараты
Всем пациентам с активным ПсА, неэффективностью и/или непереносимостью сБПВП или тсБПВП, не достигшим ремиссии и/или минимальной активности заболевания на фоне терапии указанными препаратами в течение трех – шести месяцев, а также при наличии или появлении эрозий суставов, несмотря на прием сБПВП или тсБПВП, показаны ГИБП [5].
В настоящее время для лечения ПсА в Российской Федерации зарегистрированы ингибиторы TNF-α (АДА, ГЛМ, ИНФ, ЦЗП и ЭТЦ), моноклональные антитела к IL-12/23 (УСТ) и IL-17 (СЕК).
Терапия ГИБП ассоциируется с уменьшением активности артрита, энтезита, дактилита, спондилита и Пс, а также с замедлением рентгенологического прогрессирования изменений в суставах и улучшением функционального состояния больных.
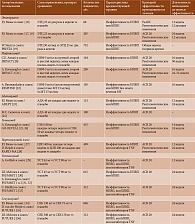
Эффективность этих препаратов доказана в рандомизированных клинических исследованиях (табл. 1) [16–36].
Согласно данным метаанализов и регистров реальной клинической практики, ингибиторы TNF-α демонстрируют сопоставимую эффективность и безопасность при длительном применении [37]. При ПсА препараты данной группы можно использовать как в режиме монотерапии, так и в комбинации с МТ.
При выборе ГИБП следует учитывать ряд факторов: активность периферического артрита, дактилита, спондилита, энтезита и Пс, наличие у пациента сопутствующих заболеваний, перекрестной иммуновоспалительной патологии (сочетание Пс и ПсА с воспалительными заболеваниями кишечника, увеитом), вирусных и инфекционных заболеваний, режим дозирования, способ введения и доступность ГИБП, иммуногенность, возможность применения комбинированной или монотерапии ГИБП, опыта длительного и безопасного использования ГИБП, а также скорость наступления эффекта терапии, планирование беременности, стоимость ГИБП, предпочтения пациента.
В случае тяжелого поражения кожи пациентам показаны МТ, ЦсА, а также ГИБП. Следует учитывать, что при псориазе ЭТЦ менее эффективен, чем другие ингибиторы TNF-α, а УСТ и СЕК более эффективны, чем ингибиторы TNF-α [38, 39].
Наличие переднего увеита у больного ПсА также влияет на выбор ингибитора TNF-α. Низкая частота рецидивов увеита отмечена на фоне лечения ИНФ, АДА, ГЛМ, ЦЗП, но не ЭТЦ.
Эффективность ингибиторов IL-12/23 и IL-17, а также тсБПВП при увеите изучается.
Таргетные синтетические базисные противовоспалительные препараты
Апремиласт
Апремиласт – пероральный ингибитор фосфодиэстеразы 4. Это представитель нового класса малых молекул (блокаторов сигнальных путей). Терапия АПР приводит к увеличению уровня внутриклеточного циклического аденозинмонофосфата (цАМФ). Как следствие, подавляется воспалительная реакция, уменьшается уровень цитокинов (TNF-α, IL-12, IL-23), увеличивается продукция противовоспалительного цитокина IL-10 [40]. Эффективность АПР при ПсА доказана в четырех плацебоконтролируемых исследованиях фазы III PALACE [41–44].
В рандомизированных клинических исследованиях PALACE 1–3 оценивалась эффективность АПР у больных с предшествующим опытом лечения сБПВП и/или ГИБП, при этом допускалось одновременное использование с сБПВП [41–43]. В исследовании PALACE 4 – монотерапии АПР у пациентов, не получавших ранее БПВП и ГИБП [44].
В исследованиях PALACE 1–3 оценивалась эффективность и безопасность длительного лечения АПР [45]. В течение 260 недель получали следующую терапию: плацебо – 495 пациентов, АПР 30 мг дважды в день – 497, АПР 20 мг дважды в день – 500 больных. По окончании лечения среди получавших АПР 30 мг критериев ACR 20, ACR 50 и ACR 70 достигли 67,2, 44,4 и 27,4% больных соответственно.
В 2018 г. опубликованы данные исследований PALACE 1–3 за 156 недель наблюдения, они отражали влияние АПР на энтезит и дактилит [46]. До начала лечения энтезит был выявлен у 945 больных, дактилит – у 633. Энтезит оценивался с помощью MASES (Maastricht Ankylosing Spondylitis Enthesitis Score), дактилит – счета дактилитов. Через 24 недели лечения АПР 30 мг значительно больше, чем при приеме плацебо, уменьшились значения MASES (-1,3 vs -0,9, p < 0,05) и счет дактилитов (-1,8 vs -1,3, p < 0,01). Среди пациентов, получавших АПР 30 и 20 мг в течение 24 недель, большее количество достигло нуля по MASES, чем среди применявших плацебо. В популяции больных, продолжавших лечение АПР в дозе 30 или 20 мг два раза в день в течение трех лет, среднее значение и медиана улучшения MASES оставались неизменными. В частности, на 156-й неделе среднее изменение значений MASES относительно исходных в группе АПР 30 мг составило минус 2,7, в группе АПР 20 мг – минус 2,8.
Через 24 недели среднее значение счета дактилитов в группе АПР 30 мг уменьшилось значительно относительно исходных показателей и показателей в группе плацебо (p ≤ 0,01). Процент изменения счета дактилитов (среднее значение и медиана) в обеих группах АПР оказался незначительно больше, чем в группе плацебо. У пациентов, продолжавших лечение АПР в течение трех лет, среднее значение и медиана счета дактилитов улучшились статистически значимо. Через 156 недель среднее изменение счета дактилитов в группе АПР 30 мг составило минус 3,0, в группе АПР 20 мг – минус 2,4. Кроме того, у 79,6% получавших АПР 30 мг и 73,9% получавших АПР 20 мг количество дактилитов снизилось до нуля.
Полученные результаты убедительно доказывают, что длительное лечение АПР положительно влияет на такие проявления ПсА, как энтезит и дактилит.
В исследованиях PALACE 1–3 также наблюдалось улучшение состояния кожных покровов у больных ПсА. В случаях, когда не менее 3% общей площади были поражены псориазом (Body Surfase Area – BSA), определялся PASI. Через 260 недель лечения АПР 30 мг дважды в день улучшение индекса PASI на 50 и 75% зафиксировано в 65,8 и 43,6% случаев соответственно (табл. 2) [45].
Установлено, что АПР способен значительно уменьшать тяжесть бляшечного Пс у больных ПсА.
Согласно результатам исследований PALACE 1–4, АПР положительно влияет на все проявления ПсА при длительном применении. Однако в исследованиях PALACE не было установлено, как быстро наступает терапевтический эффект лечения в первые 16 недель. Поэтому было проведено исследование эффективности монотерапии апремиластом ACTIVE. В него включали больных ПсА, не принимавших ранее ГИБП, но получавших одни из БПВП. Эффективность лечения оценивалась начиная со второй недели [47].
В рандомизированном клиническом исследовании ACTIVE пациенты были рандомизированы в соотношении 1:1 на группу АПР (n = 110) и группу плацебо (n = 109). Все больные начинали принимать АПР на 24-й неделе вплоть до 52-й недели [48]. Согласно полученным результатам, через две недели ACR 20 в группе АПР достигали чаще, чем в группе плацебо – 16,4% (18/110) против 6,4% (7/109) случаев (р = 0,025). Аналогичная тенденция была отмечена через 16 недель – 38,2% (42/110) против 20,2% (22/109) пациентов соответственно (р = 0,004).
Через две недели в группе АПР выявлено улучшение по таким критериям, как индекс активности заболевания 28 (Disease Activity Score – DAS), число припухших суставов, сумма баллов по опроснику оценки здоровья и индексу инвалидизации (Health Assessment Questionnaire – Disability Index – HAQ-DI), наличие энтезитов и выраженность утренней скованности. Через 16 недель в группе АПР значительно чаще, чем в группе плацебо, наблюдалось уменьшение активности ПсА по DAS 28 (р < 0,0001), HAQ-DI (р = 0,023) и индексу энтезитов (Gladman Enthesitis Index – GEI) (р = 0,001). Улучшение симптомов ПсА отмечалось в течение всего периода лечения. Согласно результатам исследования ACTIVE, АПР, принимаемый в дозе 30 мг два раза в день, способствовал достижению ACR 20, ACR 50 и ACR 70 в 67,1, 36,7 и 21,3% случаев соответственно [48].
Исследователи сделали вывод, что у больных ПсА, не имевших опыта лечения ГИБП, эффект от применения АПР наблюдается уже на второй неделе, к 52-й неделе эффективность терапии нарастает [48].
Побочные эффекты со стороны желудочно-кишечного тракта на фоне АПР могут быть обусловлены снижением уровня цАМФ в клетках слизистой оболочки. У некоторых больных такая терапия может вызвать диарею [49]. Ксантины (например, кофеин), содержащиеся в кофе, чае и некоторых безалкогольных напитках, способны увеличить уровень цАМФ и, следовательно, уменьшить частоту диареи.
На фоне лечения АПР не было зафиксировано повышения риска серьезной оппортунистической инфекции, реактивации туберкулеза. Не так давно сообщалось об успешном применении АПР у пациента с вирусом иммунодефицита человека и гепатитом С [50].
Вследствие низкой токсичности, отсутствия значительных отклонений лабораторных показателей частый мониторинг безопасности при применении АПР не требуется.
АПР показан для лечения пациентов с активным ПсА в отсутствие ремиссии или при невозможности достичь минимальной активности заболевания на фоне сБПВП, пациентов, которым по каким-либо причинам не могут быть назначены сБПВП, ГИБП. Кроме того, при ускользании эффекта на фоне применения ГИБП, а также при наличии коморбидных заболеваний, например инфекций или заболеваний печени. В рекомендациях по лечению ПсА, предложенных экспертами ACR в 2019 г., АПР наряду с МТ, ЛЕФ и ССЗ отнесен к одной группе препаратов – OSM (Oral Small Molecules), или мелкие молекулы для приема per os (таблетированные ЛС). Поэтому его можно назначать пациентам с активным ПсА в первой линии терапии, а не только при неэффективности сБПВП. Данный факт нашел отражение в обновленной версии раздела «Показания» инструкции по применению препарата ОТЕСЛА®, утвержденной Минздравом России 29 января 2019 г. Как следствие, появилась возможность назначать АПР пациентам с коморбидной патологией, ограничивающей применение ряда сБПВП.
Необходимо отметить, что АПР не рекомендуется пациентам с депрессией.
Данный препарат характеризуется хорошей переносимостью. Постоянного мониторинга лабораторных показателей или скрининга на туберкулез до начала и на фоне лечения АПР не требуется.
АПР можно использовать как в виде монотерапии, так и в комбинации с МТ.
Режим применения АПР – по 30 мг два раза в день (утром и вечером) с интервалом 12 часов. Требуется начальное титрование дозы [51, 52].
Тофацитиниб
Тофацитиниб является ингибитором янус-киназ. Препарат зарегистрирован для лечения взрослых пациентов с активным ПсА, не ответивших на лечение одним или несколькими сБПВП. Тофацитиниб оказывает влияние на цитокины, участвующие в патогенезе ПсА, такие как интерферон γ, IL-12, -23, -17 и -22.
В рандомизированных клинических исследованиях фазы III OPAL BROADEN оценивалась эффективность ТОФА в комбинации с сБПВП (в большинстве случаев МТ) по сравнению с плацебо и АДА у 422 больных ПсА [53]. На фоне применения ТОФА основные показатели ПсА и Пс улучшились. Так, через 12 месяцев терапии ТОФА в дозе 5 мг два раза в неделю отмечалось замедление рентгенологического прогрессирования ПсА. Эффективность ТОФА в дозе 10 мг два раза в день была несколько выше. Из серьезных НР следует указать на более высокую частоту развития инфекций, опоясывающего лишая (Herpes Zoster).
При назначении ТОФА требуется скрининг на туберкулез.
В рандомизированном клиническом исследовании OPAL BEYOND доказана эффективность ТОФА у больных, ранее получавших один ингибитор TNF-α и более. В частности, через шесть месяцев ответ по ACR 20 был достигнут в 59,5% случаев [54].
ТОФА в комбинации с другим сБПВП показан пациентам с активным ПсА, при неэффективности и/или непереносимости одного из сБПВП, и/или отсутствии ремиссии или минимальной активности заболевания на фоне лечения, и/или активном дактилите и/или энтезите. ТОФА рекомендуется также пациентам с активным ПсА при первичной или вторичной неэффективности одного или нескольких ГИБП, а также пациентам, которым ГИБП показаны, но не могут быть назначены по каким-либо причинам.
Перед назначением такой терапии требуется скрининг на туберкулез.
Заключение
ПсА является потенциально тяжелым заболеванием. Для него характерно гетерогенное поражение опорно-двигательного аппарата, снижение продолжительности и качества жизни, высокий риск развития коморбидных заболеваний. Это обусловливает необходимость мультидисциплинарного подхода не только к диагностике, но и к терапии.
Лечить больных ПсА с преимущественным поражением опорно-двигательного аппарата должен ревматолог при консультировании дерматовенеролога. При наличии у пациентов с ПсА воспалительных заболеваний кишечника требуется наблюдение гастроэнтеролога/колопроктолога, увеита – офтальмолога.
Выбор терапии ПсА врач должен делать совместно с пациентом.
T.V. Korotayeva, DM, Yu.L. Korsakova, PhD
V.A. Nasonova Research Institute of Rheumatology
Contact person: Tatyana Viktorovna Korotayeva, tatianakorotaeva@gmail.ru
Psoriatic arthritis is a chronic inflammatory disease of the joints, spine and enthesis of spondyloarthritis group. Pathology, as a rule, develops in patients with psoriasis.
The choice of therapy is being made taking into account the severity of the disease, the presence of comorbid conditions. Nowadays, for the treatment of psoriatic arthritis, there are used the drugs belonging to different groups: symptomatic drugs, synthetic and targeted synthetic basic anti-inflammatory drugs, genetically engineered biological drugs. It is aimed at achievement of the remission or minimal activity of the disease, slowing of the x-ray progression of destructive processes in the joints, increase of the duration and quality of patient’ life, reduction of the comorbid pathologies risk.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.